Ano: 2011 Vol. 77 Ed. 5 - Setembro - Outubro - (12º)
Seção: Artigo Original
Páginas: 605 a 610
Efeito in vitro de glicocorticosteróides sobre pólipos nasais
In vitro effect of glucocorticoids on nasal polyps
Autor(es): Fabiana Valera1; María S. Brassesco2; Angel M.Castro-Gamero3; Maria A. Cortez4; Rosane G. P. Queiroz5; Luiz G. Tone6; Wilma T. Anselmo-Lima7
Palavras-chave: corticosteróides, NF-kappa B, pólipos nasais, sinusite.
Keywords: adrenal cortex hormones, nasal polyps, NF-kappa B, sinusitis.
Resumo:
Glicocorticoides são considerados a principal opção terapêutica para polipose nasossinusal, mas seus efeitos estão sendo descobertos apenas recentemente. Objetivo: Avaliar se proprionato de fluticasona (FP) inibe "in vitro" o processo inflamatório induzido por TNF-alfa, e se NF-kappaB está associado a esta inibição. Forma de Estudo: Experimental "in vitro". Materiais e Métodos: Fibroblastos de pólipos nasais foram cultivados por 24 horas. Três concentrações diferentes de FP (1, 10 e 100nM, além do TNF-alfa) foram comparados a controles negativo (sem aditivo) e posi¬tivo (TNF-alfa). Expressão gênica (RTQ-PCR) concentração proteica (ELISA) de VCAM-1, ICAM-1, eotaxin e RANTES foram medidos, assim como a translocação nuclear de NF-kappaB. Resultados: TNF-alfa aumentou significativamente a concentração proteica e expressão gênica de todas molé¬culas estudadas, assim como a translocação nuclear de NF-kappaB, quando comparado ao controle negativo. O FP diminuiu estes parâmetros numa forma dose-dependente, diferente estatisticamente do controle positivo até 100nM. Conclusões: O FP extensivamente inibiu os recrutadores inflamatórios, em níveis proteicos e gênicos, confirmando a habilidade dos glicocorticoides em modular o processo inflamatório na polipose nasossinusal. Esta inibição esteve associada à diminuição da translocação nuclear de NF-kappaB, demonstrando que este é um importante mecanismo de ação dos glicocorticoide na polipose nasossinusal.
Abstract:
Glucocorticoids are considered the main treatment option for nasal polyps, but their effect is only recently being understood. Aim: To evaluate whether fluticasone propionate (FP) inhibits the inflammatory process induced by TNF-alpha in vitro, and to assess if NF-kappaB is associated to this inhibition. Study Design: Experimental in vitro study. Materials and Methods: Nasal polyp fibroblasts were cultured during 24 hours. Three different concentrations of FP (1, 10 and 100 nM, added to TNF-alpha) were compared to negative (without additive) and positive (TNF-alpha) controls. Gene expression (RTQ-PCR) and protein concentration (ELISA) of VCAM-1, ICAM-1, eotaxin and RANTES were measured, as well as the nuclear translocation of NF-kappaB. Results: TNF-alpha significantly increased protein concentration and RNA expression of all the studied molecules, as well as the nuclear translocation of NF-kappaB, when compared to the negative control. FP decreased these parameters in a dose-dependent manner, statistically different from positive control up to 100nM. Conclusions: FP extensively inhibited inflammatory recruiters, at both protein and RNA levels, confirming the ability of glucocorticoids to modulate the inflammatory process in nasal polyps. This inhibition was associated to decreased NF-kappaB nuclear translocation, demonstrating that this is an important mechanism of glucocorticoids action for nasal polyps.
![]()
INTRODUÇÃO
Pólipos nasais (PN) representam uma doença inflamatória que afeta primariamente a mucosa nasosinusal1,2. A inflamação é geralmente induzida por citocinas pró-inflamatórias, tais como TNF-α (fator de necrose tumoral alfa) e IL-1β (interleucina 1β); e mediada por fatores de transcrição (FT), tais como NF-κB (fator nuclear-κB) e AP-1 (proteína ativadora-1)3. Inicialmente, os FT se translocam para dentro do núcleo e induzem a expressão de moléculas pró-inflamatórias nas células de estruturas nasais (fibroblastos, células epiteliais e endoteliais)3-7, que, por sua vez, produzem citocinas e moléculas de adesão (incluindo eotaxina), RANTES (reguladas sob ativação normalmente expressa por linfócitos T, e secretadas), ICAM-1 (molécula de adesão intercelular-1), VCAM-1 (molécula de adesão celular vascular-1), seletina-E e seletina-P), que induzirão a migração de células inflamatórias (tai com linfócitos T, eosinófilos, mastócitos e neutrófilos) em direção ao alvo7-9. Uma vez na mucosa nasal, as células circulantes promovem dano tecidual8,10-12. Bachert et al.2 publicaram que a desregulação de quimiocinas e a produção de moléculas de adesão podem ser importantes na promoção da quimiotaxia local de eosinófilos.
De acordo com o Consenso Europeu sobre Rinossinusite e Pólipos Nasais, de 2007 (European Position Paper on Rhinosinusitis and Nasal Polyps 2007)11, e outros pesquisadores12-15, glicocorticosteroides tópicos (GT) representam a pedra angular no tratamento de PN. Entretanto, a taxa de sucesso dos GT varia de 60,9 a 80%12,13,16. As propriedades anti-inflamatórias dos GT ocorrem devido à sua ligação ao receptor de glicocorticosteroide (RG); o complexo GT-RG inibe outros FT, tais como o NF-κB, um fenômeno conhecido como transrepressão4,17-19. A repressão de NF-κB irá, finalmente, inibir a expressão de algumas citocinas, como TNF-α, IL-1, IL-8 (interleucina-8)e ICAM-117. A transrepressão entre os GT e os FT é recíproca, e o NF-κB17é também capaz de reprimir os receptores de glicocorticoides; que poderiam, pelo menos em parte, induzir a resistência a GT em alguns pacientes.
Recentemente20, nosso grupo observou que o tratamento in-vivo com budesonida leva a uma significativa melhora nos sintomas e na redução dos pólipos nasais, visto à endoscopia. Apesar dessa significativa melhora clínica, somente um paciente teve remissão completa. Além disso, observamos que os pacientes com resposta desfavorável ao tratamento clínico tiveram níveis mais altos de NF-κB, ICAM-1 e IL-1β do que antes do tratamento21. Uma vez que o NF-κB induz a transcrição de ambos IL-1β e ICAM-1, elaboramos a hipótese de que o NF-κB poderia ser considerado um mediador-chave no início dos PN e resistência a GT.
Assim sendo, o objetivo do presente estudo foi observar se o TNF-alfa induz a expressão de recrutadores inflamatórios em fibroblastos derivados de pólipos, e se o propionato de fluticasona (PF) inibiria essa resposta inflamatória in vitro. Além disso, o mecanismo pelo qual esse glicocorticóide age foi avaliado por meio dos níveis proteicos e de mRNA com relação à VCAM-1, ICAM-1, eotaxina e RANTES, assim como pela translocação nuclear de NF-κB.
MATERIAIS E MÉTODOS
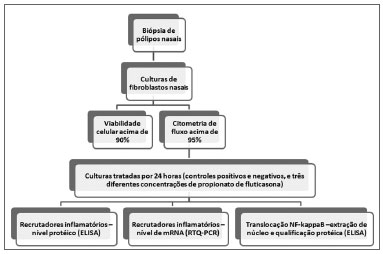
O conteúdo do estudo está resumido na Figura 1. Avaliamos amostras de seis pacientes indicados para cirurgia após falhado tratamento clínico. Para cada caso a presença bilateral de PN inflamatórios foi confirmada por TC e por endoscopia nasal. Os pacientes que tinha doenças sistêmicas, como discinesia ciliar, fibrose cística, DREA(doença respiratória exacerbada por aspirina) ou asma grave, foram excluídos. Antes da cirurgia, todos os pacientes foram mantidos sem qualquer medicação por um período de um mês. O presente estudo foi aprovado pelo Comitê de Ética da instituição (processo número 4374/2007).
Figura 1. Fluxograma do protocolo do estudo.
Cultura celular
Durante o procedimento cirúrgico, foi feita uma biópsia do pólipo. Os pólipos foram cortados em fragmentos de 0,5mm por meio de um bisturi e os fragmentos foram então desagregados com colagenase tipo IV durante 2 horas. Após tratamento enzimático, as células foram centrifugadas e a solução com colagenase foi removida e substituída por um meio de cultura HAM-F10 (complementado com penicilina a 1%, estreptomicina a 1%, e soro fetal a 20%), e cultivada a 37ºC em uma atmosfera com 5% de CO2.
Após chegar a 90% de confluência (um milhão de células/frasco), as células foram tripsinizadas e o componente fibroblasto foi confirmado por meio de citometria, seguindo o protocolo de Saalbach et al.22.
Culturas de pólipos contendo pelo menos 90% de fibroblastos foram então multiplicados em 5 diferentes frascos, e após 24 horas foram tratados da seguinte forma: controle negativo (sem aditivo), controle positivo (TNF-α 25ng/mL), PF1 (TNF-α 25ng/mL ePF 1nM/ 0,45 µg/mL), PF10 (TNF-α 25ng/mL ePF 10nM/ 4,5 µg/mL) ePF100 (TNF-α 25 ng/mL ePFa 100nM/ 45 µg/mL). Esses frascos e suas duplicações foram incubados a 37 ºC em CO2 a 5% de atmosfera úmida por mais 24 horas.
As células tratadas foram subsequentemente tripsinizadas e armazenadas em Trizol® (para o estudo de RNAs),e em DMSO (para extração do núcleo) a -80ºC. O meio de cultura foi armazenado a -20 ºC para o estudo por ELISA das moléculas secretadas. A viabilidade celular foi confirmada em mais de 90% pela exclusão por azul Trypan.
Elisa
A concentração proteica de eotaxina, RANTES, sICAM-1 e sVCAM-1 foram quantificadas em meio de cultura pelo exame de ELISA, de acordo com as instruções do fabricante (Biosource, CA, USA).
Para normalizar os resultados, a quantificação da proteína específica foi corrigida de acordo com o valor de proteína total medido pelo método de Bradford, como ditado pelo fabricante do corante: Protein Assay-Bio Rad.
PCR
O RNA foi extraído por meio de Trizol®, e os cDNAs foram obtidos pelo kit de Alta Capacidade de cDNA. Foram usados os primers TaqMan® (Applied Biosystems): Hs00164932_m1 (ICAM-1), Hs00237013_m1 (eotaxina), Hs00174575_m1 (RANTES) e Hs00365486_m1 (VCAM-1), além do housekeeping Hs00266705_g1 (GAPDH). A concentração do primer foi de 900 nM e a concentração da sonda TaqMan foi de 300nM.
A amostra foi diluída para 1:10, e 9 µL da diluição foi acrescentada a 10 µL do Universal PCR Master Mix (Applied Biosystems) e 1 µL da sonda. Usamos o sistema 7500Real-Time PCR System® para análise (PE Applied Biosystems).
Cada amostra foi testada em duplicidade. Em todas as reações, amplificamos em paralelo os mesmos controles negativos e calibradores, para determinar a eficiência de todos os experimentos.
Determinamos o valor linear de 0,1 para o estudo genético. A expressão relativa do gene foi quantificada usando-se o método 2-ΔΔCT e comparado à expressão GAPDH na mesma amostra. O valor normalizado de cada amostra foi então dividido pelo calibrador, cujo valor da expressão foi presumido em 1.
Extração do núcleo
Para avaliar a translocação nuclear do NF-κB, as membranas celulares foram rompidas e os núcleos foram isolados da seguinte forma: as células foram centrifugadas a 16000g durante 5 minutos e lavadas duas vezes em PBS (tampão de fosfato no soro fisiológico) gelada. Em seguida, a pelota foi incubada com tampão gelado A (10mmol/L HEPES; pH7,9; 10mmol/L KCl; 0,1mmol/L EDTA; 0,1mmol/L EGTA; 1mmol/L DTT; 1mg/L aprotinina; 1mg/L leupeptina,e 1mg/L pepstatina A) durante 15 minutos. Após a lise da membrana celular, acrescentamos 5µL 0,1% NP-40 à solução que foi então vigorosamente agitada por 1 minuto. A solução, foi então centrifugada a 20800g durante 5 minutos a 4ºC. O sobrenadante (correspondente à fração citoplasmática) foi descartado e as pelotas nucleares foram suspensas em 50µL de tampão B gelado (20mmol/L HEPES, pH 7,9; 420mmol/L NaCl; 0,1mmol/L EDTA; 0,1mmol/L EGTA; 1mmol/L PMSF; 1mmol/L DTT; 1mg/L aprotinina; 1mg/L leupeptina, e 1mg/Lpepstatina). Essa nova solução foi mantida a 4ºC durante 30 minutos com agitação periódica e centrifugada a 20800g durante 5 minutos a 4ºC. A quantificação proteica do NF-κB foi feita nessa solução final do núcleo com o uso do ELISA, como descrito acima.
Análise estatística
Os resultados foram analisados pelo teste t de Student para amostras pareadas, com nível de significância estabelecido em p<0,05.
RESULTADOS
Caracterização das culturas de fibroblastos
Após avaliar a viabilidade das células, uma fração foi submetida à citometria de fluxo para confirmar se as culturas estavam especificamente compostas por fibroblastos. Cinco delas exibiram mais de 98% de positividade para CD90 e menos de 1% estavam positivas para CD34; confirmando que eram quase exclusivamente fibroblastos. O restante da amostra apresentou somente 92% de células positivas para CD90 e foi retirada do estudo.
Recrutadores inflamatórios - nível proteico
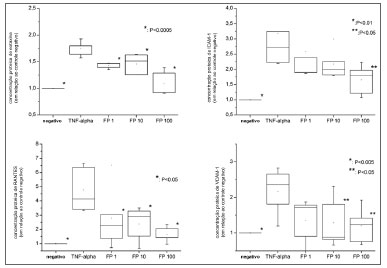
Quando comparado ao controle negativo, TNF-α a 25ng/mL, aumentou significativamente as concentrações proteicas para ICAM-1 (3,17 vezes ± 0,77;p=0,0075), VCAM-1 (2,17 vezes ± 0,66; p=0,0173), eotaxina (1,74 vezes ± 0,14;p=0,0003) e RANTES (4,78 vezes ± 1,57;p=0,0327) (Figuras 2a a 2d). O PF reduziu os recrutadores inflamatórios de forma dose-dependente para todas as proteínas estudadas (Figura 2). A redução foi significativamente diferente do controle positivo em todas as concentrações de PF para eotaxina (p=0,0003) e RANTES (p=0,0327), para os tratamentos por PF de 10 nM e 100nM para sVCAM-1 (p=0,0402) e 100 nM de PF para sICAM-1 (p=0,0476).
Figura 2. Níveis proteicos de eotaxina, RANTES, VCAM-1 e ICAM-1 medidos por meio do ensaio ELISA. Todos os valores relativos foram comparados a controle negativo (considerado como 1,0).
Além disso, as concentrações proteicas de sVCAM-1 e RANTES foram significativamente semelhantes ao controle negativo para todas as concentrações de PF. Contrastando a isso, os níveis de sICAM-1 foram significativamente mais altos do que os controles negativos para todas as concentrações (p=0,0175 para FP 100nM) enquanto os níveis de eotaxina foram significativamente mais altos do que os controles negativos com PF nas concentrações de 1 e 10nM (p<0,0001 para 1nM e 0,0057 para 10 nM), mas alcançaram similaridade na concentração de 100nM.
Recrutadores inflamatórios - nível de mRNA
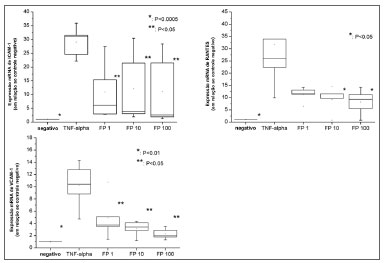
As expressões de ICAM-1, VCAM-1, RANTES e eotaxina foram analisadas por meio da RTQ-PCR. Infelizmente, a expressão de eotaxina só esteve presente quando os fibroblastos foram expostos ao TNF-α, que prejudicou as análises estatísticas.
O TNF-α aumentou significativamente a expressão de ICAM-1 (29,09 vezes ± 5,60; p=0,0004); VCAM-1 (10,22 vezes ± 3,72; p=0,0052) e de RANTES (31,62 vezes ± 8,72; p=0,0312) no mRNA (Figura 3). Além disso, os testes com RTQ-PCR revelaram que o PF reduziu suas expressões de maneira progressiva (Figura 3): a redução foi significativamente diferente daquela dos controles positivos para todas as concentrações de PF no tocante a sVCAM-1 (p=0,0488) e sICAM-1 (p=0,0368) e a concentrações mais altas do que 10nM dePFpara RANTES (p=0,0439).
Figura 3. Expressão no mRNA (por RTQ-PCR) de VCAM-1, ICAM-1 e RANTES. Todos os valores relativos foram comparados a controle negativo (considerado como 1,0).
Também, a expressão no mRNA foi semelhante àquela dos controles negativos em todas as concentrações para sICAM-1. Em contraste, as expressões de sVCAM-1 e RANTES foram significativamente mais altas quando comparadas àquelas dos controles negativos para todas as concentrações de PF estudadas.
Translocação nuclear de NF-kB
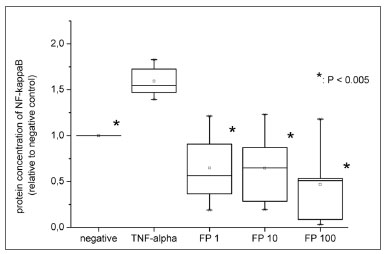
Finalmente, para investigar uma possível relação entre o NF-κB e maior expressão de recrutadores inflamatórios, investigamos se o TNF-α e o PF interfeririam na translocação nuclear de NF-κB. Para tal propósito, as células foram submetidas à extração nuclear e a concentração proteica de NF-κB foi medida na fração nuclear.Os níveis nucleares desse fator transcritivo também aumentaram significativamente quando os fibroblastos foram expostos ao estímulo positivo (1,59 vez ± 0,18, p=0,0018) (Figura 4).
Figura 4. Níveis proteicos de NF-κB nuclear medido pelo ensaio ELISA. Todos os valores relativos foram comparados a controle negativo (considerado 1,0).
Também, avaliamos se o PF reduziu ambas as expressões no mRNA da expressão proteica de moléculas de adesão e quimiocinas devido à inibição do NF-κB. O experimento do ELISA mostrou que o PF reduziu significativamente a translocação do NF-κB, mesmo nas concentrações mais baixas (1nM) (p=0,0022). Os níveis de NF-κB nuclear foram estatisticamente semelhantes àqueles dos controles negativos para todas as concentrações de PF (Fig.3).
DISCUSSÃO
Os fibroblastos dos pólipos nasais, quando induzidos por uma variedade de estímulos, são capazes de produzir mediadores pró-inflamatórios. Meyer et al.23 compararam a capacidade do TNF-α, IL1-β ou do IFN-γ de aumentar a expressão do RANTES nos fibroblastos dos pólipos nasais, e observaram que o TNF-α foi um importante estímulo pró-inflamatório. Baseado em tal estudo, escolhemos o TNF-α como o controle positivo para nosso experimento. Observamos que os fibroblastos secretam naturalmente VCAM-1, ICAM-1, eotaxina e RANTES no meio de cultura; e que o TNF-α é capaz de significativamente intensificar a produção desses mediadores em culturas de fibroblastos.
Silvestri et al.7 avaliaram o efeito de TNF-α e IL-4 sobre a expressão de ICAM-1 e VCAM-1 por citometria de fluxo e sobre a secreção de eotaxina por ELISA em fibroblastos de pólipos nasais. Os autores observaram um aumento significativo na expressão de ICAM-1 e de eotaxina 24 horas após exposição a concentrações progressivamente maiores de TNF-α, apesar dos níveis de VCAM-1 terem permanecido estáveis. Da mesma forma, Yoshifuku et al.24 observaram o efeito de TNF-α e IL-4 sobre a expressão de eotaxina, RANTES e VCAM-1 em fibroblastos de pólipos nasais usando ELISA, e demonstraram que o TNF-α, na dose de 10 ng/mL durante 24 horas foi capaz de induzir a secreção de RANTES e VCAM-1, mas não de eotaxina.
Ohori et al.25 relataram que a expressão de VCAM-1 (avaliado por meio de ELISA, citometria de fluxo e RT-PCR) em fibroblastos nasais foi induzida por TNF-α de forma dose-dependente, com pico em aproximadamente 10 ng/mL, e reduzido na dose seguinte de avaliação, 100 ng/mL. O TNF-α também induziu a translocação nuclear e, consequentemente, ativou o NF-κB.
Acreditamos que as diferenças em expressão de algumas quimiocinas ou moléculas de adesão podem ser associadas ao uso de diferentes concentrações de TNF-α, ou a diferentes técnicas para a avaliação da concentração proteica e expressão gênica. Entretanto, há certa concordância com relação a esse fato que, em geral, o TNF-α induz a expressão de mRNA e da produção proteica de recrutadores inflamatórios. Os dados obtidos no presente estudo estão de acordo com esse padrão de expressão. Também observamos que o TNF-α aumentou de forma significativa a translocação nuclear de NFκB, confirmando que esse é um importante mecanismo de indução de mediadores pró-inflamatórios em PN, como publicado por Ohori et al.25.
Assim, tanto nossos resultados como outros previamente publicados na literatura demonstram que o principal mecanismo através do qual o TNF-α induz a produção de citocinas é através da ativação de FTs. Os FTs, quando ativados, translocam-se para o núcleo e interagem com o DNA celular, aumentando a transcrição de genes pró-inflamatórios.
O mecanismo de ação dos GT ainda não foi completamente elucidado; entretanto, acredita-se que seu principal efeito anti-inflamatório seja mediado pela inibição de FT18,19.
Observamos que o PF age nos fibroblastos de pólipos nasais, reduzindo a secreção proteica e a expressão gênica de moléculas inflamatórias. Essa redução na secreção proteica foi significativamente diferente dos controles positivos para RANTES e eotaxina nas concentrações iniciais e em concentrações mais altas de PF para ICAM-1. A produção proteica de VCAM-1 e RANTES permaneceu bastante semelhante àquela observada para os controles negativos em todas as concentrações de PF, mesmo apesar da eotaxina e ICAM-1 apresentaram concentrações significativamente mais altas do que os níveis dos controles até o tratamento com 100nM de PF.
O PF também reduziu significativamente a expressão gênica de ICAM-1 e VCAM-1 em todas as concentrações estudadas, enquanto o RANTES esteve significativamente reduzido após o tratamento com 10nM. Entretanto, a expressão de RANTES esteve significativamente mais alta quando comparada aos controles negativos até a concentração de 100nM de PF.
Os resultados desse trabalho estão de acordo com aqueles relatados por Silvestri et al.7, que observaram que o PF inibiu a secreção de eotaxina pelos fibroblastos, começando com uma dose baixa de 1 nM; enquanto inibiu aquela de ICAM-1 somente sob doses mais altas (10 nM). Meyer et al.23 estudaram o efeito da betametasona e da hidrocortisona sobre fibroblastos nasais e demonstraram que essas drogas foram também eficazes na inibição da expressão de RANTES.
O PF também inibiu significativamente a translocação nuclear de NF-κB em fibroblastos a uma concentração bastante baixa. Esse feito sobre o NF-κB nos fibroblastos de pólipos nasais já havia sido sugerido por Silvestri et al.7 e por nosso grupo21, apesar desse ser o primeiro estudo in vitro a confirmar o efeito do PF sobre a translocação de NF-κB em pólipos nasais.
O mecanismo de ação dos GC tópicos sobre PN precisa ser melhor reconhecido para se melhorar a eficácia do tratamento clínico de pólipos nasais. Novos GTs, que inibam especificamente os FTs, ou inibidores de FTs, parecem ser o caminho mais racional para se encontrar novas abordagens terapêuticas para essa doença.
CONCLUSÕES
O TNF-alfa induziu de forma significativa a produção de mediadores pró-inflamatórios, tanto em nível de mRNA quanto de proteína, em culturas de fibroblastos de pólipos nasais.
Também, o PF reduziu consideravelmente a expressão de mRNA e proteína de todos os mediadores pró-inflamatórios investigados nesse estudo. Foi relatado que essa inibição do processo inflamatório reduz a translocação nuclear do NF-kappaB.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Pawankar R. Nasal polyposis: an update: editorial review. Curr Opin Allergy Clin Immunol. 2003;3(1):1-6.
2. Bachert C, Van Bruaene N, Toskala E, Zhang N, Olze H, Scadding G, et al. Important research questions in allergy and related diseases: 3-chronic rhinosinusitis and nasal polyposis - a GALEN study. Allergy. 2009;64(4):520-33.
3. Adcock IM, Ito K, Barnes PJ. Glucocorticoids: effects on gene transcription. Proc Am Thorac Soc. 2004;1(3):247-54.
4. Adcock IM, Caramori G. Cross-talk between pro-inflammatory transcription factors and glucocorticoids. Immunol Cell Biol. 2001;79(4):376-84.
5. Jahnsen FL, Haye R, Gran E, Brandtzaeg P, Johansen FE. Glucocorticosteroids inhibit mRNA expression for eotaxin, eotaxin-2, and monocyte-chemotactic protein-4 in human airway inflammation with eosinophilia. J Immunol. 1999;163(3):1545-51.
6. Takeno S, Hirakawa K, Ueda T, Furukido K, Osada R, Yajin K, et al. Nuclear factor-kappa B activation in the nasal polyp epithelium: relationship to local cytokine gene expression. Laryngoscope. 2002;112(1):53-8.
7. Silvestri M, Sabatini F, Scarso L, Cordone A, Dasic G, Rossi GA. Fluticasone propionate downregulates nasal fibroblast functions involved in airway inflammation and remodeling. Int Arch Allergy Immunol. 2002;128(1):51-8.
8. Watanabe K, Shirasaki H, Kanaizumi E, Himi T. Effects of glucocorticoids on infiltrating cells and epithelial cells of nasal polyps. Ann Otol Rhinol Laryngol. 2004;113(6):465-73.
9. Shin SH, Park JY, Jeon CH, Choi JK, Lee SH. Quantitative analysis of eotaxin and RANTES messenger RNA in nasal polyps: association of tissue and nasal eosinophils. Laryngoscope. 2000;110(8):1353-7.
10. Mladina R, Clement P, Lopatin A, Mann W, Passali D. International Consensus on Nasal Polyposis 2002-2004. Eur Arch Otorhinolaryngol. 2005;262(6):519-21.
11. Fokkens W, Lund V, Mullol J. European position paper on rhinosinusitis and nasal polyps 2007. Rhinol Suppl. 2007(20):1-136.
12. Rinia AB, Kostamo K, Ebbens FA, van Drunen CM, Fokkens WJ. Nasal polyposis: a cellular-based approach to answering questions. Allergy. 2007;62(4):348-58.
13. Pujols L, Mullol J, Benitez P, Torrego A, Xaubet A, de Haro J, et al. Expression of the glucocorticoid receptor alpha and beta isoforms in human nasal mucosa and polyp epithelial cells. Respir Med. 2003;97(1):90-6.
14. Tuncer U, Soylu L, Aydogan B, Karakus F, Akcali C. The effectiveness of steroid treatment in nasal polyposis. Auris Nasus Larynx. 2003;30(3):263-8.
15. Almawi WY, Melemedjian OK. Negative regulation of nuclear factor-kappaB activation and function by glucocorticoids. J Mol Endocrinol. 2002;28(2):69-78.
16. Henriksson G, Norlander T, Forsgren J, Stierna P. Effects of topical budesonide treatment on glucocorticoid receptor mRNA down-regulation and cytokine patterns in nasal polyps. Am J Rhinol. 2001;15(1):1-8.
17. Liberman AC, Druker J, Perone MJ, Arzt E. Glucocorticoids in the regulation of transcription factors that control cytokine synthesis. Cytokine Growth Factor Rev. 2007;18(1-2):45-56.
18. Scheinman RI, Gualberto A, Jewell CM, Cidlowski JA, Baldwin AS Jr. Characterization of mechanisms involved in transrepression of NF-kappa B by activated glucocorticoid receptors. Mol Cell Biol. 1995;15(2):943-53.
19. Necela BM, Cidlowski JA. Mechanisms of glucocorticoid receptor action in noninflammatory and inflammatory cells. Proc Am Thorac Soc. 2004;1(3):239-46.
20. Valera FC, Anselmo-Lima WT. Evaluation of efficacy of topical corticosteroid for the clinical treatment of nasal polyposis: searching for clinical events that may predict response to treatment. Rhinology. 2007;45(1):59-62.
21. Valera FC, Queiroz R, Scrideli C, Tone LG, Anselmo-Lima WT. Expression of transcription factors NF-kappaB and AP-1 in nasal polyposis. Clin Exp Allergy. 2008;38(4):579-85.
22. Saalbach A, Haustein UF, Anderegg U. A ligand of human thy-1 is localized on polymorphonuclear leukocytes and monocytes and mediates the binding to activated thy-1-positive microvascular endothelial cells and fibroblasts. J Invest Dermatol. 2000;115(5):882-8.
23. Meyer JE, Berner I, Teran LM, Bartels J, Sticherling M, Schröder JM, et al. RANTES production by cytokine-stimulated nasal fibroblasts: its inhibition by glucocorticoids. Int Arch Allergy Immunol. 1998;117(1):60-7.
24. Yoshifuku K, Matsune S, Ohori J, Sagara Y, Fukuiwa T, Kurono Y. IL-4 and TNF-alpha increased the secretion of eotaxin from cultured fibroblasts of nasal polyps with eosinophil infiltration. Rhinology. 2007;45(3):235-41.
25. Ohori J, Ushikai M, Sun D, Nishimoto K, Sagara Y, Fukuiwa T, et al. TNF-alpha upregulates VCAM-1 and NF-kappaB in fibroblasts from nasal polyps. Auris Nasus Larynx. 2007;34(2):177-83.
1. PhD, MD. (Professora, Doutora da FMRP - USP).
2. PhD (Jovem pesquisadora associada ao Laboratório de Pediatria da FMRP-USP).
3. Geneticista (Mestrando no Laboratório de Pediatria da FMRP-USP).
4. Geneticista (Doutora pelo Laboratório de Pediatria da FMRP).
5. PhD (Coordenadora do Laboratório de Pediatria da FMRP).
6. PhD, MD. (Professor Titular da FMRP).
7. PhD, MD. (Professora Associada da FMRP).
Escola de Medicina de Ribeirão Preto - Universidade de São Paulo.
Endereço para correspondência:
Fabiana C. P. Valera
Av. Bandeirantes, 3900 - 12º andar
Ribeirão Preto - SP. CEP: 14049-900
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 24 de fevereiro de 2011. cod. 7595
Artigo aceito em 4 de junho de 2011.
Apoio financeiro: FAPESP (processo número: 07/50359-4).