Ano: 2011 Vol. 77 Ed. 5 - Setembro - Outubro - (6º)
Seção: Artigo Original
Páginas: 573 a 576
Mutações em DNA mitocondrial, hipoacusia e tratamento de mexicanos com aminoglicosídeos
mtDNA mutations, hearing loss and aminoglycoside treatment in Mexicans
Autor(es): Meza G1; Torres-Ruíz NM2; Tirado-Gutiérrez C3; Aguilera P4
Palavras-chave: aminoglicosídeos, dna mitocondrial, genes, hipoacusia, rna.
Keywords: aminoglycosides, dna, mitochondrial, genes, hearing loss, rna.
Resumo:
Derivados de aminoglicosídeos e estreptomicina são comumente utilizados para tratar tuberculose e outras infecções mais resistentes; esses medicamentos podem alterar a função vestibular e/ou auditiva. Mutações no DNA mitocondrial têm sido associadas à hipersensibilidade a aminoglicosídeos; não há estudos conduzidos com mexicanos, que são muito predispostos a tais alterações, uma vez que aminoglicosídeos têm sido exageradamente prescritos há anos, sem associações à doença sendo tratada. Objetivo: investigamos mutações "hot spot" previamente descritas como causas de alterações no ouvido interno. Métodos: Mutações hot spot no gene 12S rRNA e gene SerinatRNA (UCN) foram triados pela PCR-RFLP e sequenciados em 65 indivíduos sujeitos a exames audiométricos e vestibulares. Desenho do estudo: Experimental. Resultados: 32 indivíduos com funções auditiva e vestibular normais, e 33 indivíduos com doenças auditivas. Não encontramos nenhuma das mutações previamente relatadas como associadas à hipersensibilidade aos aminoglicosídeos, ou perda auditiva não-sindrômica. Dois pacientes com hipoacusia que haviam sido tratados com estreptomicina tinham a variante T1189C na região 12S rRNA. Conclusão: Mutações associadas à hipoacusia em outras etnias não foram encontradas em mexicanos. Entretanto, a variante T1189C é possivelmente uma mutação associada à hipersensibilidade a aminoglicosídeos, e esteve presente em dois pacientes.
Abstract:
Streptomycin and aminoglycoside derivatives are commonly used to treat tuberculosis and other stubborn infections; these drugs may alter auditory and/or vestibular function. Mutations in mitochondrial DNA have been associated with hypersensitivity to aminoglycosides; no studies have been conducted in Mexicans, which are very prone to such alterations because aminoglycosides have been prescribed carelessly for many years, irrespective of the ailment to be treated. Aim: We investigated "hot spot" mutations described previously as causing inner ear alterations. Methods: Hot spot mutations at the 12S rRNA gene and the tRNA Serine (UCN) gene were screened by PCRRFLP and sequencing in 65 subjects undergoing audiological and vestibular testing. Study Design: Experimental. Results: 32 individuals had healthy auditory and vestibular function, whereas 33 subjects had auditory affections. We found none of the previously reported mutations related to aminoglycoside hypersensitivity, or non-syndromic hearing loss. Two hearing-impaired patients that had been treated with streptomycin had the T1189C variant of the mitochondrial 12S rRNA region. Conclusion: Mutations related to hearing loss in other ethnic backgrounds were not found in Mexicans. However, the T1189C variant is possibly a putative mutation related to aminoglycoside hypersensitivity and was present in 2 patients.
![]()
INTRODUÇÃO
Surdez é uma as principais doenças da humanidade. No México, cinco de cada 1.000 recém-nascidos têm surdez congênita, contrastando com 1 para cada 1.000 recém-nascidos surdos em todo o mundo1. Entre os primeiros, 25% são geneticamente determinados, 25% têm origem não-genética, e a etiologia é desconhecida nos 50% restantes. Surdez pode ser sindrômica, quando um ou mais sistemas além do órgão auditivo é (são) afetado (s); em hipoacusia não-sindrômica, somente o sistema auditivo é afetado (surdez pura). Hipoacusia não-sindrômica é frequentemente herdada da mãe, indicando que alterações genéticas ocorrem no DNA mitocondrial (mtDNA). Estruturas do ouvido médio são muito sensíveis a lesões por causa de suas específicas exigências energéticas fisiológicas (transportadores de íons e canais)2. Uma causa silenciosa e perigosa de surdez não-sindrômica ocorre quando o mtDNA adquire alta sensibilidade a aminoglicosídeos (família da estreptomicina); essas drogas são frequentemente utilizadas em infecções resistentes, tais como tuberculose, que não respondem a outros antibióticos3.
Os aminoglicosídeos afetam principalmente as moléculas envolvidas na síntese proteica; eles inibem o início da síntese, interagindo com o sítio no qual a região do anticódon tRNA (geralmente metionina do tRNA) entra em contato com o sítio ribossomal do RNA. Esse mecanismo já foi comprovado no rRNA 16S bacteriano e, provavelmente, ocorre no rRNA mitocondrial 12S 4,5.
A surdez não-sindrômica associada à região 12S do rRNA já foi estudada em vários grupos étnicos, e possíveis mutações já foram descritas6,7, são elas: T961insC, T961C e T961+C(n)ins em pacientes chineses8 e famílias italianas9; T1095C e C1494T em pacientes chineses10, espanhóis11 e em famílias espanholas12; e A1555G em pacientes coreanos13, japoneses14, chineses15, e em famílias italianas16. A mutação no gene A74445G tRNA Serina(UCN), também relatada na surdez não-sindrômica17, já foi investigada.
O DNA mitocondrial é transmitido pela mãe; seus polimorfismos (também chamados "variantes"), quando presentes em alguns sítios, parecem aumentar o risco ou susceptibilidade da pessoa desenvolver certas condições neurodegenerativas tais como hipoacusia18.
Uma vez que aminoglicosídeos são usados com frequência (como tratamento de escolha para tuberculose), decidimos investigar três diferentes alterações ou mutações pontuais na extremidade 3´ da região 12S do rRNA (T961+C(n)ins, A1555G, e C1494T), e o tRNA Serina(UCN) (A7445G) do DNA mitocondrial que poderiam estar associadas à hipersensibilidade a aminoglicosídeos em pacientes previamente triados com função vestibular e/ou auditiva normal ou comprometida.
MATERIAIS E MÉTODOS
Amostra. A amostra desse estudo envolveu 65 indivíduos mexicanos selecionados no Instituto Nacional de Enfermedades Respiratorias, no México, que concordaram em participar (Protocolo B04-02). A história clínica foi colhida, prestando-se especial atenção a tratamentos prévios com aminoglicosídeos. As funções vestibular e auditiva foram investigadas em todos os indivíduos selecionados. Amostras do sangue periférico foram colhidas para extração do DNA (DNAzol-Invitrogen, técnica provida pelos fornecedores) e foram triadas na procura de mutações hot spot no DNA mitocondrial relacionadas à surdez não-sindrômica.
Avaliações vestibular e audiológica
As idades dos indivíduos variaram entre 5 e 70 anos (média de 35 anos). Foram feitas otoscopias e audiometrias de tom puro nos limiares de 25, 250, 500, 1000, 2000, 4000, e 8000 Hz (Audiômetro AC 40 - Interacustic). Audição acima de 25 dB foi considerada normal; perda auditiva entre 25 e 40 dB foi considerada discreta, moderada entre 45 e 60 dB, grave entre 65 e 80 dB, e profunda quando entre 85 e 120 dB. Testes calóricos também foram feitos em todos os indivíduos para avaliar danos vestibulares.
Polimorfismo no comprimento do fragmento de restrição - reação em cadeia da polimerase (PCR-RFLP)
A técnica foi executada como descrito por Hutchin T, et al.19 para A1555G para 961 mutações de sítio (324-349 e 1282-1307, Mnl), e A7445G (7399-7419 e 7751-7771, Xba I). O procedimento consistiu da desnaturação a 95°C por 5 min, seguido por 35 ciclos (95°C durante 20s, 50°C por 30s, e 72°C durante 30s), e uma extensão final a 72°C durante 7 min. Cada fragmento de PCR foi digerido por restrição enzimática com as enzimas mencionadas acima e separadas por eletroforese em agarose a 3%.
A mutação C1494T e outras variantes ao redor da região A1555G, amplificada por PCR, foi estudada usando Phusion DNA polymerase (New England Biolabs) e oligonucleotídeos correspondendo às posições 1011-1134 e 1624-1644. As condições da PCR foram: desnaturação a 98°C durante 5 minutos, seguido por 35 ciclos (98°C por 30s, 60°C por 30 s, e 72°C por 45s), e uma extensão final a 72°C por 5 min. Cada fragmento foi purificado em coluna (Quiagen) e cada amostra foi subsequentemente analisada duas vezes por meio de sequenciamento direto bidirecional em um analisador Genético ABI PRISM 310 da Perkin-Elmer Applied Biosystems. O alinhamento da sequência foi feito por meio dos programas BLAST e DNAstar e comparadas ao consenso da sequência de Cambridge (GenBank Accession No. NC_012920), Dados do Genoma Mitocondrial Humano. Os cromatogramas foram todos verificados para análise sequencial.
As sequências das espécies a seguir foram usadas no alinhamento para procurar preservação dos sítios onde as variantes foram localizadas no gene 12S rRNA: humano (NC_012920), bovino (NC_006853), canino (NC_002008), roedores (NC_001665), chimpanzés (NC_001643), gorilas (NC_001645) e camundongos (NC_005089).
RESULTADOS
Achados clínicos
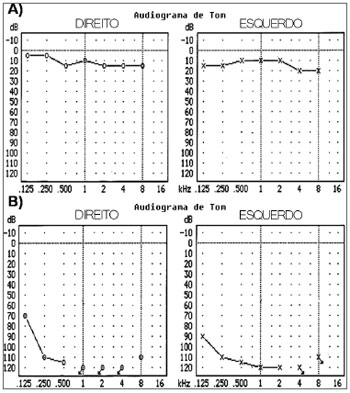
Entre os 65 indivíduos do estudo, avaliações audiológicas e vestibulares revelaram que 32 estavam saudáveis nessas funções, enquanto os 33 restantes tinham perda auditiva (Figura 1). Dentre esses últimos, 18 pacientes tinham perda auditiva profunda; 14 tinham perda auditiva discreta, e somente 13 tinham danos vestibulares. Tratamento com aminoglicosídeos foi administrado a 15 indivíduos; 18 indivíduos não foram tratados.
Figura 1. Audiogramas - análise do gene 12S rRNA - Audiogramas dos indivíduos analisados quanto ao gene 12S rRNA gene. (A) Indivíduo saudável sem alterações audiométricas e (B) paciente com perda auditiva.
Análise de PCR-RFLP e sequências
Quando os sítios relatados (961 insCn, C1494T, A1555G, e A7445G) foram triados, eles não foram encontrados em qualquer uma das amostras dos grupos de estudo.Entretanto, encontramos uma alteração (timina para citosina) no sítio 1189 no gene 12S rRNA de dois pacientes com problemas auditivos e vestibulares, que haviam sido tratados com estreptomicina (um deles havia sido tratado adicionalmente com canamicina).
DISCUSSÃO
A região 12S rRNA no DNA mitocondrial já foi descrita como um hot spot para variabilidade de nucleotídeo relacionado a surdez não-sindrômica, como resultado de hipersensibilidade a aminoglicosídeo; vários estudos já confirmaram tal achado. Em nossos estudos com biologia molecular, não encontramos mutação alguma associada à perda auditiva e hipersensibilidade a aminoglicosídeos.
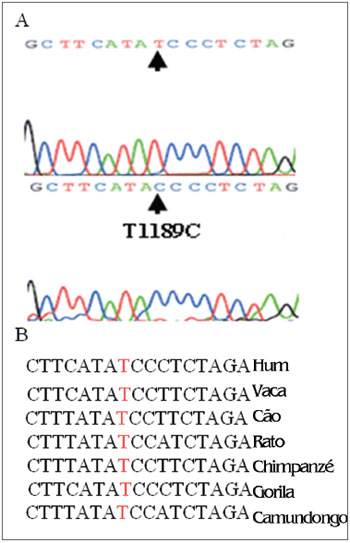
Entretanto, encontramos uma alteração T para C na posição 1189 em dois pacientes, independente de alinhamento com o banco de dados universal de Cambridge, que é o primeiro relato da literatura (pelo nosso conhecimento) de tal sequência de nucleotídeo alterada na região próxima à extremidade 3´ do gene mitocondrial 12S rRNA, que poder estar correlacionado às alterações auditivas ou vestibulares causadas por aminoglicosídeos (Figura 2A).
Figura 2. T1189C em 12S rRNA - (A) Sequências parciais do cromatograma do gene 12S rRNA nos portadores de T1189C, e (B) Alinhamento parcial da sequência do gene 12S rRNAem diferentes espécies que a posição 1189 é altamente preservada.
A análise da posição 1189 em diferentes espécies tem demonstrado que ele é um sítio altamente preservado (Figura 2B). Sendo ou não o resultado de hipersensibilidade a aminoglicosídeos em pacientes, isso teria que ser investigado em uma amostra maior. A variante T1189C está na região onde já foram encontradas alterações C1494T e A1555G; sua ação pode ser atribuída à sua proximidade do sítio ribossômico onde se inicia a síntese proteica.
CONCLUSÃO
Nossos resultados sugerem que mutações associadas à perda auditiva e toxicidade a aminoglicosídeos, que foram encontrados em outros grupos étnicos, não estavam presentes em mexicanos. Além disso, a variante T1189C, que não havia sido previamente relatada, está aparentemente associada a tratamento com aminoglicosídeo. Se tal possível mutação estiver presente em outros indivíduos, isso seria de significativa importância, e pode ser um valioso marcador de triagem antes do tratamento. Recomendações podem ser dadas para se evitar danos devido a esses perigosos antibióticos.
AGRADECIMENTOS
Os autores agradecem à Dra. Robyn Hudson, do Biomedical Institute (UNAM), por sua revisão crítica e correções gramaticais do inglês feitas nesse manuscrito; também agradecemos ao Dr. Ignacio Mora Magaña por algumas das avaliações audiológicas, e à Sra. Cecilia Escalona Ochoa por toda a sua ajuda no laboratório. Agradecemos ao Dr. Daniel Ortuño Sahagún por nos dar acesso ao programa de alinhamento reverso DNAstar, e ao pessoal técnico da Unidade de Biologia Molecular por seu significativo apoio.
REFERÊNCIAS BIBLIOGRÁFICAS
1. González JF. Uno de cada 200 niños mexicanos padece sordera profunda. Salud y Medicinas. Accessible in http://www.saludymedicinas. com/nota.asp?id=2256 Accessed on Dec 9th, 2009.
2. Gillespie PG, Müller U. Mechanotransduction by hair cells: models, molecules, and mechanisms. Cell. 2009;139(1):33-44.
3. Granados O, Meza G. A direct HPLC method to estimate streptomycin and its putative ototoxic derivative, streptidine, in blood serum: application to streptomycin-treated humans. J Pharm Biomed Anal. 2007;43(2):625-30.
4. Hobbie SN, Bruell C, Kalapala S, Akshay S, Schmidt S, Pfister P, et al. A genetic model to investigate drug-target interactions at the ribosomal decoding site. Biochimie. 2006;88(8):1033-43.
5. Davies J, Gorini L, Davis BD. Misreading of RNA codewords induced by aminoglycoside antibiotics. Mol Pharmacol. 1965;1(1):93-106.
6. Hutchin TP, Cortopassi GA. Mitochondrial defects and hearing loss. Cell Mol Life Sci. 2000;57(13-14):1927-37.
7. Kokotas H, Petersen MB, Willems PJ. Mitochondrial deafness. Clin Genet. 2007;71(5):379-91.
8. Bacino C, Prezant TR, Bu X, Fournier P, Fischel-Ghodsian N. Susceptibility mutations in the mitochondrial small ribosomal RNA gene in aminoglycoside induced deafness. Pharmacogenetics. 1995;5(3):165-72.
9. Casano RA, Johnson DF, Bykhovskaya Y, Torricelli F, Bigozzi M, Fischel-Ghodsian N. Inherited susceptibility to aminoglycoside ototoxicity: genetic heterogeneity and clinical implications. Am J Otolaryngol. 1999;20(3):151-6.
10. Zhao L, Young WY, Li R, Wang Q, Qian Y, Guan MX. Clinical evaluation and sequence analysis of the complete mitochondrial genome of three Chinese patients with hearing impairment associated with the 12S rRNA T1095C mutation. Biochem Biophys Res Commun. 2004;325(4):1503-8.
11. Bravo O, Ballana E, Estivill X. Cochlear alterations in deaf and unaffected subjects carrying the deafness-associated A1555G mutation in the mitochondrial 12S rRNA gene. Biochem Biophys Res Commun. 2006;344(2):511-6.
12. Rodríguez-Ballesteros M, Olarte M, Aguirre LA, Galán F, Galán R, Vallejo LA, et al. Molecular and clinical characterisation of three Spanish families with maternally inherited non-syndromic hearing loss caused by the 1494C/T mutation in the mitochondrial 12S rRNA gene. J Med Genet. 2006;43(11):e54.
13. Bae JW, Lee KY, Choi SY, Lee SH, Park HJ, Kim UK. Molecular analysis of mitochondrial gene mutations in Korean patients with nonsyndromic hearing loss. Int J Mol Med. 2008;22(2):175-80.
14. Noguchi Y, Yashima T, Ito T, Sumi T, Tsuzuku T, Kitamura K. Audiovestibular findings in patients with mitochondrial A1555G mutation. Laryngoscope. 2004;114(2):344-8.
15. Li Z, Li R, Chen J, Liao Z, Zhu Y, Qian Y, et al. Mutational analysis of the mitochondrial 12S rRNA gene in Chinese pediatric subjects with aminoglycoside-induced and non-syndromic hearing loss. Hum Genet. 2005;117(1):9-15.
16. Casano RA, Bykhovskaya Y, Johnson DF, Hamon M, Torricelli F, Bigozzi M, et al. Hearing loss due to the mitochondrial A1555G mutation in Italian families. Am J Med Genet. 1998;79(5):388-91.
17. Chen J, Yuan H, Lu J, Liu X, Wang G, Zhu Y, et al. Mutations at position 7445 in the precursor of mitocondrial tRNA(Ser(UCN)) gene in three maternal Chinese pedigrees with sensorineural hearing loss. Mitochondrion. 2008;8(4):285-92.
18. Manwaring N, Jones MM, Wang JJ, Rochtchina E, Howard C, Newall P, et al. Mitochondrial DNA haplogroups and age-related hearing loss. Arch Otolaryngol Head Neck Surg. 2007;133(9):929-33.
19. Hutchin T, Haworth I, Higashi K, Fischel-Ghodsian N, Stoneking M, Saha N, et al. A molecular basis for human hypersensitivity to aminoglycoside antibiotics. Nucleic Acids Res. 1993;21(18):4174-9.
1. Ph.D (Pesquisador).
2. Ph.D (Pesquisador).
3. Dr. (Pesquisador).
4. Ph.D (Pesquisador).
División de Neurociencias. Instituto de Fisiología Celular, Universidad Nacional Autónoma de México.
Enviar correspondência para:
Graciela Meza
Apartado Postal 70-253 04510, México, D.F.
Tel (52) 56-22-55-85, Fax (52) 56-22-57-47
E-mail: gmeza@ifc.unam.mx
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 6 de outubro de 2010. cod. 7354
Artigo aceito em 29 de novembro de 2010.
Universidad Nacional Autónoma de México and Instituto Nacional de EnfermedadesRespiratorias (Protocolo de aprovação B04-02).