Ano: 2011 Vol. 77 Ed. 4 - Julho - Agosto - (7º)
Seção: Artigo Original
Páginas: 447 a 454
Avaliação histomorfométrica de enxertos ósseos de cimento fosfato de cálcio no processo de reparo ósseo
Histomorphometric evaluation of calcium phosphate bone grafts on bone repair
Autor(es): Karis Barbosa Guimarães1; Belmiro Cavalcanti do Egito Vasconcelos2; Francisco de Assis Limeira Júnior3; Frederico Barbosa de Sousa4; Emanuel Sávio de Souza Andrade5; Ricardo José de Holanda Vasconcellos6
Palavras-chave: durapatita, fosfatos de cálcio, materiais biocompatíveis, osteogênese, regeneração óssea.
Keywords: biocompatible materials, bone regeneration, calcium phosphates, durapatite, osteogenesis.
Resumo:
Os materiais de fosfato de cálcio, pelas características de biocompatibilidade e osteocondução, estão sendo estudados como substitutos ósseos. Objetivo: Comparar histomorfometricamente o reparo ósseo promovido pela cerâmica bifásica de hidroxiapatita, cimento fosfato de cálcio e enxerto ósseo autógeno. Forma de Estudo: Prospectivo e experimental em laboratório. Material e Método: Foram criadas duas cavidades (esquerda e direita - teste e controle) de 5mm de diâmetro nos ossos parietais de 72 ratos Wistar. As cavidades testes GI, GII, GIII e GIV foram preenchidas com cimento fosfato de cálcio, cerâmica bifásica de hidroxiapatita, enxerto ósseo autógeno e coágulo sanguíneo. Os animais foram sacrificados aos 30, 60 e 90 dias e os espécimes avaliados histomorfometricamente. Resultados: Os resultados mostraram maior formação óssea no período de 30 dias para o GIII quando comparado aos outros grupos testes. Nos períodos de 60 e 90 dias, a neoformação óssea foi mais acentuada nos grupos testes GI, GII e GIII, alcançando maiores áreas em GI e GII. Em todos os períodos de avaliação, as cavidades testes GII apresentaram maiores áreas frente às GI. Conclusão: Os biomateriais foram superiores ao enxerto autógeno no reparo ósseo.
Abstract:
Because of its biocompatibility and osteoconductive properties, calcium-phosphate cement has been used as bone surrogate. Objective: The purpose of this study was to do a histomorphometric comparison of bone regeneration using hydroxyapatite biphasic ceramic, calcium-phosphate cement and autogenous bone graft. Study Design: Prospective and laboratorial experiment. Materials and Methods: Two 5mm in diameter cavities (left and right - test and control) were made in the parietal bone of 72 rats. The GI, GII, GIII and GIV test cavities were filled with calcium-phosphate cement, biphasic ceramic hydroxyapatite, autogenous bone graft and blood. The animals were killed at 30, 60 and 90 days and the specimens underwent histomorphometric analysis. Results: The results showed that autogenous bone graft treated defects had significantly more new bone at 30 days compared to other test groups. Within 60 and 90 days, bone formation was more significant in the test groups GI, GII and GIII; GI and GII encompassed larger areas. Throughout the evaluation periods, GII tests showed more bone formation when compared to GI. Conclusion: Biomaterials depicted a significantly increase in bone content, when compared to autogenous bone graft, concerning bone regeneration.
![]()
INTRODUÇÃO
As perdas ósseas constituem um dos maiores problemas dentro das especialidades médicas e odontológicas e, provavelmente, estão associadas à exposição do tecido ósseo a várias condições fisiológicas e patológicas. O tecido ósseo possui uma enorme capacidade regenerativa, e em muitas situações é capaz de restabelecer perfeitamente sua estrutura óssea arquitetônica e as propriedades mecânicas por meio de um processo complexo que envolve atividade local e sistêmica do organismo. No entanto, a capacidade reparativa óssea tem limites e também pode falhar, resultando em defeitos ósseos geralmente largos para serem preenchidos de forma espontânea e promoverem, desta forma, o reparo ósseo1.
As perdas ósseas promovidas por fraturas, procedimentos cirúrgicos sobre-estendidos e os processos patológicos que acometem o complexo estomatognático, tais como osteomielites, lesões císticas, tumores odontogênicos e defeitos ósseos periodontais, além da necessidade contínua e crescente à osseointegração de implantes e enxertos ósseos nos sítios receptores e doadores, têm conduzido vários pesquisadores ao desenvolvimento de novas tecnologias que visam auxiliar a reparação do tecido ósseo ou acelerar o processo de cicatrização óssea2,3.
Com o intuito de instituir, recuperar e/ou manter volume e qualidade óssea em regiões que perderam suas conformações anatômicas, diversas pesquisas têm procurado desenvolver ou aperfeiçoar novos e promissores materiais biocompatíveis e que apresentem propriedades de condução óssea, os quais favorecem o reparo dos defeitos ósseos4-7. Para tanto, algumas condições estes materiais devem cumprir: o suporte deve ser constituído por um material bioinerte ou bioativo; sua forma e dimensões devem favorecer o crescimento ósseo pelo seu interior e a deposição óssea deve ocorrer por substituição8. Os materiais osteocondutores não têm a capacidade de induzir a citodiferenciação de osteoblastos, mas preenchem o defeito, orientando as novas células originadas por proliferação das osteoprogenitoras, provenientes das margens do defeito, a promoverem a neoformação do tecido ósseo5-7,9,10.
Tendo-se em vista a maior biodisponibilidade do material, a diminuição da morbidade, o menor tempo cirúrgico, a maior facilidade de execução da técnica operatória oferecidos pelos materiais osteocondutores de preenchimento, é objetivo deste trabalho investigar com o uso de análise morfométrica o processo de regeneração óssea, com minuciosa mensuração da neoformação óssea, influenciada pelo uso do cimento fosfato de cálcio, pela cerâmica bifásica de hidroxiapatita e pelo enxerto de osso autógeno no processo de reparo ósseo de defeitos críticos, confeccionados em calvária de ratos da linhagem Wistar.
MATERIAL E MÉTODO
Tratou-se de um estudo prospectivo, do tipo experimental em laboratório, pareado, cego e com grupos de trabalho alocados de forma aleatória. O modelo animal utilizado foi o rato Wistar Albinus, macho, com peso variando de 350 a 400 gramas, clinicamente sadio e perfazendo uma amostra total de 72 ratos, mantidos sob condições naturais de luz, umidade e temperatura no Biotério da Universidade Federal de Campina Grande (Campina Grande/ Brasil). Durante todo o período experimental, os animais foram alimentados com dieta sólida padrão do biotério e água ad libitum. Os animais foram divididos em quatro grupos, e cada grupo subdividido em três subgrupos, de acordo com os períodos de observação de 30, 60 e 90 dias.
O protocolo da presente pesquisa foi submetido à avaliação e aprovação da Comissão de Ética em uso de animais da instituição sob o número 002/09.
Sob anestesia geral em região dorsal do rato - Cloridrato de Ketamina 10% (0,05 ml/100g) e Cloridrato de Xilazina 2% (0,025 ml/100g), os animais foram submetidos à assepsia e antissepsia no sítio de eleição para intervenção cirúrgica, a região craniofacial, estendendo-se, no sentido látero-lateral, entre os pavilhões auriculares externos, e no sentido ântero-posterior, as regiões dos ossos nasais e occipitais. Desta forma, realizou-se uma incisão coronal linear, na pele e tecido celular subcutâneo, de aproximadamente 1,5 cm de extensão com posterior deslocamento muco-periosteal até a exposição completa de ambos os ossos parietais dos animais. Dois defeitos ósseos padronizados com 5mm de diâmetro foram confeccionados lateralmente à sutura sagital mediana, com uma distância de 4mm entre si, medida com um compasso cirúrgico e apresentando como parâmetro de profundidade, o rompimento da cortical óssea e a exposição, sem perfuração, da dura-máter. O defeito ósseo esquerdo apresentou uma localização mais cranial, enquanto o defeito ósseo contralateral apresentou uma localização mais caudal, visando diminuir a possibilidade de deslocamento do material de preenchimento ósseo de um defeito ósseo para o outro no momento da síntese tecidual.
Após a realização de ambas as cavidades ósseas, apenas as cavidades ósseas esquerdas foram preenchidas pelo biomaterial conforme cada grupo experimental, sem apresentar excesso de material na cortical óssea externa, enquanto as cavidades ósseas direitas não receberam nenhum material de preenchimento, apenas o coágulo sanguíneo do próprio animal, servindo como grupo controle do experimento quando comparado aos materiais de preenchimento e ao enxerto ósseo autógeno. Os animais do Grupo I, II, III e IV tiveram as cavidades esquerdas preenchidas pelo cimento fosfato de cálcio (Norian CRS Fast Set Putty - Synthes North America Products, Califórnia, Estados Unidos), pela cerâmica bifásica de hidroxiapatita (constituída por 40% de hidroxiapatita e 60% de cimento fosfato de cálcio) (Genius, Baumer S.A., Campo Largo, Paraná, Brasil), pelo enxerto de osso autógeno e pelo coágulo sanguíneo do próprio animal.
O cimento de fosfato de cálcio foi preparado segundo as recomendações do fabricante, misturando-se dois componentes: o fosfato de cálcio sob a forma de pó estéril (0,25g) e um solvente estéril a base de fosfato sódico, os quais formaram uma pasta uniforme e homogênea de cimento fosfato de cálcio. A cerâmica bifásica de hidroxiapatita (0,25g), devido à sua natureza microgranular, foi misturada a uma pequena quantidade de sangue obtida do próprio animal no momento da incisão ou após a osteotomia necessária a formação dos defeitos ósseos. O osso autógeno enxertado foi obtido a partir do segmento circular da calota craniana removido durante a confecção dos defeitos ósseos. Para tal, o segmento circular foi particulado em 4 fragmentos menores, sendo 3 fragmentos de enxerto ósseo autógeno inseridos na cavidade óssea esquerda.
Após a confecção e o devido preenchimento dos biomateriais nas cavidades teste, foi posicionada a uma membrana não reabsorvível (Gen-Derm®, Baumer S.A., Campo Largo, Paraná, Brasil) sobre ambas as cavidades ósseas confeccionadas, com o intuito de evitar excessiva pressão e invasão do tecido conjuntivo nas cavidades experimental e controle. Essa membrana foi recortada e adaptada de forma passiva na calota craniana do rato, sem a necessidade de fixação da mesma. Após a inserção e adaptação da membrana, o periósteo, o tecido muscular e a pele de todos os animais foram reposicionados e suturados com fio monofilamentar de nylon (4-0).
Seguido os períodos de observação, os animais foram mortos aos 30, 60 e 90 dias de pós-operatório, pela administração de cloreto de potássio intracardíaco, com prévia anestesia geral do animal conforme protocolo descrito no momento da técnica operatória, até a constatação da ausência dos sinais vitais. As calotas cranianas de cada animal foram removidas e, assim, constituíram as peças cirúrgicas de cada grupo. Os espécimes obtidos foram imersos em solução de formalina tamponada a 10% por um período de 02 dias, sendo posteriormente descalcificados em soluções de ácido nítrico (5%) e, processados rotineiramente pela técnica de hematoxilina-eosina, segundo protocolo preconizado pelo Laboratório de Patologia Bucal da Faculdade de Odontologia da Universidade de Pernambuco.
O estudo das lâminas foi realizado com o emprego da microscopia óptica. As lâminas obtidas de cada animal foram submetidas ao exame microscópico pelo sistema de captura, num aumento de 20X, e análise de imagem, sendo constituída por um conjunto de pixels - Image-Pro Plus®. Após a captura das imagens em formato JPEG, as mesmas foram direcionadas ao programa de histomorfometria Image Tool Scripting Language®. Com programa histomorfométrico pôde-se realizar a mensuração das áreas desejadas, sem o conhecimento prévio da distribuição das imagens nos seus respectivos grupos de estudo, pela delimitação do contorno das regiões desejadas, com o auxílio do mouse, avaliando-se desta forma o processo de evolução do reparo ósseo pela mensuração das áreas de neoformação óssea. Os valores obtidos foram submetidos à análise estatística descritiva e inferencial uni e bivariada por meio do programa SPSS for Windows - versão 15, pelos testes U de Mann-Whitney (p<0,05).
RESULTADOS
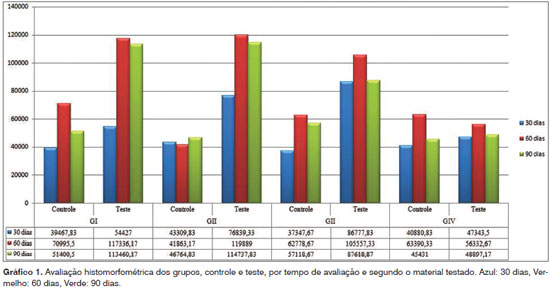
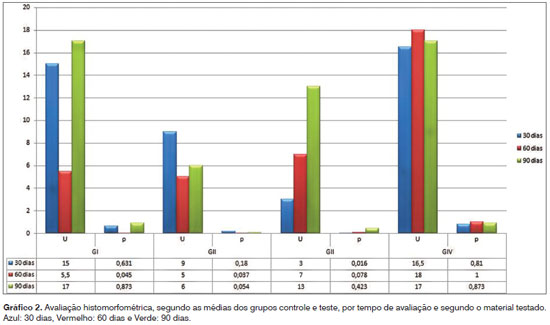
Os Gráficos 1 e 2 mostram os valores das médias referentes às áreas de trabeculado ósseo neoformado e analisadas quantitativamente em cada um dos grupos, bem como nos períodos de observação estudados, analisadas em um conjunto de pixels. A avaliação histomorfométrica foi calculada a priori comparando-se os grupos isoladamente por material testado. Dentre todas as comparações emparelhadas, a única que se mostrou significativa foi do grupo teste com 60 dias de observação (p=0,000). Comparações emparelhadas do teste U de Mann-Whitney mostraram que a diferença está no grupo controle quando comparado aos demais, este apresentando um valor histomorfométrico inferior aos outros materiais testados e em todos os períodos de observação testados.
Os resultados histomorfométricos das áreas totais de trabeculado ósseo neoformado evidenciaram que os grupos submetidos aos biomateriais de preenchimento ósseo (condutores ósseos e enxerto ósseo autógeno) exprimiram valores de área de trabeculados ósseos superiores aos grupos controle, tanto em relação ao grupo controle do mesmo animal e quanto ao grupo controle negativo do experimento (Grupo IV), porém sem associação estatística significativa entre os grupos. Analisando a osteogênese total, segundo os diferentes períodos de observação, pôde-se observar valores de neoformação óssea homogêneos entre os grupos teste e controle aos 60 e 90 dias. O aumento da osteogênese ocorrido na transição dos 30 aos 60 dias de observação e a manutenção da osteogênese dos 60 aos 90 dias de observação devem ser ressaltados em todos os grupos teste submetidos à inserção dos biomateriais de condução óssea (cimento fosfato de cálcio e cerâmica bifásica de hidroxiapatita) e ao enxerto ósseo autógeno, porém com maior intensidade nos grupos submetidos aos biomateriais de preenchimento ósseo (Gráficos 1 e 2). É importante ressaltar o declínio da osteogênenese ocorrido na transição dos 60 aos 90 dias de observação, nas cavidades teste, de todos os materiais testados.
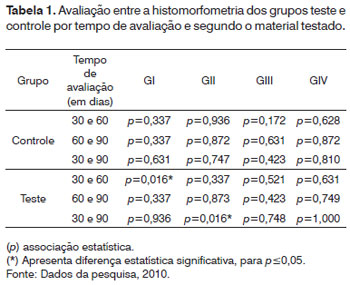
Ao analisar quantitativamente as áreas de trabeculado ósseo neoformado de cada material testado, em suas respectivas cavidades, controle e teste, foram observadas diferenças estatísticas significativas no grupo submetido ao enxerto de osso autógeno no período de 30 dias (p=0,016), sendo o valor histomorfométrico superior na cavidade teste. A segunda diferença estatística significativa foi no grupo do cimento fosfato de cálcio, aos 60 dias (p=0,045), sendo maiores as áreas de trabeculado ósseo nas cavidades teste e a terceira diferença estatística significativa foi no grupo da cerâmica bifásica de hidroxiapatita, aos 60 dias (p=0,037), também apresentando valores maiores de neoformação óssea no grupo teste. Os valores referentes ao teste encontram-se na Tabela 1, no entanto, as médias correspondentes a estes grupos podem ser observadas nos gráficos anteriores.
Quando emparelhados os tempos de avaliação com as cavidades, controle e teste dos materiais testados, duas situações foram consideradas estatisticamente significativas. A primeira situação foi evidenciada na transição dos 30 aos 60 dias da cavidade teste do grupo cimento fosfato de cálcio, sendo a média da área do trabeculado ósseo neoformado maior no período de 60 dias; a segunda diferença significante observou-se na cavidade teste do grupo da cerâmica bifásica de hidroxiapatita, no período de combinação de 30 a 90 dias, sendo a média histomorfométrica superior no período de 90 dias (Tabela 1 para testes inferenciais e Gráficos 1 e 2 para estatísticas descritivas).
DISCUSSÃO
Diversos biomateriais são constantemente estudados para substituir o tecido ósseo, a fim de fornecer uma alternativa viável para o enxerto ósseo autógeno que, apesar de ser o melhor e mais bem aceito substituto ósseo, por apresentar características essenciais de osteoindução, osteocondução e osteoprogenição4,11,12, possui desvantagens, principalmente quanto à morbidade devido à necessidade de remoção óssea em área doadora e inserção em área receptora, aumentando o número de intervenções cirúrgicas além da quantidade de enxerto ósseo disponível, especialmente em casos de área doadora intraoral13-15. Observam-se também variados graus de reabsorção óssea pós-operatória, alterando o resultado obtido inicialmente16.
Os biomateriais utilizados como substitutos ósseos devem apresentar propriedades de biocompatibilidade, atoxicidade, resistência à deformação, resistência ou não à reabsorção, conforme a aplicação desejada e, caso sejam reabsorvíveis, devem ser metabolizados pelo organismo ou excretados através de uma via fisiológica normal3,5-7,14,15.
As biocerâmicas de fosfato de cálcio continuam sendo pesquisadas e utilizadas em procedimentos para reconstrução tecidual, haja vista que as suas características e propriedades físico-químicas induzem a uma resposta biológica favorável. As biocerâmicas de fosfato de cálcio, como a hidroxiapatita, isolada ou combinada a uma pequena proporção de cimento fosfato de cálcio, apresentam propriedades de biocompatibilidade, bioatividade e osteocondutividade, o que denota que, ao serem inseridas no leito receptor, não induzem resposta imunológica, sendo capazes de ligar-se diretamente ao tecido ósseo e permitirem o crescimento do osso ao longo de sua superfície4,17. As características observadas em ambos os materiais de preenchimento ósseo, a cerâmica bifásica de hidroxiapatita (Gen-Phos® HA TCP, Genius, Baumer, S.A) e o cimento fosfato de cálcio (Norian CRS®, Synthes GmbH & CO, KG), corroboram com as propriedades conceitualmente necessárias para um biomaterial ideal, uma vez que não geraram reação inflamatória exacerbada, não foram encapsulados ou rejeitados pelo organismo e permitiram que as células osteoprogenitoras adjacentes ao defeito ósseo pudessem se diferenciar através do arcabouço gerado por tais matérias, denotando a osteocondução5,6,7,9,10.
A metodologia aplicada na presente pesquisa está de acordo com a empregada por diversos estudos, os quais visam à avaliação do comportamento dos materiais de preenchimento ósseo18-21. Como sujeito da amostra foi escolhido o modelo animal, ratos Wistar, machos e adultos jovens. O critério de inclusão da amostra objetivou evitar interferências de fatores hormonais e assegurar condições metabólicas e fisiológicas acentuadas em roedores jovens.
Os ratos vêm sendo utilizados como modelo experimental para avaliar a cicatrização óssea. Assim, a resposta cicatricial sob uma variedade de condições tem sido bem documentada. Os ossos laminares e longos dos ratos apresentam uma camada de osso cortical densamente mineralizada e bem formada, não sofrem remodelação interna e, consequentemente, adaptam-se ao estudo da cinética óssea. Estudos prévios têm relatado um ciclo de remodelação óssea alveolar de seis dias para ratos, comparados aos 60 a 120 dias para adultos humanos22.
Como sítio de eleição cirúrgica, optou-se por realizar dois defeitos circulares, lateralmente à sutura sagital mediana, na calvária dos ratos. O diâmetro do defeito circular foi definido em 5mm, sendo este diâmetro considerado crítico para a regeneração óssea23,24. De acordo com Schmitz & Hollinger25, o defeito crítico apresenta uma área que impossibilita a regeneração óssea espontânea, a não ser que seja inserido dentro ou sobre o defeito ósseo algum material osteogênico, osteocondutor ou osteoindutor. Quanto à confecção de duas cavidades ósseas em um mesmo animal, o presente trabalho baseou-se nos trabalhos de Bosch et al.23, Grandi18 e León21, os quais afirmaram que a confecção de duas cavidades esféricas na calvária dos ratos permite a confecção de um modelo de estudo pareado, sendo, desta forma, adequado para avaliar a eficácia dos materiais osteopromotores em estimular a regeneração óssea.
De acordo com os dados obtidos com a regeneração óssea, não se pode avaliar que o defeito detentor de um diâmetro de 5mm se comporta como crítico, haja visto que houve neoformação óssea no grupo que não recebeu material de preenchimento ósseo, tendo recebido apenas o coágulo sanguíneo no defeito ósseo (grupo controle dos animais teste e grupo controle negativo). A regeneração óssea observada nos grupos controles (grupo controle dos animais teste e grupo controle negativo), diverge com os estudos de Bosch et al.23, bem como com os de Donos et al.24, os quais comprovaram que o defeito de 5mm na calvária do rato não promoveria qualquer sinal de regeneração óssea espontânea após 30 ou 60 dias de observação.
É necessário levar em consideração a relação anatômica existente entre a morfologia do osso parietal, sítio ósseo de eleição para a confecção do defeito ósseo, e o processo de regeneração óssea desenvolvido ao longo dos períodos de observação. Sabe-se que o osso parietal é o osso laminar, predominantemente cortical e com pouco componente medular26. Ao realizar o defeito ósseo, este envolveu as corticais, externa e interna, do osso, sem perfuração das meninges, especificamente a dura-máter. A partir daí, observa-se que o único sentido para a osteogênese seria o induzido a partir das bordas do defeito ósseo da calvária24,27. Sabe-se também que as corticais ósseas externas e internas dos ossos laminares são revestidas externamente e internamente por uma camada de membrana conjuntiva, denominada de periósteo e endósteo26,27. Desta forma, sugeriu-se que o processo de regeneração óssea apresentado pelo grupo controle negativo (GIV) pôde ser favorecido pela diferenciação de células osteogênicas encontradas no periósteo, reposicionado no momento síntese da ferida, bem como pelo endósteo, preservado nas adjacências das bordas do defeito, conforme preconizado por Dângelo & Fattini26 e Takeuchi et al.27.
A análise histomorfométrica utilizada permitiu detectar a presença de osso no defeito e quantificar o tamanho da área de neoformação. A importância desse tipo de análise é confirmada nos estudos de Ferreira da Silva20, Cavalcanti et al.28, Grandi18 e León21, que relatam ser a análise quantitativa essencial para estudos que objetivam avaliar a efetividade de novas modalidades terapêuticas na neoformação óssea.
Ao observar a neoformação óssea, do ponto de vista quantitativo, os resultados obtidos neste experimento demonstraram diferenças entre os grupos, controle e teste, dos diferentes materiais de preenchimento ósseo utilizados, assim como destes grupos, em relação ao grupo controle negativo. Maiores áreas de trabéculas ósseas foram observadas nas cavidades teste dos grupos submetidos aos materiais de preenchimento ósseo sem, contudo, associação estatística significativa aos 30 e 90 dias, o que evidenciou a ação positiva da cerâmica bifásica de hidroxiapatita, do cimento fosfato de cálcio e do enxerto ósseo autógeno no processo de reparo ósseo. Estes resultados estão de acordo com os estudos de Ferreira da Silva20, Cavalcanti et al.28, Grandi18 e León21, os quais também encontraram um aumento da neoformação óssea frente aos materiais de preenchimento ósseo em relação às cavidades controles, utilizando software para análise das imagens e posterior estudo morfométrico.
Ao analisar quantitativamente as médias de trabeculado ósseo neoformado, segundo os períodos de observação, evidenciou-se que o modelo de estudo animal adotado apresentou maiores índices de formação óssea durante os 60 dias do experimento, com valores de neoformação óssea homogêneos e superiores entre os grupos teste submetidos aos diferentes materiais de preenchimento ósseo testados e o grupo controle negativo, com associação estatística significativa. Aos 90 dias do experimento, observou-se declínio nos níveis da osteogênese nas cavidades teste dos distintos materiais testados. Em todos os períodos de observação e em todos os materiais testados, explicitou-se uma maior área de neoformação óssea nas cavidades testes em relação às cavidades controles, as quais foram preenchidas apenas com coágulo sanguíneo do próprio animal. Essa discreta diminuição na área de neoformação óssea observada aos 90 dias em todas as cavidades teste dos diferentes materiais utilizados, sugerindo que o processo de reparo ósseo encontrava-se em um grau de progressão na maturação óssea, concordando com os estudos de Kurashina et al.29, o qual afirmam que a progressão do período de observação não promove aumento na área, e sim no grau de maturação do trabeculado ósseo.
Quanto ao comportamento dos substitutos ósseos em relação à neoformação óssea, explicitou-se que as áreas de trabeculado ósseo neoformado pela cerâmica bifásica de hidroxiapatita e pelo cimento fosfato de cálcio foram semelhantes e superiores às neoformadas pelo enxerto ósseo autógeno nos períodos de observação de 60 e 90 dias, respectivamente, denotando serem estes materiais favoráveis às células costeogênicas, fato que concorda com os estudos de Grandi18 e Tsai et al.30 e discorda com os estudos de Cavalcanti et al.28, os quais afirmam a superioridade da neoformação óssea do enxerto ósseo autógeno.
Quando observada a composição química das biocerâmicas utilizadas, pôde-se distinguir que as partículas do cimento fosfato de cálcio e da cerâmica bifásica da hidroxiapatita apresentavam-se bem diferenciadas quanto ao tamanho das partículas, expressando maiores partículas na cerâmica bifásica da hidroxiapatita, com diâmetro variando de 0,5 a 0,75mm. O cimento fosfato de cálcio apresentou-se sob a forma de pó, sendo convertido em pasta ao ser manipulado. O aumento no tamanho do cristal pode influenciar no período de manutenção destes no interior do defeito ósseo, com consequência direta na modulação da neoformação óssea, haja vista o grande potencial osteocondutor apresentado pela cerâmica bifásica de hidroxiapatita, segundo recomendações do fabricante. Assim, pode-se justificar a maior neoformação do trabeculado ósseo, segundo padrões morfométricos, no grupo teste dos animais submetidos à cerâmica bifásica da hidroxiapatita, em todos os períodos de observação, quando comparada ao grupo teste do cimento fosfato de cálcio.
Nos resultados morfométricos obtidos diante das cavidades, controle e teste, dos diferentes materiais testados, observou-se associação estatística significativa em apenas três situações: no período de 30 dias do grupo de enxerto autógeno e no período de 60 dias para os grupos do cimento fosfato de cálcio e para a cerâmica bifásica de hidroxiapatita. Observou-se que os dados morfométricos de cada grupo estudado não seguiu uma distribuição homogênea quanto à neoformação óssea dentro de cada grupo estudado, observando-se altas diferenças entre as médias de neoformação óssea entre animais do mesmo grupo. Daí a inferência ter sido não paramétrica para a avaliação dos dados, utilizando-se a mediana para as avaliações inferenciais. Tal variabilidade no comportamento de animais de um mesmo grupo pode ser justificada com os estudos de Garcia & Albergaria-Barbosa13, os quais preconizam que tanto os enxertos podem sofrer alteração durante os processos de desmineralização e liofilização, como a possível falta de padronização no preparo laboratorial dos enxertos utilizados, podem ser considerados fatores que levam à obtenção de resultados diferentes entre animais do mesmo grupo.
É sabido que o cimento fosfato de cálcio atua como um biomaterial osteocondutor, que em sua forma pura se converte em cimento de hidroxiapatita, com as mesmas propriedades encontradas no osso intacto. É nesse processo de conversão em hidroxiapatita que os cristais permanecem aprisionados no interior tecido, favorecendo a condução óssea5,6,7,9,10,31. Já a cerâmica bifásica da hidroxiapatita comporta-se de forma semelhante, promovendo a osteocondução das células ósseas neoformadas, enquanto que o osso autógeno desempenha as funções de osteoindutor, osteocondutor e osteoprogenitor10,29. Mediante os resultados morfométricos da neoformação óssea obtidos na amostra estudada, pode-se afirmar que tanto o cimento fosfato de cálcio quanto a cerâmica bifásica de hidroxiapatita comportam-se como materiais osteocondutores, uma vez que as partículas dos materiais permitiram a formação de um arcabouço para a deposição das células osteoindutoras presentes no organismo.
A partir dos resultados morfométricos obtidos e associando-os à composição química das biocerâmicas, acredita-se que o cimento de fosfato de cálcio e a cerâmica bifásica de hidroxiapatita possuem características necessárias para o uso clínico. É importante, contudo, ter conhecimento do objetivo que se pretende alcançar com a aplicação de cada um destes materiais. Nos casos em que se deseja maior volume ósseo, com maiores exigências quanto à qualidade óssea, como, por exemplo, nas correções de defeitos com comprometimento estético, a cerâmica bifásica de fosfato de cálcio pode ser indicada, dada a permanência das partículas do material, oferecendo a condutibilidade óssea necessária às células osteoprogenitoras do organismo, haja vista que o aumento no diâmetro das partículas da cerâmica bifásica de hidroxiapatita proporciona um maior tempo de arcabouço para as células citadas anteriormente. Já os casos em que o objetivo é a formação mais precoce de tecido ósseo somente, por exemplo, enxertia prévia à colocação de implantes dentários, o cimento fosfato de cálcio oferece neoformação óssea com reabsorção do material mais rapidamente.
O futuro dos substitutos ósseos deve envolver implantes biológicos, reabsorvíveis, desenvolvidos com um arcabouço poroso, tridimensional, feito de um material reabsorvível, carregado com proteínas morfogenéticas e povoado com células osteoprogenitoras. Uma reabsorção controlada tempo-dependente do arcabouço liberaria fatores bioativos aprisionados dentro da sua estrutura, o que induziria células transplantadas e do hospedeiro a crescerem neste padrão tridimensional intercomunicante. O osso se formaria através do arcabouço e não apenas na superfície19.
CONCLUSÃO
A partir dos resultados obtidos, é lícito afirmar a superioridade na neoformação óssea promovida pela cerâmica bifásica de hidroxiapatita e pelo cimento fosfato de cálcio frente ao enxerto ósseo autógeno, fato este que coloca as biocerâmicas como adjuntos cirúrgicos em procedimentos craniomaxilofaciais que necessitem de enxertos ósseos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Pinheiro ALB, Gerbi ME. Photoengineering of bone repair processes. Photomed Laser Surg. 2006;21(2):169-78.
2. Guimarães KB. Fotoengenharia do pBrocesso de raparo ósseo induzido pela laserterapia de baixa potência (GaAlAs): Estudo em fêmures de ratos [dissertação]. Porto Alegre (RS): Pontifícia Universidade Católica do Rio Grande do Sul; 2006.
3. Chow LC. Next generation calcium phosphate-based biomaterials. Dent Mater J. 2009;28(1):1-10.
4. Sugawara A, Fujikawa K, Takagi S, Chow LC. Histological analysis of calcium phosphate bone grafts for surgically created periodontal bone defects in dogs. Dent Mater J. 2008;27:787-94.
5. Sugawara A. New generation of bone graft material. Part 1. Requirements for bone regeneration. J Oral Implants. 2006;26(1):55-74.
6. Sugawara A. New generation of bone graft material. Part 2. Tactics for bone regeneration. J Oral Implants. 2006;27(1):31-56.
7. Sugawara A. New generation of bone graft material. Part 3. Animal studies and clinical applications. Jof Oral Implants. 2006;28(1):47-84.
8. Shiratori K, Matsuzaka K, Koike Y, Murakami S, Shimono M, Inoue T. Bone formation in β-tricalcium phosphate-filled bone defects of the rat femur: Morphometric analysis and expression of bone related protein in RNA. Biomed Res. 2005;26(2):51-9.
9. Cook SD, Rueger DC. Osteogenic protein-1: biology and applications. Clin Orthop Relat Resar. 1996;324:29-38.
10. Santos LA. Desenvolvimento de Cimento de Fosfato de cálcio reforçado por fibras para uso na área médico-odontológica [tese]. Campinas (SP): Universidade Estadual de Campinas; 2002.
11. Clokie CM, Moghadam H, Jackson MT, Sandor GK. Closure of critical sized defects with allogenic and alloplastic bone substitutes. J Craniofac Surg. 2002;13:111-21.
12. MJ. Reconstruction of mandibular defects with autologous tissue-engineered bone. J Oral Maxillofac Surg. 2004;62(5):601-6.
13. Garcia RR, Albergaria-Barbosa JR. Capacidade de regeneração de um enxerto ósseo humano desmineralizado e liofilizado (Dembone) em calvária de coelhos. Análise histológica. Rev ABO Nac. 2002;10:18-22.
14. Valério P, Pereira MM, Goes AM, Leite MF. The effect of ionic products from bioactive glass dissolution on osteoblast proliferation and collagen production. Biomaterials. 2004;25(15):2941-8.
15. Knabe C, Stiller M, Berger G, Reif D, Gildenhaar R, Howlett CR, et al. The effect of bioactive glass ceramics on the expression of bone-related genes and proteins in vitro. Clin Oral Implants Res. 2005;16(1):119-27.
16. Shirota T, Ohno K, Motohashi M, Michi K. Histologic and microradiologic comparison of block and particulate cancellous bone and marrow grafts in reconstructed mandibles being considered for dental implant placement. J Oral Maxillofac Surg. 1996;54:15-20.
17. Le Geros RZ. Calcium phosphate materials in restorative dentistry: a review. Adv Dent Res. 1988;2(1):164-80.
18. Grandi G. Avaliação histomorfométrica comparativa entre o cimento de α-TCP e os grânulos de β-TCP/HA no reparo ósseo de calotas cranianas de ratos [dissertação]. Porto Alegre (RS): Pontifícia Universidade Católica do Rio Grande do Sul; 2006.
19. Moghadam GH, Sándor BKG, Holmes IHH, Clokie LMC. Histomorphometric evaluation of bone regeneration using allogenic and alloplastic bone substitutes. J Oral Maxillofac Surg. 2004;62(2):202-13.
20. Ferreira da Silva LC. Estudo comparativo entre uma matriz óssea desmineralizada e um cimento de fosfato de cálcio na regeneração óssea: avaliação histológica e histomorfométrica em calvária de ratos [tese]. Camaragibe (PE): Faculdade de Odontologia de Pernambuco - Universidade de Pernambuco; 2006.
21. León MEA. Uso do cimento de fosfato de cálcio (Bonesource®) associado ou não a células tronco adultas de medula óssea no processo de reparação óssea [tese]. Camaragibe (PE): Faculdade de Odontologia de Pernambuco - Universidade de Pernambuco; 2008.
22. Friesen LR, Cobb CM, Rapley JW, Forgas-Brockman L, Spencer P. Laser irradiation of bone: II. Healing response following treatment by CO2 and Nd:YAG Lasers. J Periodontol. 1999;70:75-83.
23. Bosch C, Melsen B, Vargevic K. Importance of the critical size bone defect in testing bone-regeneration materials. J Craniofac Surg. 1998;9:310-6.
24. Donos N, Lang NP, Karoussis IK, Bosshardt D, Tonetti M, Kostopoulos L. Effect of GBR in combination with deproteinized bovine bone mineral and/or enamel matrix proteins on the healing of critical-size defects. Clin Oral Implants Res. 2004;15:101-11.
25. Schmitz JP, Hollinger, JO. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clin Orthop Relat Res. 1986;205:299-308.
26. Dângelo JG, Fattini CA. Sistema Esquelético. Em: Dângelo JG, Fattini CA, editores. Anatomia Humana: Sistêmica e Segmentar. 3 ed. São Paulo: Livraria Atheneu; 2007. p. 17-32.
27. Takeuchi H, Nagayama M, Imaizumi Y, Tsukahara T, Nakazama J, Kusaka Y, Ohtomo K. Immunohistochemical analysis of osteoconductivity β-tricalcium phosphate and carbonate apatite applied in femoral and parietal bone defects in rats. Dent Mater J. 2009;28(5):595-601.
28. Cavalcanti SC, Pereira CL, Mazzonetto R, de Moraes M, Moreira RW. Histological and histomorphometric analysis of calcium phosphate cement in rabbit calvaria. J Craniomaxillofac Surg. 2008;36(6):354-9.
29. Kurashina K, Kurita H, Hirano M, Kotani A, Klein CP, de Groot K. Calcium phosphate cement: in vitro and in vivo studies of the α-tricalcium phosphate - dicalcium phosphate dibasic - tetracalcium phosphate monoxide system. J Mat. Sci Mater Med. 1995;6:340-7.
30. Tsai CH, Lin RM, Ju CP, Chern Lin JH. Bioresorption behavior of tetracalcium phosphate-derived calcium phosphate cement implanted in femur of rabbits. Biomaterials. 2008;29(8):984-93.
31. Hirakata LM. Development and Evaluation of Apatite with Modification by a Tricalcium Phosphate [dissertation]. Kuramoto, Tokushima: The University of Tokushima, Department of Dental Engineering; 2003.
1. Mestre em Odontologia pela PUCRS; Aluna do Programa de Pós-graduação em Odontologia da Universidade de Pernambuco, Concentração Cirurgia e Traumatologia Bucomaxilofacial, Doutorado - FOP/UPE; Professora Assistente do Centro de Educação e Saúde da Universidade Federal de Campina Grande - CES/UFCG.
2. Doutor, Professor Adjunto e Coordenador do Programa de Pós-graduação em Odontologia da Universidade de Pernambuco, Concentração Cirurgia e Traumatologia Bucomaxilofacial, Mestrado e Doutorado - FOP/UPE.
3. Doutor, Professor Adjunto do Programa de Pós-graduação em Odontologia da Universidade Federal da Paraíba, Concentração Diagnóstico Bucal, Mestrado e Doutorado - UFPB.
4. Doutor, Professor Adjunto do Programa de Pós-graduação em Odontologia da Universidade Federal da Paraíba, Concentração Diagnóstico Bucal, Mestrado e Doutorado - UFPB.
5. Doutor, Professor Adjunto do Programa de Pós-graduação em Odontologia da Universidade de Pernambuco, Concentração Cirurgia e Traumatologia Bucomaxilofacial, Mestrado e Doutorado - FOP/UPE.
6. Doutor, Professor Adjunto do Programa de Pós-graduação em Odontologia da Universidade de Pernambuco, Concentração Cirurgia e Traumatologia Bucomaxilofacial, Mestrado e Doutorado - FOP/UPE.
Faculdade de Odontologia da Universidade de Pernambuco - FOP-UPE.
Endereço para correspondência:
Prof. Dr. Ricardo Jose de Holanda Vasconcellos
Faculdade de Odontologia da Universidade de Pernambuco - FOP-UPE
Av. General Newton Cavalcanti, 1650, Tabatinga
Camaragibe - PE, Brazil
Tel. (55-XX-83) 9141-2808 - Fax: (55-XX-81)3184-7659
E-mail: ricardoholanda@bol.com.br; karisguimaraes@yahoo.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 28 de setembro de 2010. cod. 7340
Artigo aceito em 8 de dezembro de 2010.