Ano: 2011 Vol. 77 Ed. 4 - Julho - Agosto - (6º)
Seção: Artigo Original
Páginas: 439 a 446
Reparo em defeito ósseo da parede alveolar do seio maxilar utilizando membranas de colágeno e fáscia temporal: estudo experimental em macacos
Bone defect repair on the alveolar wall of the maxillary sinus using collagen membranes and temporal fascia. An experimental study in monkeys
Autor(es): Adalberto Novaes Silva1; José Américo de Oliveira2; Maria Célia Jamur3; José Ari Gualberto Junqueira4; Vani Maria Correa5; Wilma Terezinha Anselmo Lima6
Palavras-chave: colágeno, fáscia, membranas, regeneração óssea, seio maxilar.
Keywords: bone regeneration, collagen, fascia, maxillary sinus, membranes.
Resumo:
Poucos experimentos têm sido conduzidos utilizando o princípio da regeneração óssea guiada nas perfurações ósseas do seio maxilar. Objetivo: Avaliar o processo de reparo ósseo em defeitos cirúrgicos experimentais realizados na parede alveolar do seio maxilar, comunicando-se com a cavidade sinusal utilizando membranas de colágeno e fáscia temporal. Materiais e Métodos: Neste estudo prospectivo, experimental, foram realizados defeitos ósseos em paredes alveolares dos seios maxilares comunicando-se com as cavidades sinusais de quatro macacos pregos (Cebus apella) com membranas de colágeno Gen-derm - Genius Baumer, Pro-tape - Proline e fáscia temporal autóloga e análises histológicas após 180 dias. Resultados: No defeito experimental sem cobertura com métodos de barreira predominou proliferação óssea em dois animais e nos outros dois, tecido conjuntivo fibroso; no grupo em que foi utilizado fáscia temporal predominou tecido conjuntivo fibroso em três animais e proliferação óssea em um animal; nos grupos com membranas de colágeno Gen-derm Pro-tape houve completa proliferação óssea em três animais e predomínio de tecido conjuntivo fibroso em um animal. Conclusões: Os defeitos cirúrgicos experimentais podem ser reparados, tanto por tecido ósseo como por tecido conjuntivo fibroso, e o uso de membranas de colágeno trouxeram benefícios ao processo de reparo ósseo.
Abstract:
Few studies has been done using guided bone regeneration in maxillary sinus defects. Aim: To assess the bone repair process in surgical defects on the alveolar wall of the monkey maxillary sinus, which communicates with the sinus cavity, by using collagen membranes: Gen-derm - Genius Baumer, Pro-tape - Proline and autologous temporal fascia. Materials and Methods: In this prospective and experimental study, orosinusal communications were performed in four tufted capuchin monkeys (Cebus apella) and histologic analysis was carried out 180 days after. Results: In the defects without a cover (control), bone proliferation predominated in two animals and fibrous connective tissue predominated in the other two. In defects repaired with a temporal fascia flap, fibrous connective tissue predominated in three animals and bone proliferation predominated in one. In the defects repaired with Gen-derm or Pro-tape collagen membranes there was complete bone proliferation in three animals and fibrous connective tissue in one. Conclusions: Surgical defect can be repaired with both bone tissue and fibrous connective tissue in all study groups; collagen membranes was more beneficial in the bone repair process than temporal fascia or absence of a barrier.
![]()
INTRODUÇÃO
Defeitos na parede óssea do seio maxilar ocasionando comunicação buco-sinusal ocorrem por uma variedade de razões. Podem ser secundários a procedimentos de cirurgia odontológica (tal como extrações dentárias e procedimentos cirúrgicos relacionados à implantodontia), doença periodontal crônica, terapia endodôntica, cirurgia ortognática, traumatismos faciais, cirurgias para tratamento de neoplasias que envolvam a maxila e seio maxilar, infecções sinusais e procedimentos cirúrgicos otorrinolaringológicos1-5.
Quando o seio maxilar é perfurado de forma traumática e ocorre uma comunicação buco-sinusal (como após uma perfuração acidental durante a extração de um dente superior posterior), acredita-se que o defeito ósseo pode reparar-se com neoformação óssea ou com uma união fibrosa, havendo fechamento do mucoperiósteo da cavidade bucal e da cavidade sinusal6,7. O resultado pode ser também uma não união e estabelecer-se uma fístula. Isso ocorre quando a comunicação entre a cavidade bucal e a cavidade sinusal maxilar se torna revestida por tecido epitelial, oriundo da proliferação dos tecidos que circundam o defeito ósseo8.
O sucesso do tratamento depende do tempo de instalação da comunicação, ausência de doença sinusal prévia, tamanho e localização do defeito e da quantidade e qualidade do tecido adjacente9. A importância do fechamento precoce de perfurações oroantrais tem sido objeto de muitos estudos. Estabelecida uma comunicação oroantral, a terapia adequada deve ser iniciada o mais breve possível, porque mudanças da mucosa podem potencializar a perda da saúde sinusal, com instalação de infecção7.
O tratamento de comunicações buco-sinusais inclui o uso de retalhos locais ou à distância e interposição de enxertos autógenos ou implantes aloplásticos. Retalhos locais são realizados utilizando-se principalmente tecidos do vestíbulo bucal ou do palato10,11. Retalho miomucoso do bucinador12 e da língua13 também tem sido descrito. Muitos autores recomendam o fechamento da fístula em dois planos14-19. Obtendo-se o fechamento do tecido mole (mucoperiósteo) do lado bucal, a terapia da comunicação buco-sinusal tem sido considerada como sucesso. Muito pouco tem sido descrito na literatura sobre como se repara o defeito do tecido ósseo na região de uma comunicação buco-sinusal tratada, com neoformação óssea ou com tecido conjuntivo fibroso, e a qualidade desse tecido ósseo neoformado.
Outra possibilidade na terapia da comunicação buco-sinusal é o uso dos princípios da regeneração óssea guiada20 (ROG), que utiliza uma membrana microporosa com a finalidade de permitir que células desejáveis invadam o coágulo, impedindo que células indesejáveis migrem para o local do defeito ósseo, isolando a área a ser reparada do tecido conjuntivo frouxo e epitelial situado ao seu redor. Esta técnica atua impedindo mecanicamente a invaginação de tecidos moles para dentro da cavidade cirúrgica, possibilitando ao organismo realizar a neoformação de tecido ósseo. O uso da ROG busca abreviar o tempo da regeneração óssea e proporcionar um osso neoformado de melhor qualidade.
Atualmente, com as possibilidades de utilização de implantes dentários para reabilitação estética e funcional do aparelho mastigatório, é importante considerarmos a viabilidade óssea da região da comunicação buco-sinusal, pois se no futuro houver a indicação de colocação de implantes osseointegráveis, estes necessitam de qualidade e quantidade ósseas para o seu sucesso21. Considerando que muito se tem estudado sobre ROG no campo da periodontia e implantodontia, e que poucos experimentos têm sido conduzidos utilizando esse princípio no reparo de perfurações ósseas do seio maxilar7,20,22,23, pretendemos investigar no nosso trabalho se o uso da ROG poderá abreviar o tempo da regeneração óssea e se poderá proporcionar um osso de boa qualidade para colocação de implante no local de uma comunicação buco-sinusal.
Muitos materiais têm sido utilizados com finalidade de ROG. Produtos derivados do colágeno são largamente empregados23-25. Poucos estudos têm relatado a utilização de fáscia temporal na ROG26,27.
Dessa forma, o objetivo do nosso trabalho foi avaliar histologicamente o processo de reparo da parede alveolar do seio maxilar após comunicação com a cavidade sinusal, e comparar histologicamente, de forma qualitativa, esse processo de reparo utilizando três diferentes materiais como barreira para ROG: membrana de colágeno Pro-tape (Proline), membrana de colágeno Gen-derm (Genius Baumer) e fáscia temporal autóloga.
Acreditamos que a similaridade anatômica entre o seio maxilar do macaco prego (Cebus apella) e de humanos permite um modelo experimental apropriado para o estudo desta indicação de tratamento cirúrgico.
MATERIAIS E MÉTODOS
Este estudo foi aprovado pelo Núcleo de Procriação de Macacos - Prego, do Departamento de Ciências Básicas da Faculdade de Odontologia de Araçatuba - UNESP, de acordo com a Portadora FOA 087/95, e pelo Comitê de Ética do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, da Universidade de São Paulo, sob o Protocolo nº 1930/97, sendo utilizados quatro macacos da espécie Cebus apella. Os animais foram mantidos em observação por 40 dias antes do início dos procedimentos experimentais. Durante os períodos pré-operatório e pós-operatório, os macacos receberam alimentação e água sem restrições, exceto na primeira semana de pós-operatório, quando a alimentação passou a ter consistência líquida (Gatorade e iogurte de frutas). Os animais foram operados e mantidos até o final do experimento em gaiolas individuais. O peso médio dos animais foi de 2,4kg, com idade entre 6 e 7 anos, considerados adultos jovens, de acordo com o critério de Gilmore28.
Em cada etapa cirúrgica, os animais passaram por um processo inicial de inalação de éter sulfúrico em uma câmara apropriada, para obter sedação. Em seguida, realizou-se aplicação intramuscular de benzodiazepínico (diazepam - 0,3mg/kg de peso) e através da via intraperitoneal injetou-se solução barbitúrica à base de tiopental sódico (30mg/kg de peso). Antes do início dos procedimentos cirúrgicos, os locais operados na maxila receberam infiltração de xilocaína 2% associada com epinefrina (1: 200.000), utilizando-se seringa carpule. Para a cirurgia, foram utilizados campos e materiais esterilizados para a manutenção da assepsia cirúrgica.
O animal foi posicionado em decúbito lateral sobre um campo cirúrgico. A antissepsia da face foi realizada com álcool iodado e a cavidade bucal limpa com uma gaze embebida com solução de clorexidina 0,12%. A seguir, o corpo do animal foi totalmente coberto com outro campo cirúrgico estéril, deixando exposta somente a face. Cálculos dentários presentes foram removidos previamente ao início das incisões cirúrgicas. Como não foi realizada intubação orotraqueal, tivemos que manter sucção cuidadosa da orofaringe do animal, para evitar aspiração de secreção e sangue para a via aérea inferior do animal. A boca foi mantida aberta por um abridor interposto entre os dentes caninos do animal, do lado contralateral ao que estava sendo operado.
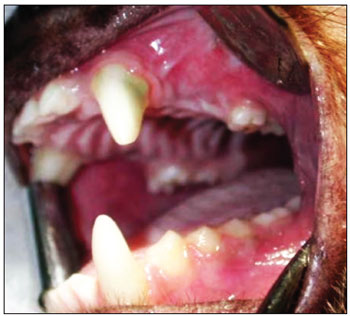
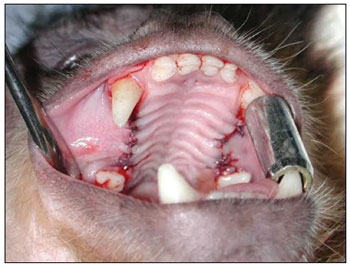
Na primeira fase cirúrgica, foram extraídos os três dentes pré-molares superiores bilateralmente (Figura 1). Para a exodontia, verificou-se a necessidade de osteotomias vestibulares (alveolectomias parciais) com brocas cirúrgicas nº 702 acionadas com motor de alta rotação. Foi realizada irrigação constante e abundante com soro fisiológico 0,9%. Para melhor exposição do campo operatório, foram realizadas incisões interpapilares e intrassulculares do primeiro pré-molar superior (P1) ao terceiro pré-molar superior (P3) e duas incisões verticais relaxantes, de 0,5cm de extensão cada uma, na mesial de P1 e na distal de P3, para facilitar o descolamento mucoperiosteal. As exodontias foram realizadas com alavancas e fórceps pediátricos similares aos utilizados em humanos. Para conseguir sutura oclusiva, foi realizada incisão do periósteo seguido da mobilização do retalho. Utilizou-se fio absorvível de poliglactina 910 nº 4.0 para sutura.
Figura 1. Exodontia dos três pré-molares superiores.
No pré e no pós-operatório imediato, os animais receberam antibioticoterapia à base de cefalotina intramuscular (100mg/kg). Após a finalização do ato operatório, cada animal recebeu 0,5ml de diclofenaco e 0,5ml de dipirona sódica intramuscular. Após o despertar do animal, iniciou-se acetaminofen gotas, misturado à dieta dos animais, por 48 horas, com finalidade de analgesia pós-operatória.
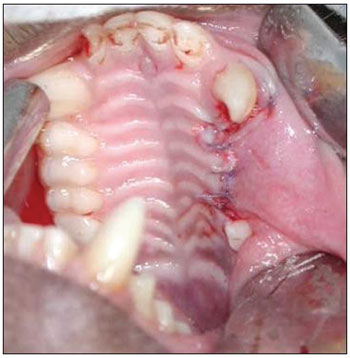
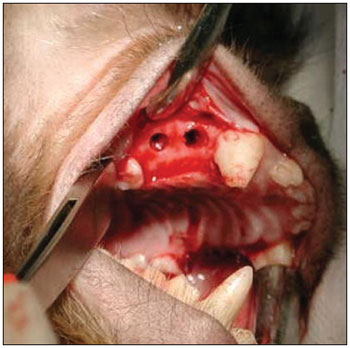
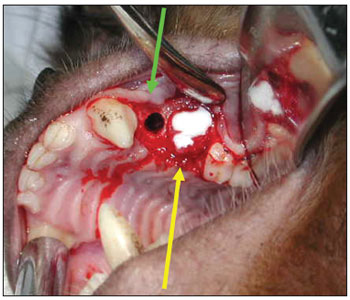
Esperamos por 90 dias para se estabelecer o processo de reparo alveolar (Figura 2). Os animais foram novamente anestesiados, como descrito acima, para a realização da segunda etapa cirúrgica. Nesta segunda fase, após o mesmo processo de anestesia e antissepsia descrito anteriormente, realizamos uma incisão no rebordo alveolar no local das ausências dentárias (de mesial de P1 à distal de P3), com descolamento mucoperiosteal no sentido do sulco gêngivo-jugal, para exposição do tecido ósseo na crista do rebordo alveolar. Em cada lado da maxila, foram realizadas duas perfurações na parede óssea alveolar do seio maxilar, incluindo a mucosa sinusal, penetrando no interior do antro maxilar, de diâmetro padronizado, utilizando broca de implante de 3,3mm de diâmetro (Figura 3). A espessura do osso medida da superfície do rebordo alveolar até o assoalho do seio maxilar variou de 3 a 4mm. Uma primeira perfuração foi realizada anteriormente (distalmente ao dente canino superior) e uma segunda perfuração foi realizada posteriormente (mesialmente ao primeiro molar superior). No lado esquerdo da maxila, a perfuração anterior foi usada como controle, não sendo utilizado nenhum material para regeneração óssea guiada (ROG). A perfuração posterior do lado esquerdo foi recoberta por uma barreira de membrana de colágeno Pro-tape (Proline). Do lado direito da maxila, a perfuração anterior foi recoberta com barreira de colágeno Gen-derm (Genius Baumer) e a perfuração posterior recoberta com barreira de fáscia temporal do próprio animal. O diâmetro dos materiais utilizados como barreira foi de aproximadamente 6mm, suficiente para cobertura de todas as bordas das perfurações (Figura 4). Os retalhos foram reaproximados e suturados com fio poliglactina 910 nº 4.0 (Figura 5). As incisões foram realizadas no rebordo alveolar ligeiramente por palatino, de forma que, quando os retalhos fossem reposicionados, a linha de sutura não ficasse sobre as perfurações ósseas realizadas. O fragmento de fáscia temporal utilizado foi removido utilizando-se uma pequena incisão anterior à orelha e superior ao arco zigomático, do lado direito da face do animal. A pele foi suturada com fio de nylon 5.0. Os medicamentos e os cuidados pós-operatórios foram os mesmos utilizados e descritos na primeira etapa cirúrgica.
Figura 2. Três meses após a primeira etapa cirúrgica - fase de reparo alveolar.
Figura 3. Perfurações comunicando-se com o seio maxilar.
Figura 4. Defeito cirúrgico controle (seta verde); Defeito cirúrgico com membrana de colágeno (seta amarela).
Figura 5. Retalho mucoperiosteal reposicionado e suturado.
Após 180 dias de pós-operatório da segunda etapa cirúrgica, os animais foram sedados e anestesiados de forma semelhante ao preparo pré-cirúrgico. Em seguida, foram perfundidos via aorta ascendente, seguindo o protocolo de perfusão sistêmica com fixação tecidual completa.
Após o sacrifício dos animais, suas maxilas direita e esquerda foram removidas e fixadas em solução de formalina a 10% em tampão fostato 0,1 molar. Em seguida, foram submetidas à descalcificação em solução de ácido tricloroacético 10% em 60 dias.
Finalizado o processo de descalcificação, as peças receberam processamento laboratorial de rotina para inclusão em parafina, possibilitando a obtenção de cortes histológicos de 6 µm de espessura. Os cortes foram semisseriados, com intervalos de 60µm, no plano frontal, a partir da distal do canino superior e da mesial do primeiro molar superior. Para cada defeito experimental estudado, foram realizados 30 cortes, os quais foram corados pela hematoxilina-eosina e com picro sirius red. Os cortes foram submetidos à avaliação histológica qualitativa com microscopia óptica convencional e com luz polarizada.
RESULTADOS
Quando do sacrifício dos animais, não foi observado nas áreas operadas, clinicamente, nenhum sinal de fístula buco-sinusal ou alteração na superfície da mucosa.
Nos defeitos experimentais em que não foram utilizados métodos de barreira, considerados como controle (as perfurações ósseas não foram recobertas com membranas), as áreas operadas foram totalmente preenchidas por proliferação óssea em dois animais. Em outros dois animais, observou-se tecido conjuntivo fibroso presente no defeito cirúrgico. Nos defeitos experimentais em que foram utilizadas membranas de colágeno Pro-tape e Gen-derm, houve total neoformação óssea nas áreas operadas em três animais. Em um animal, observou-se tecido conjuntivo fibroso presente entre as bordas ósseas. Nos defeitos experimentais em que foi utilizada fáscia temporal como método de barreira, as áreas operadas foram totalmente preenchidas por neoformação óssea somente em um animal. Em três animais, observou-se tecido conjuntivo fibroso presente no defeito cirúrgico (Tabela 1).
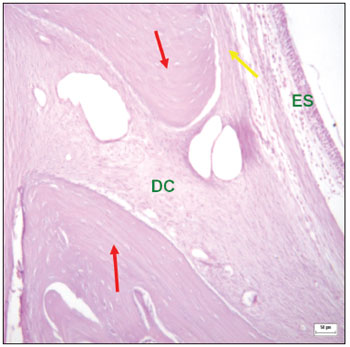
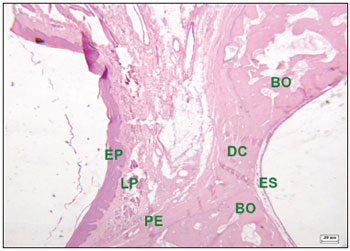
Nos defeitos experimentais que não foram preenchidos totalmente com tecido ósseo, o tecido conjuntivo entre as bordas ósseas é caracterizado por presença de fibras colágenas formando feixes densos, separando o mucoperiósteo bucal do mucoperiósteo sinusal. Nessas áreas, a disposição das fibras colágenas era paralela e não foram vistas ilhas de formação óssea no interior do tecido fibroso (Figuras 6 e 7).
Figura 6. Corte histológico de área com defeito cirúrgico experimental não preenchido totalmente com tecido ósseo (corado com hematoxilina-eosina) - bordas ósseas (setas vermelhas); defeito cirúrgico (DC) contendo tecido conjuntivo fibroso; periósteo (seta amarela); epitélio sinusal (ES).
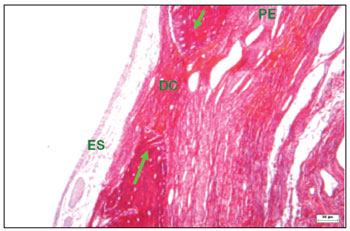
Figura 7. Corte histológico de área com defeito cirúrgico experimental não preenchido totalmente com tecido ósseo (corado com hematoxilina-eosina)- defeito cirúrgico (DC) contendo tecido conjuntivo fibroso; epitélio pavimentoso (EP); lâmina própria (LP); bordas ósseas (BO); periósteo (PE); epitélio sinusal (ES).
Um dos animais apresentou todos os defeitos cirúrgicos experimentais (controle, com utilização de membranas de colágeno Gen-derm, Pro-tape e fáscia temporal) preenchidos com tecido conjuntivo fibroso.
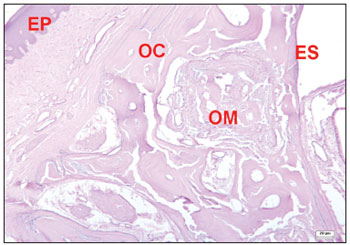
Nos animais nos quais os defeitos cirúrgicos foram ocupados totalmente por tecido ósseo, houve regeneração das paredes ósseas dos locais operados, sendo muito difícil identificar a transição do osso neoformado do osso adjacente aos locais operados. Nessas áreas, foram observadas trabéculas ósseas bem definidas, algumas vezes com sistema haversiano formado. Em alguns raros campos, foi possível identificar locais de regeneração óssea apresentando vascularização abundante e tecido conjuntivo do tipo embrionário com presença de células mesenquimais (Figura 8). Também foram observados locais com presença de osteoblastos adjacentes a trabéculas de matriz óssea formando fileiras, os quais apresentavam citoplasma fortemente basófilo, indicando atividade de síntese de proteína nestas células, principalmente colágeno tipo I.
Figura 8. Corte histológico de área com defeito cirúrgico experimental sem descontinuidade óssea, mostrando locais de regeneração óssea (corado com hematoxilina-eosina). Osso compacto (OC); osso medular (OM); epitélio pavimentoso (EP); epitélio sinusal (ES).
Decorridos 180 dias de pós-operatório, a regeneração da mucosa sinusal foi uma constante nas imagens analisadas. Os campos avaliados não apresentavam tecido inflamatório. Também não foram visualizados restos dos materiais (membranas de colágeno e fáscia temporal) utilizados como barreiras para regeneração tecidual guiada.
Nos vários grupos estudados (sem utilização de barreira, membrana Pro-tape, membrana Gen-derm, fáscia temporal), nos defeitos cirúrgicos experimentais que foram totalmente preenchidos com neoformação óssea, comparativamente, não foram observadas diferenças histológicas significativas.
Nos grupos que apresentaram persistência de tecido conjuntivo fibroso no local da perfuração óssea após 180 dias, quando cortes corados com picro sirius red foram analisados com microscopia de polarização e com campo claro, observamos a presença, a distinção e a organização das fibras colágenas nesse local. Com campo claro, observou-se em vermelho o colágeno presente nas regiões onde não ocorreu o preenchimento total do defeito cirúrgico com tecido ósseo (Figura 9). Com uso de microscopia de polarização, foram observados feixes densos e paralelos de colágeno, nos quais as fibras apresentavam birrefringência de cor vermelha, alaranjada e amarela, que sugerem a presença de colágeno tipo I (Figura 10). Observou-se, também, que as fibras colágenas estavam localizadas no tecido conjuntivo da lâmina própria e formavam uma camada subjacente ao epitélio de revestimento estratificado pavimentoso queratinizado.
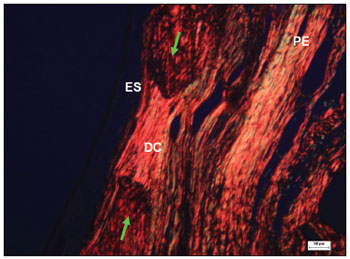
Figura 9. Corte histológico de área com defeito cirúrgico experimental não preenchido totalmente por tecido ósseo (corado com picro sirius red), avaliado com campo claro - tecido conjuntivo fibroso na área do defeito cirúrgico (DC), onde predominam fibras de cores vermelha, alaranjada e amarela, indicativas de colágeno tipo I; epitélio sinusal (ES); periósteo (PE); bordas ósseas (setas verdes).
Figura 10. Corte histológico de área com defeito cirúrgico experimental não preenchido totalmente por tecido ósseo (corado com picro sirius red), avaliado com microscopia de polarização - defeito cirúrgico (DC), com feixes densos e paralelos de colágeno onde as fibras apresentam birrefringência de cores vermelha, alaranjada e amarela, que sugerem a presença de colágeno tipo I; epitélio sinusal (ES); periósteo (PE); bordas ósseas (setas verdes).
DISCUSSÃO
De acordo com Neto & Volpon29, embora união fibrosa seja uma complicação frequente de cirurgias ósseas, não tem sido fácil estabelecê-la experimentalmente em animais. É desejável, do ponto de vista biológico e clínico, que um defeito ósseo preferivelmente seja reparado com osso ao invés de tecido conjuntivo fibroso7. Na ocorrência de uma comunicação buco-sinusal, a regeneração óssea na área, com qualidade e quantidade, será de fundamental importância se considerarmos a indicação de implantes osseointegreis21. De outra forma, teríamos que reabilitar a área desdentada com a utilização de próteses convencionais.
No nosso estudo, as áreas nas quais os defeitos cirúrgicos experimentais não receberam cobertura de nenhum material, houve proliferação óssea em dois animais e nos outros dois a comunicação foi preenchida com tecido conjuntivo fibroso. O potencial do periósteo na formação e regeneração de tecido ósseo tem sido demonstrado em vários estudos30,31. No entanto, para alguns autores a limitação do uso do periósteo é a sua inabilidade para manter espaço23.
No nosso trabalho, nos defeitos experimentais recobertos pela membrana de colágeno Pro-tape (Proline) e pela membrana de colágeno Gen-derm, as áreas dos defeitos cirúrgicos criados foram totalmente preenchidas por proliferação óssea em três animais. Matisko et al.7 estudaram a capacidade de reparo ósseo de defeitos na parede óssea do seio maxilar de coelhos, com e sem o uso de membranas de colágeno. Os resultados demonstraram que a barreira de membrana de colágeno teve um efeito benéfico após exposição do seio maxilar. Dupoirieux et al.25 justificaram resultados pouco satisfatórios obtidos com uso de membranas de colágeno para ROG pelo fato de terem pobres propriedades mecânicas, serem muito flexíveis e não manterem rigidez suficiente para manutenção do espaço que deve ser reparado.
Por se tratar de substância autógena, esperávamos conseguir bons resultados utilizando a fáscia temporal como método de barreira para facilitação do processo de regeneração óssea. Porém, em três dos quatro animais em que o defeito ósseo experimental foi recoberto com fáscia temporal autógena, houve predominância de tecido conjuntivo fibroso entre as bordas ósseas do defeito cirúrgico, separando o mucoperiósteo bucal do mucoperiósteo sinusal. Não temos a razão concreta para essa ocorrência. Discutimos o fato de que por se tratar de tecido fresco, sem receber nenhum tratamento prévio, diferentemente das membranas de colágeno, que sofrem processamento laboratorial, a fáscia temporal pudesse ter sofrido retração na fase inicial do processo de reparo da ferida cirúrgica e ao invés de recobrir as margens da perfuração cirúrgica, ter se instalado exatamente no interior do defeito, trazendo distúrbios ao processo de regeneração óssea. Silverstein et al.26 relataram que a fáscia lata é biocompatível e bem aceita pelos tecidos, servindo como membrana de colágeno regenerativa. Sarac & Bulent32 demonstraram que fáscia temporal homógena pode ser usada em timpanoplastias com a mesma taxa de sucesso que a fáscia temporal autógena.
Após 180 dias, nas áreas apresentando persistência de tecido conjuntivo fibroso no local do defeito cirúrgico experimental, que foram coradas com picro sirius red e avaliadas com microscopia de polarização, observou-se feixes densos e paralelos de colágeno33. Essas fibras apresentavam birrefringência de cores vermelha, alaranjada e amarela, que sugerem a presença de colágeno tipo I, encontrado principalmente no osso, tendão, derme e dentina. O campo fortemente birrefringente é característico de estruturas que contêm moléculas orientadas numa só direção, características de colágeno tipo I e III. Utilizando-se coloração de picro sirius red e microscopia de polarização, o colágeno tipo III apresenta birrefringência verde, não verificada nos cortes examinados no nosso estudo.
Haanaes & Gilhuus-Moe6 descrevem que em modelo experimental de comunicação buco-sinusal através do alvéolo após extração de dente molar de macacos, a proliferação epitelial ocorreu de forma mais pronunciada na parede antral em todos os períodos de observação. Não utilizamos método de barreira na parede sinusal da comunicação por inviabilidade técnica do modelo experimental e também impossibilidade de reproduzir o método no homem. Desta forma, os materiais utilizados como barreira podem ter impedido a invasão de tecido fibroepitelial para dentro do defeito criado experimentalmente na face bucal das perfurações, mas não da face sinusal das mesmas.
Os resultados encontrados neste experimento permitem concluir, apesar do pequeno número de animais estudados, que os defeitos ósseos nas paredes alveolares comunicando-se com o seio maxilar repararam-se melhor quando foram utilizadas membranas de colágeno (Gen-Derm/Pro-tape) do que quando nos defeitos experimentais não foram utilizados métodos de barreira e ainda menos satisfatória foi a neoformação óssea nos locais onde foram utilizados fáscia temporal autógena.
A necessidade de reconstrução de defeitos ósseos da maxila e mandíbula vem mudando o enfoque cirúrgico em muitos procedimentos, tal como exodontias mais conservadoras associadas à reconstrução óssea imediata ou métodos preventivos da atrofia alveolar, utilização de enxertos, o plasma rico em plaquetas, proteína óssea morfogenética e o princípio da regeneração óssea guiada. Os resultados do nosso trabalho demonstram a necessidade de novas pesquisas envolvendo métodos de tratamento da comunicação buco-sinusal, de forma que tenhamos um reparo satisfatório na área do defeito ósseo, permitindo a adequada reabilitação morfofuncional da região operada.
CONCLUSÕES
A utilização de membranas de colágeno (Gen-derm/Pro-tape) com a finalidade de regeneração óssea guiada trouxe benefícios ao reparo do defeito cirúrgico na parede alveolar, comunicando-se com o seio maxilar, comparando-se com os locais onde não se utilizou método de barreira e com os locais onde se utilizou fáscia temporal.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Heling I, Rotstein I. A persistent oronasal sinus tract of endodontic. J Endod. 1989;15(3):132-4.
2. Felix DH, Wray D, Smith GLF, Jones GA. Oro-antral fistula: an unusual complication of HIV-associated periodontal disease. Br Dent J 1991;171(2):61-2.
3. Aksungur EH, Apaydin D, Gonlusen G, Kiroglu M, Soylu L, Duce MN, Cosar E. A case of oroantral fistula secondary to malignant fibrous histiocytoma. Eur J Radiol. 1994;18(3):212-3.
4. Morgan MK, Aldren CP. Oroantral fistula: a complication of transantral ligation of the internal maxillary artery for epistaxis. J Laryngol Otol. 1997;111(5):468-70.
5. Agnihotri N, Spinnato G, Ziccardi V. Oroantral communication with chronic sinusitis 8 years after maxillofacial trauma: a case report. J N J Dent Assoc. 2007;78(1):23-5.
6. Haanaes HR, Gilhuus-Moe O. A histologic study of experimental oro-paranasal communications in monkeys. Int J Oral Surg. 1972;1(5):250-7.
7. Matisko LM, Wallace JA, Mundell R, Schumtz J, Zullo T. Healing of osseous maxillary sinus defects using guided tissue regeneration: An experimental study in rabbits. J Endod. 1999;25(1):49-51.
8. Rezende RA, Heitz C. Comunicação Buco-sinusal e Buco-nasal. In: Zanini SA. Cirurgia e Traumatologia Buco-Maxilo-Facial. 1990; Revinter, Rio de Janeiro; p.431-48.
9. Awang M. Closure of oroantral fistula. Int J Oral Maxillofac Surg. 1988;17(2):110-5.
10. James R. Surgical closure of large oroantral fistula using a palatal island flap. J Oral Surg. 1980;38(8):591-5.
11. Killey HC, Kay LW. An analysis of 250 cases of oro-antral fistula treated by the buccal flap operation. Oral Surg Oral Med Oral Path. 1967;24(6):726-39.
12. Carstens MH, Stofman GM, Sotereanos GC, Hurwitz DJ. A new approach for repair of oro-antral-nasal fistulaes. The anteriorly based buccinator myomucosal island flap. J Craniomaxfac Surg. 1991;19(2):64-70.
13. Coghlan K, O'Regan O, Carter J. Tongue flap repair of oro-nasal fistulae in cleft palate patients. J Craniomaxfac Surg. 1989;17(6):255-9.
14. Quayle AA. A double flap technique for closure or oronasal and oroantral fistula. Br J Plast Surg. 1981;19(2):132-7.
15. Hanazawa Y, Itoh K, Mabashi T, Sato K. Closure of oroantral communications using a pedicled buccal fat pat graft. J Oral Maxillofac Surg. 1995;53(7):771-5.
16. Martin-Granizo R, Naval L, Costas A, Goizueta C, Rodriguez F, Monge F, Muñoz M, Diaz F. Use of buccal fat pad to repair intraoral defects: review of 30 cases. Br J Oral Maxillofac Surg. 1997;35(2):81-4.
17. Allais M, Maurette PE, Cortez ALV, Filho JRL, Mazonetto R. Retalho do corpo adiposo bucal no fechamento de comunicação buco-sinusal. Rev Bras Otorrinolaringol. 2008;74(5):799.
18. Poeschl PW, Baumann A, Russmueller G, Poeschl E, Klug C, Ewers R. Closure of oroantral communications with Bichat's buccal fat pad. J Oral Maxillofac Surg. 2009;67(7):1460-6.
19. Madeira, M.C. Anatomia da Face. Bases anátomo-funcionais para a prática odontológica. 4. Ed. São Paulo: Sarvier; 2003.
20. Waldrop TC, Semba SE. Closure of oroantral communication using guided tissue regeneration and an absorbable gelatin membrane. J Periodontol. 1993;64(11):1061-6.
21. Smith DE, Zarb GA. Criteria for success of osseointegrated endosseous implants. J Prosthet Dent. 1989;62(5):567-72.
22. Becker J, Neukam F, Schliephake H. Restoration of the lateral sinus wall using a collagen type I membrane for guided tissue regeneration. Int J Oral Maxillofac Surg. 1992;21(4):243-6.
23. Hardwick R, Scantlebury T, Sanchez R, Whitley N, Ambruster J. Membrane criteria for guided bone regeneration of the alveolar ridge. In: Buser D, Dahling C, Schenck RK. Guided bone regeneration in implant dentistry. Berlim: Quintessence; 1994. P.149-54.
24. Bunyaratavej P, Wang HL. Collagen membranes: a review. J Periodontol. 2001;72(2):215-29.
25. Dupoirieux L, Pourquier D, Picot MC, Neves M. Comparative study of three different membranes for guided bone regeneration of rat cranial defects. Int J Oral Maxillofac Surg. 2001;30(1):58-62.
26. Silverstein LH, Kraft JD, Wand R. Bone regeneration and tissue acceptance of human fascia lata grafts adjacent to dental implants: a preliminary case report. J. Oral Implantol. 1992;18(4):394-8.
27. Unsal B. Kurtis B. Ozcan G. Ozdemir A, Karaoz E. An investigation of resorption and tissue reaction after subcutaneous implantation of collagen based materials in rats. J. Marmara Univ Dent Fac. 1997;2(4):609-15.
28. Gilmore RM. Mammalogy in an epidemiological study of jungle yellow fever in Brazil. J Mammal. 1943;24:144-62.
29. Dos Santos Neto FL, Volpon JB. Experimental nonunion in dogs. Clin Orthop Relat Res. 1984;187:260-71.
30. Reide CA, McCarthy JG, Kolber AB. A study of regeneration in parietal bone defects in rabbits. Plast Reconstr Surg. 1981;67(5):591-6.
31. Lemperle SM, Calhoun CJ, Curran RW, Holmes RE. Bone healing of large cranial and mandibular defects protected from soft tissue interposition: A comparative study of spontaneous bone regeneration, osteoconduction, and cancellous autografting in dogs. Plast Reconstr Surgery. 1998;101(3):660-72.
32. Sarac S, Bulent G. Use of homograft dehydrated temporal fascia in tympanoplasty. Otol Neurotol. 2002;23(4):416-21.
33. Junqueira LC, Bignolas G, Brentani R. Picroirius staining plus polarization microscopy, a specific method for collagen detection in tissue reactions. Histochem J. 1979;11(4):447-55.
1. PhD, Professor Doutor.
2. PhD, Professor Doutor.
3. PhD, Professora Titular.
4. Técnico.
5. Técnica.
6. Professora Associada, Docente.
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, SP
Núcleo de Procriação de Macacos Prego da Faculdade de Odontologia da Universidade Estadual Paulista "Júlio de Mesquita Filho" - UNESP, "Campus" de Araçatuba - SP.
Endereço para correspondência:
Wilma T. Anselmo-Lima - MD
Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo
Av. Bandeirantes, 3900
CEP 14049-900 - Ribeirão Preto - SP, Brasil
Tel. 55(0xx16) 3602-2862 - Fax: 55(0xx16)3602-2860
E-mail: mcecilia@hcrp.fmrp.usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 8 de abril de 2010. cod. 6993
Artigo aceito em 5 de março de 2011.