Ano: 2011 Vol. 77 Ed. 3 - Maio - Junho - (20º)
Seção: Artigo de Revisão
Páginas: 391 a 400
Manifestações otorrinolaringológicas na infecção pelo HIV - aspectos clínicos e terapêuticos
Otolaryngologic manifestations in HIV disease - clinical aspects and treatment
Autor(es): Fernanda Alves Sanjar1; Barbara Elvina Ulisses Parente Queiroz2; Ivan Dieb Miziara3
Palavras-chave: agentes anti-hiv, hiv, infecções oportunistas relacionadas com a aids, manifestações bucais, síndrome de imunodeficiência adquirida.
Keywords: oral manifestations, anti-hiv agents, aids-related opportunistic infections, acquired immunodeficiency syndrome, hiv.
Resumo:
A infecção por HIV/AIDS é uma pandemia, com casos notificados em quase todos os países. Estudos retrospectivos apontam uma prevalência em torno de 80% dos sintomas na região da cabeça e pescoço, podendo ser o otorrinolaringologista o primeiro médico a ser procurado pelo paciente. As manifestações orais são as mais frequentes, seguidas pelo acometimento cervical, nasossinusal e, menos comumente, otológico. As lesões orais podem representar importantes marcadores clínicos da falha do tratamento antirretroviral. Tais sintomas podem estar presentes desde a infecção aguda até estágios avançados da doença. Objetivo: Determinar o avanço e as novas condutas no tratamento das principais manifestações otorrinolaringológicas no paciente soropositivo pelo levantamento de artigos publicados entre 2002 e 2007. Material e Método: Foram selecionados artigos de revisão sistemática e séries de caso, na língua inglesa e portuguesa, publicados no período de janeiro de 2002 a outubro de 2007, baseando-se nas manifestações otorrinolaringológicas mais comuns previamente publicadas. Conclusão: As manifestações otorrinolaringológicas são frequentes no consultório e o otorrino deve saber identificá-las e tratá-las adequadamente.
Abstract:
HIV is a pandemic infection with cases notified in almost all countries. The reported prevalence of symptoms in the head and neck is about 80%; otolaryngologists may be the first physician to see such patients. Oral manifestations are the most common, followed by neck and sinus manifestations. Otolaryngologic symptoms may be important signs of antiretroviral therapy failure. Symptoms are present in acute infections and advanced cases. Objective: To describe new approaches in the past five years for the treatment of the most frequent otolaryngologic manifestations in HIV patients. Methods: Systematic reviews and case series published in English and Portuguese from January 2002 to October 2007 including the most common otolaryngology manifestations were selected. Conclusion: Otolaryngologic manifestations are common and ENT specialists must be prepared to identify such cases.
![]()
INTRODUÇÃO
Estudos retrospectivos apontam uma prevalência em torno de 80% dos sintomas na região da cabeça e pescoço. As manifestações orais são as mais frequentes, seguidas pelo acometimento cervical, nasossinusal e, menos comumente, otológico1. Tais sintomas podem estar presentes desde a infecção aguda até estágios avançados da doença. As lesões orais podem representar importantes marcadores clínicos da falha do tratamento antirretroviral2.
Esta revisão de literatura tem como objetivo determinar o avanço e as novas condutas no tratamento das principais manifestações otorrinolaringológicas no paciente HIV positivo pelo levantamento de artigos publicados entre 2002 e 2007.
MATERIAIS E MÉTODOS
A pesquisa bibliográfica foi realizada no Pubmed, baseando-se nas manifestações otorrinolaringológicas mais comuns previamente publicadas. Foram selecionados artigos de revisão sistemática e séries de caso, na língua inglesa e portuguesa, publicados no período de janeiro de 2002 a outubro de 2007.
As principais manifestações otorrinolaringológicas revisadas e seu tratamento correspondente foram divididos de acordo com o sítio de acometimento e sua prevalência. Manifestações orais: Candidíase oral; Leucoplasia pilosa; Estomatite aftoide recorrente; Neoplasias (Sarcoma de Kaposi e Linfomas); Afecções causadas pelo herpes simples, herpes zoster e papilomavírus humano (HPV); Doença periodontal; Tuberculose oral. Manifestações Nasossinusais: Rinossinusite aguda e crônica; Rinite alérgica; Neoplasias (Sarcoma de Kaposi e Linfomas). Manifestações Cervicais: Linfadenopatia; acometimento de glândulas salivares. Manifestações Otológicas: Otite média aguda e crônica; Otite média secretora; Otite externa; Pólipo de conduto auditivo externo; Neoplasia (Sarcoma de Kaposi); perda auditiva neurossensorial; Paralisia facial periférica.
DISCUSSÃO
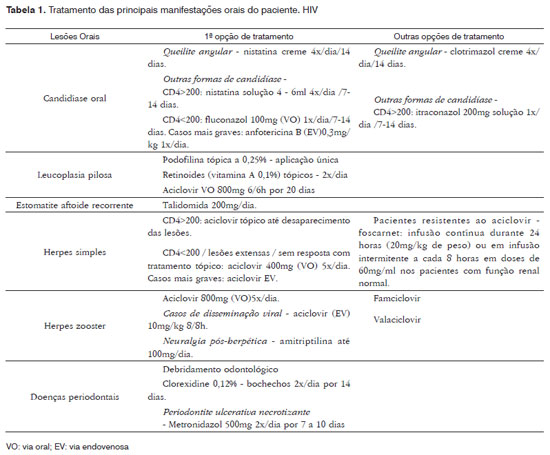
Lesões orais (Tabela 1)
1. Candidíase: é a afecção oral mais comum nos pacientes com HIV/AIDS. Estima-se que sua prevalência na América Latina seja aproximadamente 40% das lesões orais, segundo Ranganathan et al.3. É causada pelo fungo Candida albicans e, frequentemente, ocorre no início da infecção pelo HIV, em pacientes previamente assintomáticos e em 90% dos com AIDS. Um fator bem estabelecido para o aparecimento da candidíase oral é a queda dos níveis de linfócitos T CD4+ circulantes2,4-6. A infecção é considerada um marcador clínico da falha do tratamento com antirretrovirais com ou sem uso de inibidores de protease2,7. As três apresentações mais comuns da candidíase na cavidade oral de pacientes infectados pelo HIV são a pseudomembranosa, a eritematosa e a queilite angular5.
A queilite angular é caracterizada por lesões eritematosas ou fissuras nos cantos da boca. A candidíase eritematosa apresenta-se com lesões atróficas ou máculas avermelhadas em palato e dorso de língua, mas podem estar presentes em outras áreas da língua. A forma pseudomembranosa aguda é a mais comum, com placas brancas ou amareladas aderentes à mucosa, de fácil remoção, deixando a mucosa subjacente hiperemiada e, por vezes, sangrante5,8. As formas eritematosa e pseudomembranosa podem ocorrer simultaneamente8. Nos casos de imunodeficiência grave, as lesões podem disseminar-se por toda a extensão da cavidade bucal5. O diagnóstico é clinico8.
2. Leucoplasia Pilosa: é uma lesão de coloração esbranquiçada, de superfície rugosa e irregular que não se destaca, em face lateral da língua. Causada pelo vírus Epstein-Barr, geralmente é assintomática. É também considerada um marcador confiável tanto de infecção pelo HIV como de falha do esquema antirretroviral e da progressão da infecção2,6,7. Está relacionada, assim como a candidíase oral, a uma queda dos níveis de CD4 circulantes em pacientes soropositivos6,9. É importante observar que, entretanto, não é exclusiva dos pacientes soropositivos, ocorrendo em outros estados de imunossupressão e, mais raramente, em pessoas sem comprometimento do sistema imunológico10.
Seu tratamento visa à redução do tamanho da lesão e não a sua erradicação. É indicado nos casos em que a leucoplasia pilosa interfere na alimentação ou por motivos estéticos, no entanto ainda não há estudos que indicam um tratamento de escolha11.
3. Estomatite Aftoide Recorrente (EAR): é uma entidade mórbida caracterizada pelo aparecimento de úlceras (aftas) dolorosas, de tamanho e duração variáveis, que são tipicamente encontradas na mucosa bucal não-queratinizada. Apesar de inúmeras pesquisas, as causas da EAR ainda são pouco conhecidas12. Três formas principais de aftas são encontradas: minor, major e herpetiforme. Elas se distinguem umas das outras pelo número, tamanho e duração, embora nem sempre seja possível diferenciá-las claramente12,13.
A associação de úlceras major está diretamente relacionada ao estado imunitário do paciente soropositivo. Miziara et al. notaram em estudo com 94 pacientes soropositivos ou com AIDS com EAR que as aftas do tipo major apresentaram menor contagem de células CD4+ e CD8+ e maior inversão da relação CD4+/CD8+ do que aqueles com úlceras minor e herpetiforme. Não fosse o bastante, o número de pacientes com aftas major e contagem absoluta de células CD4+ abaixo de 60 foi maior do que aqueles portadores de aftas herpetiformes e minor13.
O tratamento mais efetivo é o uso da talidomida, devendo-se ser ponderado o risco/benefício devido à toxicidade e a teratogenicidade do medicamento14. Estudo multicêntrico realizado em 2001 por Jacobson et al., comparando doses baixas intermitentes de talidomida (100mg, 3 vezes por semana) e placebo para a prevenção de ulcerações orais e esofágicas em pacientes tratados com sucesso com talidomida no passado, demonstrou que essa droga não foi eficaz neste propósito11,15.
4. Sarcoma de Kaposi (SC): clinicamente, assemelha-se a outras lesões vasculares, como hemangioma, equimose ou acúmulo de pigmento melânico, com manchas, placas planas ou nodulações, e pode se tornar sintomática quando ocorre infecção secundária ou trauma, causando dor e distúrbios na deglutição e fala5. Com o uso da terapia antirretroviral (TARV), sua incidência reduziu drasticamente16.
Os principais locais da cavidade oral acometidos são o palato e a gengiva, podendo ser encontrados em praticamente toda a cavidade8. Apresenta associação com o herpes vírus humano (HPV) 8 8,10 e 4 10. O diagnóstico definitivo é feito por biópsia e o tratamento consiste em radioterapia, aplicação de agentes quimioterápicos locais de vimblastina ou tetradecil sulfato sódico e, eventualmente, exérese cirúrgica5,10,11. A quimioterapia sistêmica pode ser uma opção nos casos de tumores avançados8.
5. Herpes Simples: nessa afecção, a reativação do vírus latente no gânglio trigeminal é a principal forma de acometimento dos pacientes soropositivos está relacionada à queda dos níveis de CD4 circulantes e ao aumento da carga viral. Lesões em lábios ou mucosa bucal com vesículas que resultam em úlceras irregulares coalescentes dolorosas com margens esbranquiçadas são características5. No tratamento do herpes simples deve-se levar em conta a contagem de CD4. Nos casos de contagem acima de 200, deve ser considerado o tratamento tópico para o herpes simples perioral até o total desaparecimento das lesões. Se a contagem de CD4 for inferior a 200, ou se as lesões forem extensas ou, ainda, se o paciente não respondeu ao tratamento tópico, deve ser utilizado um antiviral sistêmico, como o aciclovir. Casos mais graves requerem uso de medicação endovenosa. Nos casos de pacientes portadores de cepas resistentes ao aciclovir, pode ser usado foscarnet endovenoso11.
6. Herpes Zoster: o varicela-zoster vírus está associado a lesões crônicas, recorrências frequentes e até morte, caso haja disseminação do vírus nos imunossuprimidos. Cerca de 15% a 20% dos casos de herpes zoster envolvem o nervo trigêmeo, especialmente em sua primeira divisão, acarretando lesões oculares e em couro cabeludo. Quando atinge a 2ª e 3ª divisões há acometimento da boca e face, com bolhas, vesículas e dor unilateral. Os principais sítios na cavidade oral são palato, língua e lábios11.
O tratamento deve ser iniciado o mais precoce possível devido à alta taxa de neuralgia pós-herpética no paciente soropositivo11. Consiste no uso de aciclovir, sendo indicada a via endovenosa nos casos de disseminação viral. O famciclovir e o valaciclovir são outras opções terapêuticas. A neuralgia pós-herpética pode ser tratada com antidepressivos tricíclicos e corticosteroides intralesionais11.
7. Lesões Causadas pelo Papilomavírus Humano (HPV): assim como a candidíase oral, as lesões causadas pelo HPV (papilomas, hiperplasia epitelial focal ou condiloma acuminado) ocorrem mais frequentemente quando os níveis de CD4 estão reduzidos9. No entanto, diferentemente da candidíase oral e da leucoplasia pilosa, as taxas de infecção pelo HPV não se reduziram com a introdução da terapia antirretroviral5,11. O tipo mais associado é o 32 17.
O tratamento dessas lesões não é bem estabelecido, podendo ser realizado com agentes ácidos/cáusticos, cantaridina, podofilina tópica, cidofovir tópico, interferon-α intralesional, bleomicina intralesional, 5-fluoracil tópico ou tratamento cirúrgico (criocirurgia, laser de CO2, curetagem ou ressecção com lâmina fria)11.
8. Doenças Periodontais: as principais doenças periodontais que ocorrem no paciente HIV/AIDS são o eritema linear gengival, a gengivite ulcerativa necrotizante e a periodontite ulcerativa necrotizante. O eritema linear gengival apresenta-se como uma intensa faixa de eritema vascular circundando a gengiva marginal e áreas de pontilhado, podendo estar acompanhada de desconforto e sangramentos gengivais. Apresenta frequência de 2% a 6% nos países em desenvolvimento3.
Alguns estudos apontam para uma relação entre a colonização gengival por espécies de Candida e doenças periodontais no paciente HIV, incluindo o eritema linear gengival. A classificação mais recente da Academia Americana de Periodontologia classifica o eritema linear gengival dentro da categoria de doenças gengivais de origem fúngica5,18.
A periodontite ulcerativa necrotizante diferencia-se da gengivite ulcerativa necrotizante devido à rápida destruição de tecido mole e osso, com perda de dentes, sangramento, dor intensa, odor fétido. O tratamento inclui, além das medidas já anteriormente citadas para o eritema linear gengival, o uso de terapia antibiótica5,11.
9. Tuberculose Oral: é muito rara, acometendo 1,33% dos pacientes soropositivos, segundo Miziara et al.19. O quadro clínico caracteriza-se por lesões ulceradas superficiais ou massas papilomatosas, geralmente em palato e dorso da língua, podendo ser únicas ou múltiplas, associadas ou não a dor ou sangramento. A lesão oral pode ser a manifestação tanto da infecção primária quanto da secundária19. O diagnóstico é feito pela biópsia e cultura e o tratamento é o mesmo realizado em pacientes imunocompetentes19.
10. Linfomas: o risco de uma pessoa portadora de HIV apresentar Linfoma não-Hodgkin é 50 a 200 vezes maior do que na população geral; até 5% dos indivíduos soropositivos desenvolvem-no na ausência de terapia antirretroviral20, só perdem para o Sarcoma de Kaposi em frequência entre os tumores associados à AIDS.
Os usuários de drogas injetáveis soropositivos são particularmente afetados. As manifestações bucais ocorrem na gengiva e processo alveolar, podendo-se estender para o palato. As tonsilas são sítio de algumas lesões.
O vírus Epstein-Barr tem sido identificado em material colhido das lesões. O diagnóstico é feito por biópsia e o tratamento por rádio e quimioterapia combinados21.
O tratamento quimioterápico mais comumente utilizado é o esquema CHOP (ciclofosfamida, doxorrubicina, adriamicina, vincristina e prednisona)20.
Manifestações nasossinusais
1. Rinossinusite: é muito comum nos pacientes soropositivos, com uma prevalência que varia de 30% a 68%22. A maior susceptibilidade ao desenvolvimento da rinite alérgica, associada a uma diminuição do clearence mucociliar e a disfunção imunocelular contribuem para o acometimento dos seios paranasais1,23,24.
Os microorganismos responsáveis pela infecção aguda na população geral são os mesmos encontrados nos indivíduos infectados pelo vírus da imunodeficiência humana, devendo o otorrinolaringologista adotar o mesmo tratamento que nos pacientes imunocompetentes1,23. Observa-se, no entanto, nestes pacientes maior incidência de Estafilococos e Pseudomonas, seja nos quadros agudos ou crônicos. Os germes oportunistas devem ser lembrados quando há progressão da doença para um estado de imunossupressão, sobretudo quando a contagem de linfócitos T CD4 estiver abaixo de 200 células23.
O quadro clínico nas infecções agudas é semelhante ao de indivíduos não infectados: cefaleia, febre, descarga nasal purulenta, obstrução nasal e gotejamento posterior. No entanto, pacientes imunodeprimidos não são capazes de desenvolver uma resposta inflamatória e, muitas vezes, nestes pacientes as manifestações clínicas de um quadro sinusal podem ser caracterizadas apenas por tosse crônica, infecções pulmonares recorrentes, febre de foco indeterminado ou infecções do sistema nervoso central24. Nos indivíduos com rinossinusite crônica, Miziara et al. observaram a presença de rinorreia purulenta, obstrução nasal e cefaleia como as queixas mais comuns25.
Exames de imagem, como Tomografia Computadorizada (TC) ou Ressonância Magnética (RM), são úteis para o diagnóstico ou em casos de sinusite complicada.
O tratamento clínico dos casos agudos ou crônicos é semelhante ao de indivíduos não infectados. O uso de antibióticos com espectro para Estafilococos e Pseudomonas deve ser considerado. O tempo de tratamento ainda é controverso, recomendando-se atualmente três semanas nos casos agudos e 4-6 semanas nos crônicos1,23. O uso de descongestionante, tópico ou sistêmico, também é útil23.
A antibioticoterapia guiada pela cultura do seio acometido é reservada para pacientes que não responderam ao tratamento inicial ou que se apresentaram toxemiados ou com CD4 abaixo de 50 cels./mm3 no início do quadro. Nos casos refratários, sinusite complicada, infecções oportunistas ou neoplasias devem ser investigadas e afastadas como possíveis responsáveis pela falha do tratamento. Diante destas suspeitas, deve-se proceder rapidamente exames de imagem23.
A cirurgia endoscópica pode ser benéfica nos casos crônicos ou refratários tanto se para restabelecer a drenagem do seio, como auxílio no diagnóstico. No entanto, ainda faltam dados na literatura que possam garantir o sucesso cirúrgico nos pacientes soropositivos23.
2. Rinite Alérgica: o desenvolvimento ou exacerbação dos quadros alérgicos, inclusive da rinite alérgica, é duas vezes mais comum no paciente soropositivo23. Acredita-se que seja uma consequência da ativação policlonal de linfócitos B, que leva a um aumento das imunoglobulinas, em especial a Ig E. É este aumento de Ig E que desencadeia os sintomas alérgicos nestes pacientes1,23.
O quadro clínico é semelhante nos pacientes imunocompetentes, caracterizando-se principalmente pela presença de rinorreia espessa e obstrução nasal. O tratamento pode ser feito com corticosteroides tópico e uso de anti-histamínicos1.
A imunoterapia é uma importante ferramenta para os pacientes com rinite alérgica refratários ao tratamento clínico habitual. No entanto, seu uso em pacientes soropositivos ainda é limitado. Randhawa et al. relataram um caso de um paciente soropositivo de 44 anos, com rinite alérgica refratária e em uso de TARV, que fez uso da imunoterapia. Observaram que a imunoterapia pode ter levado a uma proliferação discreta dos linfócitos T CD 4, bem como aumento moderado da carga viral, mas que se reverteram com a manutenção do terapia antirretroviral26.
3. Neoplasias: as principais neoplasias relacionadas ao paciente soropositivo são o Sarcoma de Kaposi (SK) e o Linfoma24. O SK pode acometer a mucosa de qualquer área do trato aerodigestivo superior, inclusive a nasofaringe. A lesão pode se apresentar sob a forma de placa ou nódulos, semelhantes a tecido de granulação24. O Linfoma não-Hodgkin (LNH) também pode estar presente na cavidade nasal, causando obstrução nasal com sinusite crônica refratária ao tratamento clínico ou sintomas constitucionais inespecíficos, como febre ou perda ponderal24.
Exames de imagens como a TC são úteis, mas não diferenciam processos tumorais de lesões inflamatórias. Desta forma, diante da forte suspeita clínica, a biópsia deve ser realizada e o diagnóstico definitivo firmado25.
Manifestações Cervicais
1. Linfadenopatia Cervical: é a manifestação cervical mais frequente no paciente soropositivo1. A etiologia é variada, desde causas infecciosas a neoplásicas, sendo o processo reacional o mais comum24. Prasad et al. observaram a presença de linfadenopatia cervical em 42% dos pacientes soropositivos que apresentavam manifestações otorrinolaringológicas da doença1.
A linfadenopatia reacional generalizada está presente em mais de 70% dos pacientes logo nos primeiros meses após a soroconversão. É descrita como um aumento linfonodal difuso que envolve duas ou mais cadeias ganglionares extra-inguinal, por um período superior a 3 meses1. Os linfonodos são simétricos, de consistência amolecida, variando de 1,0 a 5,0 cm de tamanho e localizados, principalmente, no trígono cervical posterior1,24.
Embora seja um processo benigno, em algumas situações a punção aspirativa com agulha fina (PAAF) ou biópsia estão indicados1.Presença de sintomas constitucionais, sem outras manifestações associadas. Linfadenopatia assimétrica ou não generalizada. Aumento desproporcional de linfonodo único em pacientes com adenopatia generalizada. Presença de citopenia periférica, não explicado por outros fatores.
O acometimento cervical pelo Mycobacterium tuberculosis vem aumentando a incidência nos pacientes soropositivos1. Nos indivíduos com doença avançada, 50% a 67% da infecção tuberculosa irá se manifestar em sítio extra-pulmonar, sendo a região cervical um dos principais locais envolvidos24,27. O quadro clínico pode se manifestar apenas com um aumento cervical endurecido1. O PPD e o raio-x de tórax são necessários para confirmar ou afastar a infecção.
Em casos de aumento rápido do volume cervical, de consistência endurecida, o acometimento neoplásico, como o Sarcoma de Kaposi e o LNH, deve ser investigados. Nestes casos, a análise histopatológica é necessária1.
2. Acometimento das glândulas salivares: o envolvimento parotídeo tem sido observado em 5% a 10% dos pacientes infectados pelo HIV28. Nestes pacientes, isto pode ocorrer por processos benignos ou malignos. O envolvimento das parótidas pode provocar xerostomia e aumento indolor e progressivo da glândula24.
Os cistos linfoepiteliais são lesões benignas, altamente específicos da infecção pelo HIV, provavelmente causados pela obstrução glandular secundário à hiperplasia linfonodal intrparotídea24. Representa uma das manifestações iniciais da infecção, raramente encontrados em pacientes com doença avançada30.
Outros processos como linfadenite, inflamação crônica ou aumento reativo de linfonodo intraparotídeo, também podem ser responsáveis pela hipertrofia glandular24.
A TC pode revelar os cistos, quase sempre multiloculados. A punção aspirativa por agulha fina é um método seguro para o diagnóstico, embora esse procedimento possa reduzir o tamanho do cisto, um novo crescimento é esperado. O tratamento cirúrgico é reservado nos casos de infecção secundária ou se houver alteração estética importante24,29.
Em alguns casos, a TC e/ou exame físico podem revelar a presença de uma massa sólida. Nestes pacientes, o risco de comprometimento maligno aumenta consideravelmente, devendo-se excluir o Sarcoma de Kaposi e os Linfomas1. Steele et al. relataram um caso raro de um paciente sem diagnóstico prévio de infecção pelo HIV, com envolvimento parotídeo crônico e bilateral. A análise anatomopatológica do linfonodo intraparotídeo, revelou-se tratar de Sarcoma de Kaposi30.
A Síndrome linfocítica infiltrativa difusa é uma patologia rara, causada pela infiltração visceral por linfócitos T CD8. Riviera et al. demonstraram o papel do vírus Epstein-Barr e do HIV na patogênese desta síndrome, por meio de achados imunoistoquímicos31.
Manifesta-se por linfocitose por aumento de linfócito T CD8 permanente, linfadenopatia cervical e edema parotídeo bilateral ou unilateral32. Além das glândulas salivares, os pulmões também são frequentemente acometidos, apresentando-se clínica e radiologicamente como uma pneumonia por Pneumocystis carinii. Outras manifestações são: neuropatia periférica, infiltração linfocítica do fígado (hepatite), miosite, nefrite intersticial linfocítica33. A biópsia é determinante para a exata natureza do envolvimento parotídeo34 e o tratamento é realizado com a terapia anti-retroviral35.
Manifestações otológicas
O acometimento otológico pelo vírus HIV é raro. No entanto, o desenvolvimento da AIDS causada por este retrovírus abrange uma série de condições clínicas que devem ser reconhecidas pelo médico otorrinolaringologista36, bem como pelo clínico em geral.
Chandrasekhar et al. observaram em séries de casos a presença de manifestações otológicas em 33% dos pacientes infectados pelo vírus HIV. Destes indivíduos, 34% apresentavam plenitude auricular, 32% tontura, 29% hipoacusia, 26% zumbido, 23% otalgia e 5% otorreia. A otite média foi um achado frequente37.
Prasad et al., no acompanhamento durante oito anos de 968 pacientes infectados pelo vírus da imunodeficiência humana, encontraram o acometimento otológico em 20% dos casos, sendo a otite média crônica supurativa a doença mais comum (13%)1.
As manifestações clínicas relacionadas ao envolvimento da orelha externa e média na AIDS são variadas. Podem ser causadas, mais comumente, por infecções otológicas casuais, bem como por doenças oportunistas. As principais são: otite externa; otomicose; otite média aguda (OMA) e otite média aguda recorrente (OMAR); otite média secretora; otite média crônica supurativa; herpes zoster oticus. Dentre as doenças oportunistas, estão: otite externa maligna; otite média crônica secundária à infecção por Pneumocistis jiroveci; neoplasias (Sarcoma de Kaposi)1,36,38,39.
1. Otite Externa Aguda: a incidência de otite externa aguda não é aumentada nos pacientes com AIDS em comparação à população geral1. É causada tipicamente por Pseudomonas aeruginosa e, menos comumente, espécies de Aspergillus e Proteus. Irritação excessiva da pele e trauma são os principais fatores predisponentes. Ao exame, o conduto auditivo externo (CAE) pode estar edemaciado e eritematoso, com debris purulentos em seu interior, levando a uma hipoacusia condutiva24.
O tratamento baseia-se no uso de gotas tópicas com ação antipseudomonas e limpeza frequente do CAE24.
2. Otite Externa Maligna: primeiramente denominada por Chandler em 1968, a otite externa maligna (OEM) é uma infecção necrotizante do conduto auditivo externo (CAE) que se estende às regiões mastoidea e petrosa do osso temporal, podendo levar à osteomielite de base de crânio36,40. Embora acometa principalmente indivíduos idosos e diabéticos, pacientes imunocomprometidos (infectados pelo HIV, em quimioterapia etc.) também são susceptíveis a esta afecção36,41,42.
Pseudomonas aeruginosa é o agente causal na grande maioria dos casos41,43. Nos indivíduos HIV positivos, relatos de OEM por Proteus mirabilis ou Aspergillus fumigatus já foram apresentados40. Numa revisão retrospectiva de sete pacientes com AIDS que foram diagnosticados com OEM entre 1990 e 1995, Ress et al. encontraram, no entanto, apenas dois pacientes cujas culturas da secreção do conduto auditivo externo foram positivas para Pseudomonas aeruginosa. Isto pode ser explicado provavelmente pelo uso prévio de drogas antipseudomonas para infecções adquiridas na comunidade, bem como pelo grau de imunodeficiência43.
A infecção pela Pseudomonas aeruginosa é uma infecção oportunista, raramente ocorrendo em indivíduos sadios. Esta bactéria gram-negativa não faz parte da flora normal do CAE, colonizando-o após pequenos traumas ou exposição excessiva a água41. No paciente soropositivo, defeitos na imunidade, como a presença de outras infecções oportunistas (CMV, por exemplo) favorecem o desenvolvimento da OEM complicada com osteomielite de base de crânio36,40,44.
O quadro clínico é semelhante tanto nos pacientes com AIDS/soropositivos, quanto nos indivíduos com imunidade celular e humoral normal40. É caracterizado por otalgia intensa refratária a analgésicos e que piora a noite, cefaleia temporal ou em região mastoidea e dor na articulação têmporo-mandibular. Febre não é comum. Otorreia está presente na maioria dos casos40,41. Na otoscopia, não é comum a presença de tecido de granulação no CAE, ao contrário dos indivíduos soronegativos. No entanto, o seu achado é indicador de imunidade e prognóstico favorável41,43. O acometimento de nervos cranianos pode acontecer em qualquer fase da doença. Outras complicações incluem abscesso cerebral, meningite, trombose de seio venoso etc40,41.
O diagnóstico é baseado em achados clínicos e radiológicos. Na suspeita clínica de OEM, exames de imagem devem ser realizados, preferencialmente uma tomografia computadorizada de ossos temporais. Este exame é muito útil ao demonstrar a extensão da lesão, avaliação da resposta terapêutica e identificação de recorrência40,43. O tratamento baseia-se no uso da combinação de drogas antipseudomonas, como ciprofloxacino e ceftazidime, durante um período prolongado, pois reduzem significativamente a mortalidade destes pacientes40,41. Pacientes com OEM de etiologia fúngica devem ser tratados com limpeza local e antifúngicos, como anfotericina B ou itraconazol41.
3. Otomicose: é uma infecção crônica e superficial do CAE, geralmente causada pelo Aspergillus niger36. A otomicose pode ocorrer devido ao uso prévio de antibióticos ou na vigência de infecção bacteriana45. O quando clínico é semelhante ao de uma otite externa bacteriana, porém o diagnóstico definitivo depende da identificação histopatológica de invasão fúngica, já que o Aspergillus é quase sempre um microorganismo saprófito do CAE 36. O tratamento clínico é baseado na limpeza do CAE, bem como no uso de antifúngicos tópicos. Se o tratamento clínico inicial não for eficaz, deve-se aventar a possibilidade de infecção fúngica invasiva dos tecidos. Neste momento, avaliação radiológica da extensão da doença com tomografia computadorizada ou ressonância magnética pode ser realizada45. Na infecção fúngica invasiva, desbridamento cirúrgico dos tecidos e antifúngicos sistêmicos estão indicados36,45.
4. Otite Média Aguda (OMA) e Otite Média Aguda Recorrente (OMAR): estudos de ossos temporais de indivíduos soropositivos têm demonstrado a presença de alterações inflamatórias da mucosa da orelha média em graus variados, mesmo em indivíduos assintomáticos, confirmando o envolvimento otológico pelo vírus46,47.
A OMA é uma infecção comum tanto em crianças soropositivas, quanto nas não infectadas48, podendo resultar em grande morbidade devido à perda auditiva a que induz49. Miziara et al., no acompanhamento de 459 crianças brasileiras imunocomprometidas pelo vírus da imunodeficiência humana, relataram o envolvimento da orelha média como sendo a manifestação otorrinolaringológica mais frequente50. Barnett et al. observaram que até os três anos de idade, todas as crianças infectadas pelo vírus irão apresentar pelo menos um episódio de otite média aguda. Já as crianças soronegativas apresentarão uma prevalência de 75% de OMA na mesma idade51. As crianças infectadas pelo vírus HIV são mais susceptíveis à otite média aguda, do que os adultos soropositivos52, embora Chandrasekhar et al. tenham observado o desenvolvimento de otite média em 23% destes pacientes37.
A OMAR é definida pela ocorrência de três ou mais episódios de OMA, num período de seis meses. Estes episódios estão associados com o nível de linfócitos T CD4, sendo mais frequentes no hospedeiro imunocomprometido48,53.
Vários estudos confirmam que os microorganismos mais comumente responsáveis pelos episódios de OMA nas crianças soropositivas, sem imunossupressão, são semelhantes aos encontrados nos indivíduos imunocompetentes: Streptococcus pneumoniae e Haemophilus influenzae49,54. As crianças imunocomprometidas, além da maior recorrência dos episódios48, podem ter o Staphylococcus aureus como possível agente etiológico49. OMA secundária à infecção por micobactéria, P. carinii, P. aeruginosa, entre outros, já foram relatados.
O quadro clínico é semelhante à infecção na criança não contaminada pelo vírus. Os indivíduos imunossuprimidos apresentam episódios mais graves e com riscos maiores de complicações, com meningite e bacteremia55. A abordagem terapêutica realizada pelo otorrinolaringologista é semelhante aos dos pacientes imunocompetentes, feita com antibioticoterapia contra os germes habituais, devendo-se realizar timpanocentese com coleta de material para análise ou ampliação da cobertura para S. aureus no caso de falha terapêutica inicial49. Nos casos de OMAR, Zucotti et al. demonstraram uma redução de episódios de OMA em 100% das crianças submetidas à antibioticoprofilaxia com cefaclor por um período de 6 meses53. O uso da vacina antipneumocócica heptavalente mostrou-se eficaz e imunogênica nos pacientes HIV positivos, porém crianças com infecção sintomática pelo vírus foram mais susceptíveis a reações adversas56.
5. Otite Média Secretora: o desenvolvimento da otite média com efusão está relacionado com a disfunção da Tuba de Eustáquio, geralmente secundária a otites de repetição ou atopia, ou obstrução da mesma por algum fator nasofaríngeo (hiperplasia linfoide, principalmente)24,54,57. Desta forma, é de se esperar que as crianças soropositivas que apresentem episódios de OMAR sejam mais susceptíveis à persistência de efusão na orelha média58.
É uma importante causa de hipoacusia condutiva, podendo levar a déficits no desenvolvimento da linguagem54. O tratamento dos fatores predisponentes, na maioria das vezes, leva à resolução dos sintomas57. Todavia, miringotomia com colocação de tubo de ventilação pode ser necessária54.
6. Otite Média Crônica Supurativa (OMCS): é uma inflamação crônica do ouvido médio e da mastoide associado a episódios de otorreia por uma membrana timpânica perfurada. Bernaldez et al. observaram, num período de dez anos, a prevalência desta doença em crianças soropositivas de 13,24%, com uma incidência anual de 3,31%59. Os microorganismos predominantemente isolados neste estudo foram P. aeruginosa e Proteus. O tratamento deve ser voltado para os germes encontrados, além da melhoria da imunidade do paciente59. O uso da terapia antirretroviral potente mostrou reduzir a prevalência da OMC nas crianças imunocomprometidas, provavelmente por aumentar o número de linfócitos T CD450.
7. Infecção pelo Pneumocistis jiroveci: o P. jiroveci é, provavelmente, o patógeno mais comum do paciente HIV/AIDS39. O principal local de acometimento é o pulmão, mas focos extrapulmonares já foram descritos, sobretudo no osso temporal57.
A infecção extrapulmonar pode ocorrer por diversas vias: hematogênica, linfática, contaminação via conduto auditivo externo através da membrana timpânica ou, ainda, disseminação retrógrada pela Tuba de Eustáquio. A origem embriológica semelhante do epitélio da membrana timpânica e dos alvéolos pulmonares é uma hipótese possível para o desenvolvimento da infecção pelo P. jiroveci naquela região60.
Clinicamente, os pacientes apresentam hipoacusia condutiva, otalgia e otorreia. Nódulos subcutâneos ou pólipos no conduto auditivo externo estão presentes. Ocasionalmente, pode ter acometimento bilateral ou sob a forma de otite média e mastoidite36. Nem sempre o envolvimento pulmonar ocorre concomitantemente.
Deve-se suspeitar desta infecção oportunista, frente a um paciente soropositivo com pólipos de CAE refratário ao tratamento clínico habitual. Nestes casos, deve-se proceder à biópsia da lesão para afastar não só o processo infeccioso, mas também algum acometimento maligno61.
O tratamento é feito com uso de sulfametoxazoltrimetropim por um período de três semanas36.
8. Sarcoma de Kaposi: é uma neoplasia de crescimento progressivo definidora de AIDS62. Pode se apresentar sob a forma de lesões difusas no pavilhão auricular ou na membrana timpânica, ou, ainda, lesões exofíticas do conduto auditivo externo, provocando perda auditiva condutiva. O tratamento varia desde a excisão cirúrgica até químio e radioterapia24.
9. Perda auditiva neurossensorial: a incidência nos pacientes HIV varia de 23 a 49%. A possível etiologia é a infecção primária pelo HIV no sistema nervoso central ou no nervo auditivo1. Devem ser consideradas outras causas de perda auditiva neurossensorial, como infecção do SNC, neoplasias, drogas ototóxicas1,24. A maioria dos pacientes se apresenta com uma perda neurossensorial pior nas frequências mais altas, porém com a discriminação da fala próximo ao normal.O tratamento é voltado para a causa específica, considerando-se reabilitação auditiva e uso de próteses1.
10. Paralisia facial periférica: a presença de manifestações neurológicas representa uma importante causa de morbidade e mortalidade nos pacientes soropositivos. A neuropatia periférica varia entre 5% e 20% das complicações neurológicas, sendo a paralisia facial periférica rara63,64. A paralisia facial periférica pode ocorrer em qualquer estágio da infecção pelo HIV, sendo mais comum nos estágios iniciais. Nesta fase, o paciente pode desenvolver tanto uma paralisia de Bell, como uma síndrome de Guillain-Barre. Nos casos mais avançados, de imunossupressão instalada, a paralisia facial periférica é geralmente secundária a infecções oportunistas do sistema nervoso central, como a neurotoxoplasmose e o linfoma23.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Prasad HK, Bhojwani KM, Shenoy V, Prasad SC. HIV manifestations in otolaryngology. Am J Otolaryngol.2006;27(3):179-85.
2. Ranganathan K, Hemalatha R. Oral lesions in HIV infection in developing countries: an overview. Adv Dent Res.2006;19(1):63-8.
3. Miziara ID, Weber R. Oral candidosis and oral hairy leukoplakia a predictors of HAART failure in Brazilian HIV-infected patients. Oral Dis.2006;12:402-7.
4. Pienaar ED, Young T, Holmes H. Interventions for the prevention and management of oropharyngeal candidiasis associated with HIV infection in adults and children. (Cochrane Review). In: The Cochrane Library, Issue 3, 2007. Oxford: Update Software.
5. Reznik DA. Oral manifestations of HIV disease. Top HIV Med.2005-2006;13(5):143-8.
6. Hodgson TA, Greenspan D, Greenspan JS. Oral lesions of HIV disease and HAART in industrialized countries. Adv Dent Res.2006;19:57-62.
7. Ramirez-Amador V, Ponce-de-Leon S, Anaya-Saavedra G, Ramirez BC, Sierra-Madero J. Oral Lesions as Clinical Markers of Highly Active Antiretroviral Therapy Failure: A Nested Case-Control Study in Mexico City. Clin Infect Dis.2007;45(7)925-32.
8. Reichart PA. Oral manifestations in HIV infection: fungal and bacterial infections, Kaposi's sarcoma. Med Microbiol Immunol.2003;192:165-9.
9. Lilly EA, Cameron JE, Shetty KV, Leigh JE, Hager S, McNulty KM, et al. Lack of evidence for local immune activity in oral hairy leukoplakia and oral wart lesions. Oral Microbiol Immunol.2005;20(3):154-62.
10. Webster-Cyriaque J, Duus K, Cooper C, Duncan M. Oral EBV and KSHV infection in HIV. Adv Dent Res.2006;19(1):91-5.
11. Baccaglini L, Atkinson JC, Patton LL, Glick M, Ficarra G, Peterson DE. Management of oral lesions in HIV-positive pacients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod.2007;103(suppl 01):S50.e1-S50e23.
12. Kerr AR, Ship JA. Management strategies for HIV-associated aphthous stomatitis. Am J Clin Dermatol.2003;4(10):669-80.
13. Miziara ID, Araujo Filho BC, Weber R. AIDS e estomatite aftoide recidivante. Braz J Otorhinolaringol.2005;71(4):517-20.
14. Jacobson JM, Greenspan JS, Spritzler J, Ketter N, Fahey JL, Jackson JB, et al. Thalidomide for the treatment of oral aphthous ulcers in patients with human immunodeficiency virus infection. New Engl J Med.1997;336(21):1487-93.
15. Jacobson JM, Greenspan JS, Spritzler J, Fox L, Fahey JL, Jackson JB, et al. Thalidomide in low intermittent doses does not prevent recurrence of human immunodeficiency virus associated aphthous ulcers. J Infect Dis.2001;183(2):343-6.
16. Kalpidis CDR, Lysitsa SN, Lombardi T, Kolokotronis AE, Antoniades DZ, Samson J. Gingival involvement in a case series of patients with Acquired Immunodeficiency Syndrome-related Kaposi sarcoma. J Periodontol.2006;77(3):523-32.
17. Baumgarth N, Szubin R, Dolganov GM, Watnik MR, Greenspan D, Da Costa M, et al. Highly tissue substructure-specific effects of human papilloma virus in mucosa of HIV-infected patients revealed by laser-dissection microscopy assisted gene expression profiling. Am J Pathol.2004;165(3):707-18.
18. Robinson PG, Sheiham A, Challacombe SJ, Zakrzewska JM. Periodontal health and HIV infection. Oral Dis. 1997;3(suppl 1):S149-52.
19. Miziara ID. Tuberculosis affecting the oral cavity in Brazilian HIV-infected patients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod.2005;100(2):179-82.
20. Ministério da Saúde - Secretaria de Vigilância em Saúde - Programa Nacional de DST e AIDS. Recomendações para terapia anti-retroviral em adultos e adolescentes infectados pelo HIV 2007/2008. Documento preliminar. Brasília - DF 2007.
21. Carbone A, Gloghini A. AIDS-related lymphomas: from pathogenesis to pathology. Br J Haematol.2005;130(5):662-70.
22. Tami T, Wawrose SF. Disease of the nose and paranasal sinuses in the human immunodeficiency virus-infected population. Otolaryngol Clin North Am.1992;25:1199-210.
23. Gurney T, Lee K, Murr A. Contemporary issues in rhinosinusitis and HIV infection. Curr Opin Otolaryngol Head Neck Surg.2003;11(1)45-8.
24. Gurney T, Murr A. Otolaryngologic manifestations of human immunodeficiency virus infection. Otolaryngol Clin N Am.2003;36:607-24.
25. Miziara ID, Araujo Filho BC, La Cortina RC, Romano FR, Lima AS. Chronic rhinosinusitis in HIV-infected patients: radiological and clinical evaluation. Rev Bras Otorrinolaringol.2005;71(5):604-8.
26. Randhawa IS, junaid I, Klaustermeyer WB. Allergen immunotherapy in a patient with human immunodeficiency virus: effect on T-cell activation and viral replication. Ann Allergy asthma Immunol.2007;98(5):495-7.
27. Srirompotong S, Ymtae K, Srirompotong S. Tuberculosis in the upper aerodigestive tract and human immunodeficiency virus coinfections. J Otolaryngol.2003;32(4):230-3.
28. Mandel L, Surattanont F. Regression of HIV parotid swellings after antiviral therapy: case reports with computed tomographic scan evidence. Oral Surg Oral Med Oral Pathol Oral Raiol Endod.2002;94(4):454-9.
29. Favia G, Capodiferro S, Scivetti M, Lacaita MG, Filosa A, Lo Muzio L. Multiple parotid lymphoepitelial cysts in patients with HIV-infection: report of two cases. Oral Dis.2004;10(3):151-4.
30. Steele NP, Sampogna D, Sessions RB. Kaposi´s Sarcoma of an Intraparotid Lymph Node Leading to a Diagnosis of HIV. Laryngoscope.2005;115:861-3.
31. Riviera H, Nikitakis NG, Castillo S, Siavash H, Papadimitriou JC, Sauk JJ. Histopathological analysis and demonstration of EBV and HIV p-24 antigen but not CMV expression in labial minor salivary glands of HIV patients affected by diffuse infiltrative lymphocytosis syndrome. J Oral Pathol Med.2003;32(7):431-7.
32. Tripathi AK, Gupta N, Ahmad R, Bandhari HS, Kalra P. HIV disease presenting as parotid lymphoepitelial cysts: a presumptive diagnosis of diffuse infiltrative lymphocytic syndrome. J Assoc Physicians India.2004;52:921-3.
33. Franco-Paredes C, Rebolledo P, Folch E, Hernandez I, del Rio C. Diagnosis of diffuse CD 8+ lymphocytosis syndrome in HIV- infected patients. AIDS Read.2002;12(9):408-13.
34. Feller L, White JP, Bouckaert M, Muthupei MN. Diffuse infiltrative CD 8+ lymphocytosis syndrome: review of the literature and repor of a case. SADJ.2007;62(7):214-7.
35. Basu D, Williams FM, Ahn CW, Reveille JD. Changing spectrum of the diffuse infiltrative lymphocytosis syndrome. Arthritis Rheum.2006;55(3):466-72.
36. Rinaldo A, Brandwein M, Devaney K, Ferlito A. AIDS-related Otological Lesions. Acta Otolaryngol.2003;123:672-4.
37. Chandrasekhar SS, Conelly PE, Brahmbhatt SS, Shah CS, Kloser PC, Baredes S. Otologic and audilogic evaluation of human immunodeficiency virus-infected patients. Am J Otolaryngol.2000;21(1):1-9.
38. Morris MS, Prasad S. Otologic disease in the acquired immunodeficiency syndrome. Ear Nose Throat J.1990;69(7):451-3.
39. Madriz JJ, Herrera G. Human Immunodeficiency Virus and Acquired Immune Deficiency Syndrome AIDS-related Hearing Disorders. J Am Acad Audiol.1995;6:358-64.
40. Hern JD, Almeyda J, Thomas DM, Main J, Patel KS. Malignant otitis extern in HIV and AIDS. J Laryngol Otol.1996;110:770-5.
41. Gangadhar SS, Kwartler JA. Skull base osteomyelitis secondary to malignant otitis externa. Curr Opin Otolaryngol Head Neck Surg.2003,11:316-23.
42. Rubin Grandis J, Branstetter BF. The changing face of malignant (necrotizing) external otitis: clinical, radiological, and anatomic correlations. Lancet Infect Dis.2004;4(1):34-9.
43. Ress B, Luntz M, Telischi F, Balkany TJ, Whiteman MLH. Necrotizing External Otitis in Patients with AIDS. Laryngoscope.1997;107(4):456-60.
44. Kielofner M, Atmar RL, Hamill RJ, Musher DM. Life-threatening Paseudomonas aeruginosa infectious in patients with human immunodeficiency virus infection. Clin Infect Dis.1992;14(2):403-11.
45. Strauss M, Fine E. Aspergillus Otomastoiditis in Acquired Immunodeficiency Syndrome. Am J Otol.1991;12(1):40-53.
46. Chandrasekhar SS, Siverls V, Chandrasekhar HK. Histopatologica And Ultrastructural Changes In The Temporal Bones Of HIV-Infected human Adults. Am J Otol.1992;13(3):207-14.
47. Michaels L, Soucek S, Liang J. The Ear In The Acquired Immunodeficiency Syndrome: I. temporal Bone Histopatologic Study. Am J Otol.1994;15(4):515-22.
48. Newton JP. The causes of hearing loss in HIV infection. Community Ear and Hearing Health:2006;3:1-16 Issue n. 3.
49. Marchisio P, Principi N, Sorella S, Sala E, Tornaghi R. Etiology of acute otitis media in human immunodeficiency virus-infected children. Pediatr Infect Dis J.1996;15(1):58-61.
50. Miziara ID, Weber R, Cunha Filho BA, Pinheiro Neto CD. Otitis media in Brazilian human immunodeficiency virus infected children undergoing antirretroviral therapy. J Laryngol Otol.2007;121:1048-54.
51. Barnett ED, Kline JO, Pelton SI, luginbuhl LM. Otitis media in children born to human immunodeficiency virus-infected mothers. Pediatr Infect Dis J.1992;11:360-4.
52. Godofsky EW, Zinreich J, Armstrong M, Leslie JM, Weickel CS. Sinusitis in HIV-infected patients: a clinical and radiographic review. Am J Med.1992;93:163-70.
53. Zucotti G, Dauria E, Torcoletti M, Lodi F, Bernardo L, Riva E. Clinical and pro-host effects of cefaclor in prophylaxis of recurrent otitis media in HIV-infected children. J Int Med Res.2001;29(4):349-54.
54. Chen AY, Ohlms L, Stewart M, Kline M. Otolaryngologic Disease Progression in Children with Human Immunodeficiency Virus Infection. Arch Otolarynol Head Neck Surg.1996;122(12):1360-3.
55. Shapiro LN, Novelli V. Otitis media in children with vertically-acquired HIV infection: the Great Ormond Street Hospital experience. Int J Ped Otorhinolaryngol.1998;45:69-75.
56. Nachman S, Kim S, King J, Abrams E, Margolis D, Petru A, et al. Safety and Immunogenicity of a Heptavalent pneumococcal Conjugate Vaccine in Infants With Human Immunodeficiency Virus Type 1 infection. Pediatrics.2003;112;66-73.
57. Kohan D, Giacchi RJ. Otologic surgery in patients with HIV-1 and AIDS. Otolaryngol Head Neck Surg.1999;121(4):355-60.
58. Thorp MA. Needle myringotomy: a useful technique with the increased prevalence of the human immunodeficiency virus. J Laryngol Otol.1998;112:865-6.
59. Bernaldez P, Morales G, Hernandez C. Chronic Suppurative Oitis Media in HIV-Infected Children. Otolaryngol Head Neck Surg.2005;133(2):243-4.
60. Praveen CV, Terry RM, Elmahallawy M, Horsfield C. Pneumocystis carinii infection in bilateral aural polyps in a human immunodeficiency virus-positive patient. J Laryngol Otol.2002;116:288-90.
61. Manger DJ, Berg RG. Pneumocystis carinii infection of the middle ear and external auditory canal. Report of a case and review of the literature. ORL J Otorhinolaryngol Relat Spec.2003;65(1):49-51.
62. CDC 1993 revised classification system for HIV infection and expanded surveillence case definition for AIDS among adolescents and adults. MMWR 1992/41 (RR-17).
63. Sasaki M, Leite P, Leite A, Almeida S. Bilateral peripheral facial palsy secondary to lymphoma in a patient with HIV/AIDS. Braz J Infec Dis.2002;6(1):50-4.
64. Kim MS, Yoon HJ, Kim HJ, Nam JS, Choi SH, Kim JM, Song YG. Bilateral peripheral facial palsy in a patient with Human Immunodeficiency Virus (HIV) infection. Med J.2006;47(5):745-7.
1. Médica Otorrinolaringologista, Fellow em Cirurgia Plástica Facial no serviço de Otorrinolaringologia da Universidade de São Paulo - USP.
2. Médica Otorrinolaringologista, Fellowship em Otoneurologia do serviço de Otorrinolaringologia da Universidade de São Paulo.
3. Doutor em Otorrinolaringologia pela Faculdade de Medicina da USP, Chefe do Grupo de Estomatologia da Otorrinolaringologia da Universidade de São Paulo.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 21 de janeiro de 2010. cod. 6887
Artigo aceito em 03 de abril de 2010.