Ano: 2011 Vol. 77 Ed. 1 - Janeiro - Fevereiro - (15º)
Seção: Artigo Original
Páginas: 88 a 95
Avaliação dos níveis séricos de testosterona em pacientes com síndrome da apneia obstrutiva do sono
Evaluation of testosterone serum levels in patients with obstructive sleep apnea syndrome
Autor(es): Fernando Drimel Molina1; Marcela Suman2; Thiago Bittencourt Ottoni de Carvalho3; Vânia Belintani Piatto4; Sebastião Roberto Taboga5; José Victor Maniglia6; Waldir Antônio Tognola7
Palavras-chave: apneia do sono tipo obstrutiva, contagem de células sanguíneas, hipóxia celular, obesidade, testosterona.
Keywords: blood cell count, sleep apnea obstructive, obesity, obstructive, cell hypoxia, testosterone.
Resumo:
Homens com síndrome da apneia obstrutiva do sono (SAOS) podem apresentar diminuição dos níveis de testosterona devido à hipóxia. Objetivos: Relacionar os níveis séricos da testosterona, em pacientes com SAOS, com parâmetros clínico-laboratoriais. Material e Métodos: Foram revisados 103 prontuários de pacientes com SAOS, entre os anos de 2002 e 2009, e coletados os seguintes dados: idade à época da realização da polissonografia, valores do Hematócrito e Hemoglobina, nível sérico da testosterona total, IMC, índice de apneia/hipopneia(IAH) e SatO2. Forma do Estudo: Estudo de casos retrospectivo em corte transversal. Resultados: 79 pacientes (77%) não apresentaram alteração hormonal e 24 (23%) apresentaram níveis séricos inferiores. Dos pacientes com testosterona normal 70% estavam com sobrepeso, enquanto que 63% com testosterona alterada apresentaram obesidade grau I (p<0,05). Os pacientes com testosterona alterada apresentaram as dosagens médias do Ht e da Hb e dos níveis médios do andrógeno significantemente inferiores aos dos pacientes sem alteração androgênica. A média do IMC dos pacientes com alteração hormonal foi significativamente maior que a média daqueles sem alteração. Conclusão: A relação entre o perfil sérico da testosterona matinal e a obesidade e, em menor grau, a idade, o IAH e a hipóxia, podem ser responsáveis pela supressão central da testosterona nesses pacientes. A queda dos valores hematimétricos pode ser relacionada aos baixos níveis circulantes da testosterona.
Abstract:
Males with obstructive sleep apnea syndrome (OSAS) may present decreased testosterone serum levels because of hypoxemia. Aim: To correlate testosterone levels in OSAS patients with laboratory parameters. Material and methods: 103 registries of OSAS patients were reviewed from 2002 to 2009. The following data collected: age when polysomnography was done, hematocrit and hemoglobin levels, total testosterone serum levels, BMI, apnea/hypopnea index (AHI), and O2 saturation. Study Design: A cross-sectional retrospective case study. Results: 79 patients (77%) had no hormonal changes, and 24 patients (23%) had decreased serum levels. In patients with normal testosterone levels, 70% were overweight; 63% with altered testosterone levels had obesity grade I (p<0.05). Patients with altered testosterone levels had significantly lower average doses of Ht, Hb and androgen compared to patients without altered androgen levels. The average BMI of patients with altered hormone levels was significantly higher compared to patients with normal hormone levels. Conclusions: The relationship between morning testosterone levels and obesity, and to a lesser degree age, AHI and hypoxemia may be the cause of central suppression of testosterone in these patients. Decreased blood HT and HB levels may be related to lower levels of circulating testosterone.
![]()
INTRODUÇÃO
A síndrome da apneia/hipopneia obstrutiva do sono (SAHOS) é um distúrbio respiratório relacionado ao sono altamente prevalente, afetando cerca de 4% dos indivíduos adultos do gênero masculino e 2% dos do gênero feminino caracterizada pelo recorrente colapso, sono-induzido, das vias aéreas faríngeas levando a hipoxemia e hipercapnia1. Variáveis tendendo a promover o colapso faríngeo incluem a pressão negativa dentro das vias aéreas durante a inspiração e a pressão positiva fora dessas vias por deposição de gordura e/ou mandíbula pequena2.
Embora os reais mecanismos da apneia/hipopneia do sono sejam ainda desconhecidos, alterações no controle dos músculos das vias aéreas superiores pelo sistema nervoso central são consideradas um importante componente da síndrome3. A patogênese da síndrome é devida a um colapso das vias aéreas superiores cuja patência, para propiciar a respiração normal, é dependente de um músculo dilatador específico. Dentre os músculos das vias aéreas superiores há o genioglosso, principal músculo extrínseco protusor da língua inervado pelo nervo hipoglosso2,4. Contrações do músculo genioglosso, durante a inspiração, contribuem para a efetiva ventilação pulmonar e pela manutenção da abertura das vias aéreas superiores. O sistema neural central controla as funções aéreas desde o nariz até os bronquíolos, sendo um componente integral do sistema regulador da respiração e da patência dessas vias durante a vigília e o sono. Neurônios serotoninérgicos e noradrenérgicos podem fazer vias paralelas estimulando, diretamente, as células motoras do nervo hipoglosso que regulam os músculos dilatadores das vias aéreas superiores. Portanto, a ativação desses neurônios aumenta a atividade do músculo genioglosso4.
A função serotoninérgica é influenciada pela idade e pelos níveis de hormonais sexuais. A produção de serotonina, em neurônios no corno anterior da medula cervical associados aos do núcleo motor do nervo frênico, diminui com a idade5. O estrógeno aumenta os níveis de serotonina por meio de múltiplos mecanismos6. Assim, as mudanças relacionadas à idade no sistema serotoninérgico e sua influência no controle motor respiratório poderiam ocorrer, indiretamente, por meio de alterações nos níveis dos hormônios gonadais7. Os efeitos da idade e dos hormônios sexuais nas respostas à hipóxia, particularmente seus impactos na plasticidade respiratória seguida a uma hipóxia intermitente, pouco têm sido investigados8,9. Tal compreensão é de fundamental interesse uma vez que vários distúrbios respiratórios, incluindo a síndrome da apneia/hipopneia obstrutiva do sono, exibem padrões relacionados à idade e gênero10,11.
Uma vez que a maioria das ações da testosterona no sistema serotoninérgico é mediada pelo estradiol, que é produzido pela ação da aromatase sobre a testosterona, a testosterona per se não pode ser responsável pelas alterações na magnitude da facilitação a longo prazo. A facilitação a longo prazo é uma forma de plasticidade respiratória expressa como um persistente aumento da atividade dos nervos frênico e hipoglosso após hipóxia intermitente. As dosagens dos níveis séricos dos hormônios sexuais refletem os níveis circulantes, mas não necessariamente o nível nas áreas do sistema neural central relacionadas à respiração, tais como a rafe caudal e o núcleo do nervo frênico e do hipoglosso. A aromatase pertence ao grupo das enzimas do citocromo p450 e age como mediador da aromatização (conversão) de andrógenos em estrógenos7. Os neurônios serotoninérgicos no núcleo caudal da rafe projetam-se para os núcleos motor do hipoglosso e frênico, existindo evidências de que os hormônios sexuais modulam a plasticidade respiratória via sistema serotoninérgico.
A depleção de hormônios gonadais pode diminuir a captação serotoninérgica pelo núcleo motor do hipoglosso e frênico, diminuindo, assim, a facilitação a longo prazo. Efeitos androgênicos no sistema serotoninérgico parecem ser indiretos, refletindo a conversão da testosterona em estradiol no sistema neural central12. A depleção do estradiol diminui a síntese, liberação, reutilização e a degradação da serotonina, além de diminuir a serotonina terminal e a densidade do receptor em várias regiões do cérebro. Assim, o estradiol parece ter um papel-chave na modulação da função serotoninérgica influenciando, desse modo, a facilitação a longo prazo respiratória13-15.
Como a SAHOS afeta homens de meia-idade bem mais que mulheres na mesma faixa etária, não é surpresa que a testosterona esteja implicada no controle da respiração. Com o avançar da idade há um declínio dos níveis circulantes de testosterona, estradiol e progesterona em homens16. Alguns efeitos dos hormônios sexuais no controle respiratório são mediados pela conversão da testosterona em estradiol pela aromatase, no cérebro12. Contudo, ainda não está claro se há um declínio idade-associado nos níveis da aromatase que possam contribuir para a perda da plasticidade respiratória associada com o avançar da idade7. Entretanto, há relatos de homens com SAHOS que apresentam baixos níveis de testosterona, independentemente da idade17.
Este estudo teve como objetivos analisar os valores da dosagem quantitativa da testosterona sérica, em pacientes com diagnóstico de síndrome da apneia/hipopneia obstrutiva do sono, a fim de relacioná-los com a faixa etária, o índice de massa corpórea, o índice de apneia/hipopneia, a saturação máxima de oxigênio, o hematócrito e hemoglobina.
CASUÍSTICA E MÉTODO
Este é um estudo retrospectivo, de corte transversal, para o qual foram utilizados os dados obtidos por revisão de prontuário de 103 pacientes com diagnóstico de síndrome de apneia/hipopneia do sono (SAOHS) entre os anos de 2002 e 2009. Para a seleção dos pacientes foram considerados os seguintes critérios de inclusão:
a) preencham os critérios A ou B, mais o C para o diagnóstico da síndrome:
A. sonolência diurna excessiva que não pode ser explicada por outros fatores.
B. dois ou mais dos seguintes critérios que não podem ser explicados por outros fatores:
respiração ofegante ("gasping") durante o sono;
despertares recorrentes do sono;
sono não-reparador;
fadiga diurna;
falta de concentração.
C. monitoramento durante a noite demonstrando mais de cinco episódios de obstrução da respiração por hora, durante o sono. Esses eventos podem incluir qualquer combinação de apneia obstrutiva/hipopneia ou esforços respiratórios relacionados com despertares.
b) dosagem de testosterona total matinal e eritrograma após realização da polissonografia.
c) ausência de qualquer outra anormalidade somática e laboratorial, após realização dos exames físico geral e complementares.
d) ausência de dismorfismo craniofacial ou alterações temporomandibular, investigados pelo exame físico específico.
e) ausência de dependência de drogas, alcoolismo, transtornos depressivos, demência, investigados pela anamnese e avaliações psiquiátricas.
f) ausência de síndromes genéticas aparentes, investigadas pelo exame físico genético-clínico.
g) presença ou não de outros casos na família.
h) idade máxima de 70 anos.
i) IMC < 30.
j) gênero masculino.
Foram coletados os seguintes dados: idade à época da realização da polissonografia, valores do hematócrito (Ht) e hemoglobina (Hb), nível sérico da testosterona total, índice de massa corpórea (IMC), índice de apneia/hipopneia (IAH) e saturação máxima de O2, ambos dados obtidos pelos registros do aparelho de polissonografia (Stellat System QC, Harmonie TM, Canada). Os pacientes foram distribuídos nas seguintes faixas etárias: adulto jovem (18 a 40 anos), adulto (41 a 65 anos) e idoso (>65 anos)18,19. Em relação ao índice da apneia/hipopneia (IAH) os pacientes foram agrupados na seguinte classificação: SAHOS leve (IAH de 5 a 15 eventos/hora), SAHOS moderada (IAH de 16 a 30 eventos/hora), SAHOS grave (IAH > 30 eventos/hora)20,21. Da mesma forma, em relação ao Índice de Massa Corporal (IMC) os pacientes foram agrupados de acordo com a seguinte classificação de acordo com a OMS: peso ideal (18,5-24,9 Kg/m2), sobrepeso (25,0-29,9 Kg/m2) e obesidade Grau I (30,0-34,9 Kg/m2)22. Foi estipulado o limite do IMC < 30, a fim de que maiores graus de obesidade não influenciassem nos níveis séricos da testosterona.
A dosagem quantitativa da testosterona total, após coleta de sangue venoso periférico matinal e adicionado em tubo seco, foi realizada pelo método de imunoensaio competitivo por meio de tecnologia quimioluminescente direta utilizando o sistema comercial ADVIA Centaur (Siemens Medical Solutions Diagnostics, NY, USA). Para a realização do eritrograma foi coletado sangue venoso periférico e adicionado em tubo contendo anticoagulante EDTA. Os parâmetros hematológicos (hematócrito e hemoglobina) foram analisados utilizando um contador de células automático (Horiba ABX Diagnostics, Pentra DF 120, Montpellier, France). Os valores de referência da testosterona total (245-1836 ng/dl), do hematócrito (40,7-50,3%) e hemoglobina (14,5-18,0 g/dl), para o gênero masculino, estão de acordo com os respectivos protocolos dos sistemas de dosagem hormonal e contagem celular utilizados no Laboratório Central do Hospital da Instituição.
O presente estudo foi aprovado pelo Comitê de Ética em Pesquisa (CEP) da Instituição (Parecer Nº 365/2009).
Análise estatística
Os resultados foram submetidos previamente à estatística descritiva para determinação da normalidade. Foram utilizados o teste t bicaudal de Student para amostras independentes com distribuição normal e o teste de Mann-Whitney para amostras com distribuição não normal. Quando aplicável foi utilizado o teste Chi-square para comparação entre as variáveis. Foi estabelecido o nível de significância de 5%.
RESULTADOS
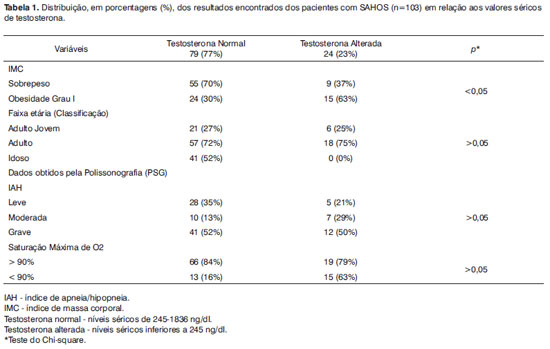
Dos 103 pacientes com SAHOS, 79 (77%) apresentaram níveis de testosterona dentro dos limites da normalidade e 24 (23%) apresentaram níveis inferiores aos valores de referência.
Cinquenta e sete pacientes (72%) com testosterona normal e 18 pacientes (75%) com testosterona alterada eram adultos. Não houve paciente com idade > 65 anos com testosterona alterada.
A análise do Índice de Massa Corporal (IMC) demonstrou que 70% dos pacientes com SAHOS e testosterona normal estava com sobrepeso, enquanto que 63% dos pacientes com SAHOS e testosterona alterada estava com obesidade grau I, sendo esta relação estatisticamente significante (p<0,05).
De acordo com o Índice de Apneia/Hipopneia (IAH), o grau grave foi o mais prevalente tanto para os pacientes com SAHOS e testosterona normal (52%) como para aqueles com SAHOS e testosterona alterada (50%). Do mesmo modo, a saturação máxima de O2 > 90% foi mais prevalente tanto para o pacientes com SAHOS e testosterona normal (84%) como para os pacientes com testosterona alterada (79%).
Os dados gerais obtidos dos pacientes estão expressos na Tabela 1.
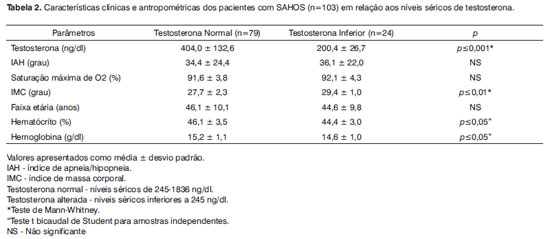
Conforme apresentado na Tabela 2, os pacientes com SAHOS e testosterona alterada apresentaram as dosagens médias do hematócrito, da hemoglobina e dos níveis séricos médios da testosterona significantemente inferiores aos dos pacientes com SAHOS e sem alteração deste hormônio. Mas, quando avaliada a média do IMC dos pacientes com SAHOS e testosterona alterada, foi observado que esta foi significativamente maior quando comparada à média dos pacientes com níveis de testosterona normais.
DISCUSSÃO
Nos últimos anos, tem havido uma crescente conscientização de que os hormônios sexuais têm um importante papel em praticamente todos os processos fisiológicos, inclusive na respiração. Os hormônios estrógeno, progesterona e testosterona podem influenciar a função respiratória em animais e em humanos9,23. Em adição, vários distúrbios respiratórios, tais como a SAHOS, a síndrome da morte súbita do lactente e a síndrome de Rett também apresentam claras diferenças sexuais nas suas prevalências, conferindo a importância dos hormônios sexuais no controle da respiração24-26.
A facilitação a longo prazo respiratória propicia um importante modelo, possibilitando a investigação dos efeitos dos hormônios sexuais na neuroplasticidade, em geral, e na plasticidade respiratória, em particular. Pela rigidez da musculatura das vias aéreas superiores, a facilitação a longo prazo permite estabilizar a respiração sob condições que poderiam levar, de outro modo, à obstrução das vias aéreas superiores e à apneia. Embora o papel da facilitação a longo prazo ainda não tenha sido claramente identificado como um fator causal da SAHOS, alterações que prejudiquem a plasticidade respiratória, devido à diminuição dos níveis dos hormônios sexuais com o envelhecimento, podem contribuir para a progressão dessa síndrome1.
A incidência da SAHOS é maior em homens com baixos níveis séricos de testosterona, em homens de meia idade27,28, em mulheres com baixos níveis de estrógeno e progesterona e em mulheres na pós-menopausa que não estão em terapia de reposição hormonal11,29,30. O presente estudo demonstrou baixos níveis séricos de testosterona total em pacientes com SAHOS estando a maioria destes com idade média de 44,6 anos, obesidade Grau I e IAH de grau grave, resultados estes concordantes com os da literatura17,27,31-34.
Vários fatores podem ser responsáveis pela diminuição da secreção da testosterona observada em homens de meia idade com SAHOS os quais incluem: hipóxia, fragmentação do sono, obesidade e idade avançada. Estudos prévios que investigaram a função hipofisária-gonadal na SAHOS demonstraram diminuição dos níveis séricos de testosterona. As testosteronas total e livre estavam reduzidas em homens obesos com SAHOS quando comparados a um grupo controle pareado em idade e peso corporal. Uma correlação negativa foi demonstrada entre a gravidade da apneia do sono e níveis de testosterona, isto é, quanto maior o IAH, menor o nível de testosterona, indicando que a gravidade da apneia estava relacionada com a diminuição da secreção da testosterona na SAHOS31,33. Entretanto, esse conceito é ainda controverso, pois a deficiência de testosterona tem sido encontrada não apenas em pacientes com SAHOS de grau grave, mas também em pacientes obesos, de faixa etária mais avançada e com IAH grave35.
Foi demonstrado que a concentração sérica de testosterona diminui com o avançar da idade. Níveis hipogonadais de testosterona foram observados em cerca de 12% de homens acima de 50 anos de idade e em 50% de homens acima de 80 anos de idade27,36. A diminuição dos níveis de testosterona em relação à idade tem origem central (hipofisária) e periférica (testicular)27,37. No presente estudo, níveis hormonais inferiores aos da normalidade foram observados em 50% dos pacientes com SAHOS grave e com obesidade Grau I (63%), mas a faixa etária não foi avançada, estando a maioria dentro do grupo de adultos (75%). Dentre os pacientes sem alterações na testosterona, também foi encontrado que a maioria (52%) apresentou IAH de grau grave e 72% eram adultos. Entretanto, o IMC estava dentro do grupo de sobrepeso (70%).
Apesar de a literatura referir a associação entre nível alterado de testosterona e o IMC em graus mais elevados que o Grau I27,31, no presente estudo os pacientes com testosterona em níveis inferiores e com IMC de Grau I apresentaram esta associação significativamente maior em relação aos pacientes com níveis hormonais normais indicando que, nos pacientes com alterações hormonais, o IMC de Grau I teve correlação com os níveis alterados de testosterona. A obesidade é comum na SAHOS e está associada ao aumento da gravidade da apneia do sono, como indicado pelo IAH38.
Potenciais mecanismos responsáveis para a associação entre SAHOS e obesidade incluem múltiplas anormalidades endócrinas, as quais estão envolvidas no desenvolvimento do acúmulo de gordura, particularmente da gordura visceral, e onde níveis reduzidos de andrógenos parecem ter um importante papel. De fato, os andrógenos estimulam a lipólise no tecido adiposo, enquanto inibem a atividade da lipoproteína lipase, particularmente ao nível visceral. O suporte ao papel da testosterona na regulação do metabolismo lipídico é a evidência de que homens hipogonadais, invariavelmente, apresentam aumento da gordura visceral. Em homens obesos, as testosteronas total e livre diminuem com o aumento do peso corporal e massa gordurosa, como consequência de reduzida síntese de hormônio ligado à globulina e atividade alterada do sistema aromatase nos tecidos periféricos39-41.
Prévios estudos têm demonstrado que os níveis séricos de testosterona total correlacionam-se inversamente com a gravidade da SAHOS, isto é, com os índices de apneia/hipopneia sendo essas alterações resultantes do aumento da fragmentação do sono e da redução da oxigenação, os quais são conhecidos fatores em inibir a produção da testosterona27,33. Em um extenso estudo de corte transversal em 225 homens submetidos ao exame polissonográfico, a redução da testosterona total, dos hormônios sexuais ligados à globulina e da testosterona livre, foi significativamente correlacionada com a gravidade da SAHOS42. Este fato não ocorreu no presente estudo, pois, apesar de 50% dos pacientes com SAOS e testosterona alterada apresentarem apneia de grau grave, prevalência semelhante (52%) foi encontrada nos pacientes com SAOS e com níveis hormonais normais. Há necessidade de maiores investigações para se esclarecer qual ou quais fatores que estariam determinando esta gravidade no índice de apneia na população do estudo.
Mecanismos pelos quais a dessaturação de O2 influencia nos níveis da testosterona ainda são pouco conhecidos. Entretanto, a redução da disponibilidade do oxigênio durante o sono tem sido associada com a inibição central do eixo hipotálamo-hipofisário-gonadal, provavelmente por meio de um aumento dos níveis centrais de endorfina. Além disso, quando pacientes são expostos a repetitivos episódios de obstrução das vias aéreas superiores com distinta fragmentação do sono, o ritmo circadiano da testosterona pode ser afetado43. A relativa importância da hipóxia e fragmentação do sono na gênese da disfunção gonadal foram descritas em estudos prévios, nos quais foi constatado que, em adultos jovens normais, a privação do sono foi associada à supressão de esteroides gonadais43,44. Quando pacientes com SAHOS com grave dessaturação de O2 foram comparados com pacientes com dessaturação menos grave, uma significante correlação foi encontrada entre o pico do nível de testosterona e o tempo total de dessaturação, sugerindo que a hipóxia foi o fator responsável em afetar o ritmo circadiano da testosterona ocasionando diminuição dos níveis matinais da mesma43,45.
Pacientes com SAHOS que apresentam hipoxemia crônica podem ter alterações ventilatórias, pois a hipoxemia pode afetar a síntese e a atividade de diversos neurotransmissores alterando, assim, a função de quimiorreceptores centrais e periféricos responsáveis pelo controle ventilatório46. Prévios estudos demonstram a influência do IAH na secreção da testosterona e enfatizam o grau de hipóxia. É possível, entretanto, que a hipóxia e a fragmentação do sono influenciem a função hipofisária-gonadal em pacientes com SAHOS. A reduzida quantidade de testosterona e sua significante associação com IAH sugerem que a disfunção gonadal é uma consequência da SAHOS, em vez de uma alteração primária independente do eixo hipotálamo-hipófise-gonadal27,43,45.
No presente estudo, apesar de a relação entre os grupos de pacientes com os valores médios do IAH e com os valores médios da PaO2 não ter sido estatisticamente significante, 63% dos pacientes com testosterona alterada apresentaram PaO2<90% contra apenas 16% dos pacientes com níveis hormonais normais. E, apesar de os valores médios do Ht e Hb estarem dentro dos níveis de normalidade, houve uma diferença estatisticamente significante entre ambos os grupos de pacientes com SAHOS, indicando uma relativa diminuição destes valores nos pacientes com testosterona alterada.
Os andrógenos endógenos são capazes de estimular a eritropoiese, aumentar a contagem de reticulócitos, os níveis das células sanguíneas e a atividade eritropoiética da medula óssea em mamíferos, enquanto que a castração tem efeito oposto. A deficiência de testosterona resulta em uma diminuição de 10% na 20% na concentração de hemoglobina, o que pode resultar em anemia. Homens jovens com hipogonadismo geralmente apresentam poucas hemácias e baixos níveis de hemoglobina do que homens de mesma faixa etária, mas com níveis androgênicos normais. O principal envolvimento androgênico no mecanismo normal da hematopoiese é a estimulação direta da produção renal de eritropoietina pela testosterona47. A deprivação androgênica em homens reduz a eritropoiese e o hipogonadismo é frequentemente associado à redução do hematócrito, conforme encontrado no presente estudo, apesar de conforme referido, estar ainda dentro dos níveis de referência de normalidade. A anemia relacionada à idade é, no mínimo, parcialmente devido ao declínio nos níveis androgênicos circulantes em homens mais velhos48,49.
Homens com SAHOS podem ter diminuição dos níveis de testosterona, provavelmente devido ao efeito combinado da fragmentação do sono e hipóxia. No início do sono a concentração plasmática de testosterona é baixa sendo que os níveis máximos ocorrem nas primeiras horas da manhã. Seu aumento noturno parece estar relacionado com a latência para o primeiro episódio do sono REM (Rapid Eye Movement) e aos ciclos REM/NREM. O pico dos níveis de testosterona coincide com o início do sono REM. Além disso, a elevação relacionada ao sono dos níveis da testosterona em homens jovens está associada ao início do primeiro episódio do sono REM da noite. Quando avaliada a concentração da testosterona num estudo de fragmentação do sono em homens jovens, notou-se uma atenuação do aumento noturno nos indivíduos que não atingiram o estágio REM do sono45,50. Devido a isto, no presente estudo as dosagens de testosterona foram realizadas no período da manhã, após a realização da polissonografia, permitindo assim a identificação dos pacientes nos quais houve ou não atenuação do aumento noturno.
Baixos níveis séricos de testosterona também têm sido identificados em pacientes obesos, diabéticos, hiperlipêmicos, insulino-resistentes e/ou com síndrome metabólica. Em vista do crescente avanço nos estudos sobre os aspectos cardiovasculares do hipogonadismo assim como sobre a SAHOS, com ou sem essas condições metabólicas associadas, a questão da testosterona sérica em homens merece mais pesquisas. Se a presença da SAHOS diminui os níveis de testosterona por si só ou se pacientes com SAHOS com idade mais avançada, com obesidade, resistentes à insulina e/ou diabéticos estão mais propensos a terem níveis hipogonadais de testosterona, ambas as hipóteses permanecem ainda desconhecidas17.
Os achados do presente estudo e os descritos na literatura podem ter implicações práticas no tratamento de pacientes obesos com SAHOS. Tratamentos nutricional e comportamental para conseguirem rápida perda de peso e manutenção a longo prazo do mesmo têm um importante papel na melhora significativa da função respiratória e das alterações metabólicas. Em adição, os níveis de testosterona tendem a um aumento significativo após a perda de peso e esse fato pode favorecer na manutenção contínua do peso dentro dos níveis de normalidade51.
A anormalidade endócrina na SAHOS pode ser revertida após três meses de terapia sob Pressão Positiva Contínuas nas Vias Aéreas (Continuous Positive Airway Pressure -CPAP)28,32. Entretanto, níveis normais de testosterona também têm sido observados em pacientes com SAHOS, fazendo ou não uso da CPAP terapia52, conforme encontrado no presente estudo. As discrepâncias entre esses resultados podem estar relacionadas ao grau da SAHOS, aos níveis inalterados dos hormônios sexuais ligados à globulina ou à inconsistente duração dos tratamentos com CPAP, os quais poderiam explicar a não alteração dos níveis de testosterona.
Esses dados sugerem que a SAHOS em homens de meia idade está associada à reduzida secreção androgênica, juntamente com a obesidade e envelhecimento, tendo a hipóxia e a fragmentação do sono como fatores contribuintes adicionais na diminuição das concentrações hormonais desses pacientes33, conforme encontrado no presente estudo. A testosterona tem sido o foco de várias pesquisas e estudos de revisão em homens, mas poucos têm enfocado sua interação com o sono. Maiores conhecimentos desta relação não são apenas importantes para a compreensão da fisiologia básica do sono, mas também para auxiliar na descoberta das causas de certos problemas de saúde associados aos distúrbios do sono, envelhecimento e até mesmo quanto ao horário de trabalho O conhecimento das interações entre hormônios e respiração propicia novas perspectivas em terapias farmacológicas para os distúrbios do sono, além de estimular pesquisas no intuito de investigar em como o sistema endócrino influencia o controle da respiração na saúde e na doença53.
CONCLUSÕES
A SAHOS pode ser associada à diminuição da função hipofisária-gonadal nos pacientes do estudo.
A relação entre o perfil sérico da testosterona matinal e a obesidade pode ser responsável pela supressão central da testosterona nos pacientes do estudo.
Não foi possível verificar se há relação da alteração no nível sérico da testosterona com a idade, com o índice de apneia/hipopneia e com a hipóxia pelos resultados obtidos no estudo.
A queda dos valores hematimétricos nos pacientes do estudo pode ser relacionada aos baixos níveis circulantes da testosterona.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Young T, Peppard P, Gottlieb D. The epidemiology of obstructive sleep apnoea: a population health perspective. Am J Respir Crit Care Med.2002;165:1217-39.
2. Sakai K, Takada T, Nakayama H, Kubota Y, Nakamata M, Satoh M, et al. Serotonin-2A and 2C receptor gene polymorphisms in Japanese patients with obstructive sleep apnea. Intern Med.2005;44:928-33.
3. Yilmaz M, Bayazit YA, Ciftci TU, Erdal E, Urhan M, Kokturk O, et al. Association of serotonin transporter gene polymorphism with obstructive sleep apnea syndrome. Laryngoscope.2005;115:832-6.
4. Jelev A, Sood S, Liu H, Nolan P, Horner RL. Microdialysis perfusion of 5-HT into hypoglossal motor nucleus differentially modulates genioglossus activity across natural sleep-wake states in rats. J Physiol. 2001;532:467-81.
5. Ko ML, King MA, Gordon TL, Crisp T. The effects of aging on spinal neurochemistry in the rat. Brain Res Bull. 1997;42:95-8.
6. Bethea CL, Gundlah C, Mirkes SJ. Ovarian steroid action in the serotonin neural system of macaques. Novartis Found Symp.2000;230:112-30.
7. Zabka AG, Behan M, Mitchell GS. Ageing and gonadectomy have similar effects on hypoglossal long-term facilitation in male Fischer rats. J Physiol.2005;563:557-68.
8. Behan M, Zabka AG, Mitchell GS. Age and gender effects on serotonin-dependent plasticity in respiratory motor control. Respir Physiol Neurobiol.2002;131:65-77.
9. Behan M, Zabka AG, Thomas CF, Mitchell GS. Sex steroid hormones and the neural control of breathing. Respir Physiol Neurobiol. 2003;136:249-63.
10. Ware JC, McBrayer RH, Scott JA. Influence of sex and age on duration and frequency of sleep apnea events. Sleep.2000;23:165-70.
11. Bixler EO, Vgontzas AN, Lin H-M, Have TT, Rein J, Vela-Bueno A, et al. Prevalence of sleep disordered breathing in women. Effects of gender. Am J Respir Crit Care Med.2001;163:608-13.
12. Zabka AG, Mitchell GS, Behan M. Conversion from testosterone to oestradiol is required to modulate respiratory long-term facilitation in male rats. J Physiol.2006;576:903-12.
13. Kugaya A, Epperson CN, Zoghbi S, Van Dyck, Hou Y, Fujita M, et al. Increase in prefontral cortex serotonin 2A receptors following estrogen treatment in postmenopausal women. Am J Psych.2003;160:1522-4.
14. Scharfman HE, Mercurio TC, Goodman JH, Wilson MA, Maclusky NJ. Hippocampal excitability increases during the estrous cycle in the rat: a potential role for brain-derived neurotrophic factor. J Neurosci. 2003;23:11641-52.
15. Blurton-Jones M, Kuan PN, Tusynski MH. Anatomical evidence for transsynaptic influences of estrogen on brain-derived neurotrophic factor expression. J Comp Neurol.2004;468:347-60.
16. Bhasin S, Cunningham G, Hayes F, Matsumoto A, Snyder P, Sweerdloff R, et al. Testosterone therapy in adult men with androgen deficiency syndrome: An endocrine society clinical practice guideline. J Clin Endocrinol Metab.2006;91:1995-2010.
17. Kirbas G, Abakay A, Topcu F, Kaplan A, Unlü M, Peker Y. Obstructive sleep apnoea, cigarette smoking and serum testosterone levels in a male sleep clinic cohort. J Int Med Res.2007;35:38-45.
18. Estatuto do Idoso. Lei Nº 10.741, de 1º de Outubro de 2003. Série fontes de referência. Legislação: nº 53. 42 p.ISBN:85-7365-345-0.
19. Murahovski J. Puericultura no Ambulatório e Consultório. In: Pediatria: Diagnóstico + Tratamento. 6ª ed. São Paulo:Sarvier;2003.p.3-36.
20. Li HY, Chen NH, Lee LA, Shu YH, Fang TJ, Wang PC. Use of morphological indicators to predict outcomes of palatopharyngeal surgery in patients with obstructive sleep apnea. ORL J Otorhinolaryngol Relat Spec. 2004;66:119-23.
21. Taheri S. The genetics of sleep disorders. Minerva Med.2004;95:203-12.
22. WHO. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. WHO Technical Report Series 854. Geneva: World Health Organization,1995.
23. Behan M, Wenninger JM. Sex steroidal hormones and respiratory control. Resp Physiol Neurobiol.2008;164:213-21.
24. Kapsimalis F, Kryger MH. Gender and obstructive sleep apnea syndrome. Part 1: clinical features. Sleep.2002;25:412-9.
25. Kapsimalis F, Kryger MH. Gender and obstructive sleep apnea syndrome. Part 2: mechanisms. Sleep.2002;25:499-506.
26. Chahrour M, Zoghbi HY. The story of Rett syndrome: from clinic to neurobiology. Neuron.2007;56:422-37.
27. Luboshitzky R, Aviv A, Hefetz A, Herer P, Shen-Orr Z, Lavie L, et al. Decreased pituitary-gonadal secretion in men with obstructive sleep apnea. J Clin Endocrinol Metab.2002;87:3394-8.
28. Meston N, Davies RJ, Mullins R, Jenkinson C, Wass JA, Stradling JR. Endocrine effects of nasal continuous positive airway pressure in male patients with obstructive sleep apnoea. Intern Med. 2003;254:447-54.
29. Young T, Finn L, Austin D, Peterson A. Menopausal status and sleep-disordered breathing in the Wisconsin sleep cohort study. Am J Respir Crit Care Med.2003;167:1181-5.
30. Netzer NC, Eliasson AH, Strohl KP. Women with sleep apnea have lower levels of sex hormones. Sleep Breath.2003;7:25-9.
31. Gambineri A, Pelusi C, Pasquali R. Testosterone levels in obese male patients with obstructive sleep apnea syndrome: Relation to oxigen desaturation, body weight, fat distribution, and the metabolic parameters. J Endocrinol Invest.2003;26:493-8.
32. Hoekema A, Stel A-L, Stegenga B, van der Hoeven JH, Wijkstra PJ, van Driel MF, de Bont Lambert GM. Sexual function and obstructive sleep-apnea-hypopnea: a randomized clinical trial evaluating the effects of oral-appliance and continuous positive airway pressure terapy. J Sex Med.2007;4:1153-62.
33. Luboshitzky R, Lavie L, Shen-Orr Z, Herer P. Altered luteinizing hormone and testosterone secretion in middle-aged obese men with obstructive sleep apnea. Obes Res.2005;13:780-6.
34. Saaresranta T, Polo O. Hormones and breathing. Chest.2002;122:2165-82.
35. Araujo AB, ODonnell AB, Brambilla DJ, Simpson WB, Longcope C, Matsumoto AM, et al. Prevalence and incidence of androgen deficiency in middle-aged and older men: estimates from Massachusetts Male Aging Study. J Clin Endocrinol Metab.2004;89:5920-6.
36. Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR. Longitudinal effects on serum total and free testosterone levels in healthy men. J Clin Endocrinol Metab.2001;86:724-31.
37. Basaria S, Dobs AS. Hypogonadism and adrogen replacement therapy in elderly men. Am J Med.2001;110:563-72.
38. Lima N, Cavaliere H, Knobel M, Halpern A, Mediros-Neto R. Decreased androgen levels in massively obese men may be associated with impaired function of the gonadostat. In J Obes Relat Metab Disord. 2000;24:1433-7.
39. Simpson ER. Clyne C, Rubin G, Bonn WC, Robertson K, Britt K, Speed C, et al. Aromatase - a brief overview. Annu Rev Physiol.2002;64:93-127.
40. Pasquali R, Casimirri F, Cantobelli S, Melchionda N, Morselli-Labate AM, Fabbri R, et al. Effect of obesity and body fat distribution on sex hormones and insulin in men. Metabolism.1991;40:104-4.
41. Gambineri A, Pasquali R. Testosterona therapy in men: clinical and pharmacological perspectives. J Endocrinol Invest. 2000;23:196-214.
42. Grunstein RR, Handelsman DJ, Lawrence SJ, Blacwell C, Caterson ID, Sullivan CE. Neuroendocrine dysfunction in sleep apnea: reversal by continuous positive airways pressure therapy. J Clin Endocrinol Metab.1989;63:352-8.
43. Kouchiyama S, Honda Y, Kuriyama T. Influence of nocturnal oxygen desaturation on circadian rhythm of testosterone secretion. Respiration.1990;57:359-63.
44. Singer F, Zumoff B. Subnormal serum testosterone levels in male internal medicine residents. Steroids.1992;57:86-9.
45. Luboshitzky R, Zabari Z, Shen-Orr Z, Herer P, Lavie P. Disruption of the nocturnal testosterone rhythm by sleep fragmentation in normal men. J Clin Endocrinol Metab.2001;86:1134-9.
46. Martins AB, Tufik S, Moura SMGPT. Síndrome da apneia-hipopneia obstrutiva do sono. Fisiopatologia. J Bras Pneumol. 2007;33:36-43.
47. Spivak JL. The blood in systemic disorders. Lancet. 2000;355:1707-12.
48. Hero M, Wickman S, Hanhijärvi R, Siimes MA, Dunkel L. Pubertal upregulation of erythropoiesis in boys is determined primarily by androgen. J Pediatr.2005;146:245-52.
49. Ferruci L, Maggio M, Bandinelli S, Basaria S, Lauretani F, Ble A, et al. Low testosterone levels and the risk of anemia in older men and women. Arch Intern Med.2006;166:1380-8.
50. Luboshitzky R, Herer P, Levi M, Shen-Orr Z, Lavie P. Relationship between rapid eye movement sleep and testosterone secretion in normal men. J Androl.1999;20:731-7.
51. Pasquali R, Colella P, Cirignotta F, Mondini S, Gerardi R, Buratti P, et al. Treatment of obese patients with obstructive sleep apnea syndrome (OSAS): effect of weight loss and interference of otorhinolaryngoiatric pathology. Int J Obes.1990;14:207-17.
52. Bratel T, Wennlund A, Carlstom K. Pituitary reactivity, androgens and catecholamines in obstructive sleep apnoea: effects of continuous positive airway pressure treatment (CPAP). Respir Med.1999;93:1-7.
53. Axelsson J, Ingre M, Akerstedt T, Holmback U. Effects of acutely sleep on testosterone. J Clin Endocrinol Metab.2005;90:4530-5.
1. Doutor em Ciências da Saúde, Chefe do Ambulatório de ORL e CCP FUNFARME/FAMERP.
2. Graduação em Medicina, Residente R3 em ORL e CCP FAMERP.
3. Graduação em Medicina, Residente R4 em ORL e CCP FAMERP.
4. Doutor em Ciências da Saúde, Professor Adjunto III-D do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço - FAMERP.
5. Livre-Docente UNESP, Professor Adjunto do Departamento de Biologia UNESP.
6. Livre-Docente, Professor Adjunto do Departamento de ORL e CCP FAMERP.
7. Livre-Docente, Orientador da Pós-Graduação FAMERP.
Faculdade de Medicina de São José do Rio Preto, São Paulo (FAMERP) - Av. Brig. Faria Lima 5416 Vila São Pedro São José do Rio Preto SP 15090-000.
Endereço para correspondência:
Vânia Belintani Piatto
Departamento de ORL e CCP Fac Med São José do Rio Preto (FAMERP)
Av. Brig. Faria Lima 5416
Vila São Pedro São José do Rio Preto SP 15090-000
Tel. (0xx17) 3201-5747
E-mail:vbpiatto@gmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 22 de fevereiro de 2010. cod. 6939
Artigo aceito em 5 de maio de 2010.