Ano: 2010 Vol. 76 Ed. 5 - Setembro - Outubro - (8º)
Seção: Artigo Original
Páginas: 579 a 587
Estudo da mucosa nasal de contatos de hanseníase, com positividade para o antígeno glicolipídio fenólico 1
Nasal mucosa study of leprosy contacts with positive serology for the phenolic glycolipid 1 antigen
Autor(es): Ana Cristina da Costa Martins1, Alice Miranda2, Maria Leide Wan-del-Rey de Oliveira3, Samira Bührer-Sékula4, Alejandra Martinez5
Palavras-chave: endoscopia, glicolipídios, mucosa nasal, mycobacterium leprae, reação em cadeia da polimerase.
Keywords: endoscopy, glycolipids, nasal mucosa, mycobacterium leprae, polymerase chain reaction.
Resumo:
A hanseníase é uma doença infecciosa de evolução crônica causada pelo Mycobacterium leprae que acomete com maior frequência a mucosa nasal. Esse acometimento independe da forma clínica da doença e pode ocorrer mesmo antes do aparecimento de lesões na pele ou em outras partes do corpo. Faz-se necessário a vigilância epidemiológica dos contatos de casos novos de hanseníase para o diagnóstico precoce da doença. Objetivos: Identificar lesões específicas e precoces de hanseníase por meio de exame endoscópico, baciloscópico, histopatológico e da reação em cadeia da polimerase em Tempo Real da mucosa das cavidades nasais dos contatos domiciliares e peridomiciliares com sorologia positiva para o antígeno glicolipídio fenólico. Material e Métodos: Estudo prospectivo transversal em 31 contatos de pacientes de hanseníase com sorologia positiva (PGL-1), 05 controles negativos e 01 positivo no período de 2003 a 2006. Resultados: Entre os contatos soropositivos a PCR-RT foi positiva para a presença de DNA de M. leprae em 06 (19,35%) destes e o maior número de cópias do genoma do bacilo foi encontrado no contato que adoeceu. Conclusão: Isoladamente os exames da mucosa nasal não permitiram o diagnóstico precoce da hanseníase, mas com a combinação de vários métodos, o exame dos contatos pôde ajudar na identificação da infecção subclínica e monitoramento daqueles que poderiam ter papel importante na transmissão da doença.
Abstract:
Leprosy is a chronic infectious disease caused by Mycobacterium leprae. The disease more frequently affects the nasal mucosa and can occur independently of its clinical form or even before lesions on the skin or on other parts of the body. It is necessary to employ epidemiological surveillance of household contacts with new leprosy cases for early disease diagnosis. Aim: identify specific and early leprosy lesions through endoscopic, baciloscopy, histopathology exams, and real time polymerase chain reaction of the nasal cavity mucosa on household and peridomiciliary contacts with positive serology for the phenolic glycolipid 1 antigen. Methodology: Between 2003 at 2006 there was a prospective cross-sectional clinical study with 31 contacts with patients with leprosy with positive serology against PGL-1, 05 negative controls and 01 positive control. Results: Between seropositive contacts, real-time PCR was positive for M. leprae DNA in 06 (19.35%) of them and the higher number of genome copies were found in contacts who became sick. Conclusion: Nasal mucosa tests alone did not enable the early diagnosis of Leprosy. However, through the combination of various methods, tests on the contacts can help identify subclinical infection and monitor the contacts that could be responsible for spreading the disease.
![]()
INTRODUÇÃO
A hanseníase foi classificada por Rabello como uma doença polar com duas formas opostas (HT e HV) baseando-se na resposta do organismo hospedeiro à infecção, a partir de uma apresentação inicial indeterminada (HI). Essa classificação polar recebeu a inclusão de novas formas clínicas denominadas "borderline" a partir do VI Congresso Internacional de Leprologia realizado, em 1953, em Madri. Estas novas classificações, também conhecidas como dimorfas, foram designadas a pacientes que evoluíam da forma indeterminada (HI) para aspectos clínicos não característicos das formas polares tuberculoide (HT), com baixa carga bacilar e alta resposta imunológica celular e virchowiana (HV), com alta carga bacilar e baixa resposta imunológica celular.
Desde a introdução da poliquimioterapia (PQT/OMS) no início da década de 80, buscam-se novas ferramentas diagnósticas que possibilitem o diagnóstico precoce da hanseníase. A identificação dos grupos com maior risco de adoecer em áreas de alta endemicidade ampliada e extrapolada para o extradomicílio, aliada à vacinação dos contatos com BCG, são medidas brasileiras que deveriam contribuir para a redução de formas multibacilares de hanseníase. Entretanto, essas têm sua efetividade comprometida por vários problemas operacionais o que resulta em altos coeficientes de detecção na maioria dos estados brasileiros.
Com relação à transmissão da doença, discute-se há anos serem as vias aéreas superiores, principalmente o nariz, a rota de entrada e provável eliminação do Mycobacterium leprae. Acredita-se que 95% dos pacientes MHV (hanseniase virchowiana) terão envolvimento nasal precoce. Note-se que, mesmo sem lesões mucosas visíveis, há alterações histopatológicas específicas da doença1. Nestes pacientes MHV, no estágio de invasão bacilar, observa-se um grande número de células produtoras de muco, edema e aumento da vascularização da submucosa infiltrada por plasmócitos e linfócitos. Esta grande quantidade de muco explicaria a congestão nasal e rinorreia características neste estágio inicial. Posteriormente, no estágio de proliferação, ocorre uma exacerbação dos achados anteriores, conferindo à mucosa aspecto granuloso; neste estágio, a presença de macrófagos no infiltrado inflamatório é predominante. O estágio a seguir é o de destruição e ulceração da mucosa, com infiltrado inflamatório constituído por macrófagos com numerosos bacilos, além de linfócitos e plasmócitos. Já o ultimo estágio, o de resolução e fibrose, a fibrose é marcante e raramente são encontrados bacilos2.
O epitélio nasal é do tipo pseudoestratificado cilíndrico ciliado com células caliciformes e, por sofrer múltiplas agressões, dificilmente se mantém normal. Entre os fatores agressores temos: temperaturas extremas, processos infecciosos, poluição e traumas. Esse contínuo ataque leva à diminuição dos cílios onde há impacto do ar, além do aumento do número de células caliciformes e de células inflamatórias. O caráter progressivo da metaplasia escamosa encontrada nesses casos desde a infância consiste em um fenômeno normal como resposta protetora às influências externas e pode ser observado com frequência nas rinopatias alérgicas3.
Quanto ao diagnóstico, a utilização do exame histopatológico é de grande valor na confirmação e classificação das formas clínicas de hanseníase, especialmente nos casos MHI (forma indeterminada), pois este exame poderá mostrar precocemente a tendência para um ou outro tipo polar (tuberculoide ou virchowiano). A biópsia deve ser processada e fixada em formol a 10% ou Millonig (formol tamponado), sendo utilizadas as colorações de Hematoxilina-Eosina, Ziehl-Wade-Klingmuller ou Fite Faraco.
Entre as novas ferramentas de apoio ao diagnóstico precoce ou de valor preditivo para a seleção desses grupos a sorologia com teste rápido, que detecta anticorpos contra o antígeno glicolipídio fenólico 1 (PGL-1), específico do M. leprae presente em sua parede. O PGL-1 é específico deste bacilo e constitui cerca de 2% da massa total bacteriana e pode ser encontrado nos tecidos, no sangue circulante e na urina de doentes multibacilares. Este teste, vem sendo utilizado em todo o mundo como método diagnóstico4,5,6 estando o resultado relacionado à carga bacilar ou seja, quanto maior a exposição bacilar, maior é a positividade do teste que varia de 1+ (carga bacilar baixa) a 4+ (carga bacilar alta). Para o diagnóstico na mucosa nasal o método de amplificação do DNA pela técnica da PCR parece ser o mais específico e sensível para a detecção do bacilo nesta região7-18. Inúmeros trabalhos de coorte9,10,14-17 baseados na soro positividade (Anti-PGL-1) e pesquisa de bacilos na mucosa nasal por meio da reação em cadeia da polimerase corroboram para persistência de infecção subclínica, principalmente em áreas com elevados níveis endêmicos.
Os fatos citados anteriormente nortearam o estudo endoscópico da mucosa das cavidades nasais para averiguação de infecção subclínica em contatos soropositivos de uma área urbana do Rio de Janeiro, o Município de Duque de Caxias. No início do estudo em 2003, na microárea da investigação, o 2º distrito, a incidência e a prevalência de hanseníase eram de 5,04 e 7,29 por 10 mil habitantes, respectivamente. A alta endemicidade pode ser constatada pelo fato de cerca de 11% dos casos novos da área serem menores de 15 anos, fato que reflete transmissão ativa e recente da doença nesta área segundo vários estudos19-22. Ressalta-se o alto percentual de casos novos com deformidade no ano de 2003, especialmente no 1º e mais populoso distrito (10,7%), com 75,7% dos casos avaliados.
METODOLOGIA
Realizou-se estudo do tipo transversal em 31 contatos (de 1886 contatos que compunham a amostra total do inquérito sorológico)23 de pacientes de hanseníase com sorologia positiva contra o PGL-1 e 06 controles, sendo 01 positivo e 05 negativos, no período de 2003 a 2006. Os contatos e controles foram submetidos à endoscopia nasal, coleta de material da mucosa nasal e biópsia da concha inferior direita para os exames BAAR (bacilos álcool ácido-resistentes), histopatológico e para a Reação em cadeia polimerase em Tempo Real (PCR-RT). Foi procedida à construção de um novo banco de dados (SPSS for Windows) com a inclusão das seguintes informações: Sexo, Idade, Resultado do Anti-PGL-1, forma clínica do caso índice (MB-multibacilar ou PB-paucibacilar), Tipo de relação (parentesco ou social) com o caso índice, Tipo de contato (domiciliar ou peridomiciliar) com o caso índice, Tipo de convívio (exposição: diária, semanal ou quinzenal) com o caso índice, queixas otorrinolaringológicas, endoscopia nasal, BAAR, exame histopatológico e a PCR em Tempo Real.
O projeto foi aprovado conforme MEMO-nº 146/03 e MEMO-n0 0015.0.009.000-04. Após aceitação e assinatura do termo de consentimento livre e esclarecido, os contatos com teste positivo, maiores de 15 anos, foram submetidos à avaliação clínica Otorrinolaringológica, sendo assegurados aos mesmos todos os cuidados referentes às normas de biossegurança.
RESULTADOS
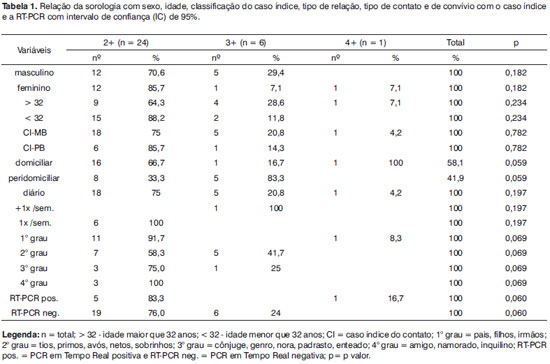
Tabela 1. Relação da sorologia com sexo, idade, classificação do caso índice, tipo de relação, tipo de contato e de convívio com o caso índice e a RT-PCR com intervalo de confiança (IC) de 95%.
Endoscopia nasal
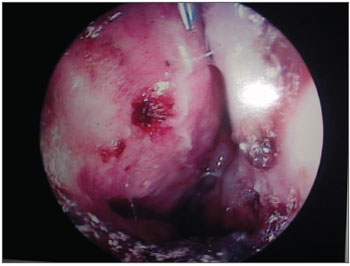
Figura 5. RINITE HANSÊNICA - Endoscopia nasal do controle positivo: mucosa nasal típica da rinite hansênica, onde se evidenciam infiltração difusa da mucosa, ressecamento, áreas de ulceração superficial, crostas hemáticas (CH), ectasias e áreas de sangramento.
Figura 5. Rinite hansênica - cavidade nasal de paciente controle positivo evidencia à esquerda na endoscopia nasal, infiltração difusa de mucosa, crostas hemáticas e ressecamento.
Histologia
Foi realizada a análise semiquantitativa das alterações histopatológicas encontradas nos contatos, porém, não específicas de hanseníase e estas foram classificadas como rinopatia alérgica com diferentes graus de intensidade. E ainda, a análise histopatológica do controle positivo (Rinite hansênica).
Lâminas
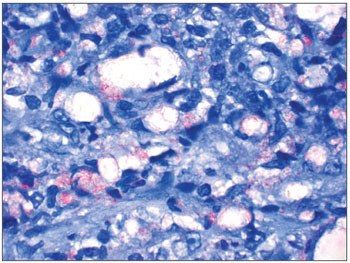
Ilustração 1: WADE-controle positivo/rinite hansênica
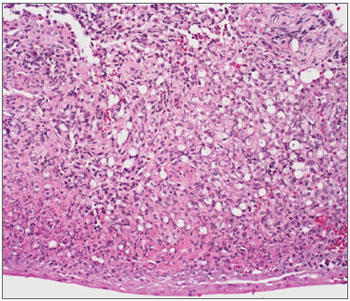
Figura 1. Lâmina com aumento de 1000x - coloração de WADE - Rinite hansênica com macrófagos vacuolados e bacilos (em vermelho) dispostos em globias.
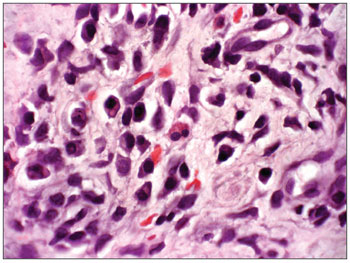
Ilustração 2: RCA/HE(Contato número 19 que adoeceu).
Figura 2. Rinite crônica agudizada - Lâmina com aumento de 1000x, coloração de Hematoxilina Eosina - Lâmina evidencia a presença de eosinófilos (célula binucleada ao centro da lâmina)
Ilustração 3: RCM/HE
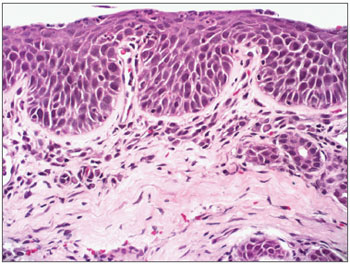
Figura 3. Rinite crônica moderada - lâmina com aumento de 400x e coloração por Hematoxilina Eosina - Lâmina evidencia metaplasia escamosa (área rosa mais escuro bem marcada na superfície)
Ilustração 4:RCS/HE
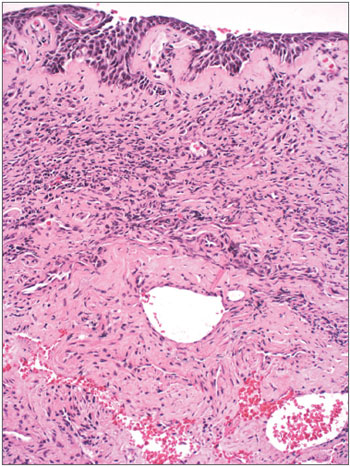
Figura 4. Rinite crônica severa Lâmina com aumento de 400X e coloração por Hematoxilina Eosina - lâmina evidencia infiltrado inflamatório intenso (área rósea mais densa) com áreas hemorrágicas (vermelho)
Ilustração 6: RINITE HANSENICA/HE
Figura 6. Rinite hansênica Lâmina com aumento 200x e coloração de Hematoxilina Eosina - Infiltrado inflamatório denso (células com núcleo roxo) e muitos macrófagos vacuolados.
Ilustração 7: RCL/HE,
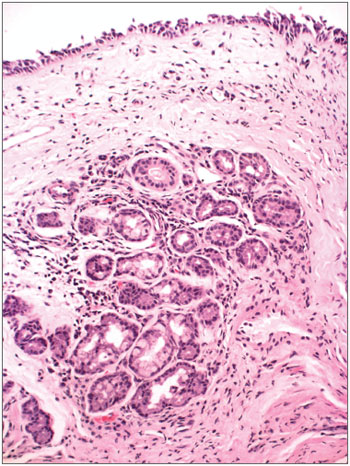
Figura 7. Rinite crônica leve Lâmina com aumento de 200x e coloração por Hematoxilina-Eosina - Lâmina evidencia infiltrado inflamatório discreto (células com núcleos roxos permeados por tecido róseo claro) e dilatação glandular (ao centro da lâmina - aspecto nodular).
Resultados dos métodos laboratoriais utilizados no estudo
Foram encontrados ao todo, 06 contatos com sorologia positiva e positividade na amplificação do DNA pela reação da RT-PCR. Destes, 04 tinham como casos índice pacientes MB e 02 com casos índice PB. Observa-se que entre os 06 contatos, 05 tinham sorologia positiva em 2+ e somente um com 4+. As idades variaram desde os 16 anos aos 70 anos, sendo 04 mulheres e 02 homens.
Quadro 1. Resultados dos métodos laboratoriais utilizados em contatos de hanseníase.
Quadro 2. Resultados dos métodos laboratoriais utilizados no controle positivo.
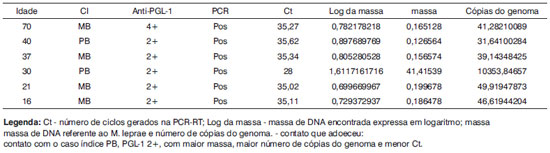
Quadro 3. Resultados de contatos com a PCR em Tempo Real positiva e contato que adoeceu.
DISCUSSÃO
A casuística deste estudo é pequena em relação à amostra total de 1886 contatos, não apenas pela exclusão dos casos negativos, dos duvidosos e os com Anti-PGL-1 positivo em 1+, mas também, devido às inúmeras dificuldades destas pessoas: resistência dos que eram assintomáticos; o problema da distância e locomoção, pessoas com condição socioeconômica e grau de instrução baixa e o fato de serem submetidas a um procedimento invasivo como a biópsia nasal. Desta forma, para fins de segurança e aspectos operacionais, o estudo restringiu-se aos maiores de 15 anos. No inquérito sorológico foi observado que 31% dos contatos soropositivos eram menores de 15 anos, consequentemente excluídos deste estudo.
Sob o ponto de vista epidemiológico, observa-se a importância da vigilância dos contatos para fora do limite domiciliar. É possível identificar fontes de transmissão e, provavelmente, infecção subclínica em contatos peridomiciliares e, sobretudo entender o real papel da mucosa nasal neste contexto. A percentagem encontrada neste estudo entre os soropositivos, foi de 58,1% para os contatos domiciliares e de 41,9% para os peridomiciliares. Entre estes últimos, a maioria apresentou sorologia positiva em 3+ (83,3%) e, entre os contatos domiciliares, a soropositividade predominante foi a de 2+ (66,7%). A moradia no mesmo quintal que o caso índice é um hábito comum no Município de Duque de Caxias e caracteriza o conceito de peridomicílio. O convívio diário com parentes de 10 e 20 graus foi mais evidente entre os soropositivos em 2+ e, entre os contatos com 3+ a relação prevalente foi a de 20 grau (Tabela 1). Questiona-se a possibilidade da existência de infecção subclínica a partir dos resultados obtidos, já que a extrapolação do limite domiciliar foi significativa dentro do contexto sorológico (p=0,059/Tabela 1).
Neste estudo não foram encontrados percentuais significativos ao se correlacionar a soropositividade do contato com a forma clínica do caso índice. Muito embora haja uma tendência de maior preponderância dos casos índices MB. A forma clínica do caso índice não está relacionada à soropositividade de seus contatos e chama-se atenção para o fato de que esse caso índice não seja o caso primário, nem mesmo a fonte de transmissão para o caso secundário23.
Ao se cruzar a sorologia (Anti-PGL-1) com a RT-PCR, os percentuais obtidos foram muito próximos da significância estatística (p=0,060/Tabela 1). Este achado reforça a importância da exposição bacilar e consequente influência desta na resposta sorológica, mesmo em contatos com níveis sorológicos mais baixos. Entretanto, a forma clínica do CI (caso índice) não foi determinante para a positividade da PCR. Apesar do aparente predomínio da forma clínica MB, neste estudo não se observou diferença estatística quando comparada aos contatos expostos à forma clínica PB. Embora este resultado aponte a importância e a inclusão da forma clínica PB como fonte transmissora. Para Van Beers12 e Moet24, os contatos de pacientes PB também parecem apresentar maior risco de adoecer em relação à população geral.
Neste estudo, dentro do contexto da transmissão, foram encontrados 07 contatos de casos índice PB. Destes, 02 com sorologia e RT-PCR positivas e 05 com positividade apenas sorológica. Dos 02, com positividade sorológica e da PCR, um apresentou aumento da sorologia após o estudo da mucosa, passando de 2+ para 4+ com posterior adoecimento e o outro não apresentou aumento da sorologia nem adoecimento. O contato que virou caso não tinha história de caso coprevalente MB e, com isso, cria-se dúvida quanto à real fonte transmissora. Este achado desempenha importância na cadeia epidemiológica da doença quando são considerados como transmissores exclusivos os pacientes MB. Em concordância com a maioria dos trabalhos9,10, 12,14-17,25-28, obteve-se 24 contatos cujos casos índice eram MB.
Note-se que a detecção de anticorpos Anti-PGL-1 pode auxiliar na classificação da doença porque expressa a carga bacilar e corrobora o diagnóstico dos pacientes Muito bem, podendo também, identificar os contatos infectados5,6,29. Entretanto, as pesquisas sorológicas não refletem infecção em todos os indivíduos, já que a maioria das pessoas expressa resistência ao Mleprae e, mesmo adoecendo, apresenta baixa carga bacilar (paucibacilares-PB) e consequentemente, baixos níveis de imunoglobulina do tipo IgM reagindo contra o PGL-14,29-31.
Supõe-se a existência de infecção subclínica transitória em contatos e que esta possa ser consequência da descarga nasal de pacientes bacilíferos, com desenvolvimento ou não da doença. Tal fato sugere ser a mucosa nasal, o provável sítio inicial da resposta imunológica9,10,13,15,17,26,32-39. Alguns autores postulam que não somente os pacientes com hanseníase, mas também, contatos saudáveis, poderiam ser carreadores assintomáticos do M. leprae na mucosa nasal.
Faz-se ressalva ao fato de que a maioria dos contatos referiu queixas inespecíficas, porém sugestivas de rinopatia alérgica como obstrução nasal-35,5%, prurido-25,8%, rinorreia-29% e espirros-9,7%. Associa-se a estas queixas a presença de fatores como: ambientes poucos ventilados, úmidos, ruas sem asfaltamento e calçamento e poeira, ambiente propício para a viabilidade do M.leprae e a sua deposição na mucosa nasal, que pode desencadear, na fase inicial da doença, sintomas como congestão nasal e rinorreia, muitas vezes confundidos com estado gripal. Mesmo assim, ressalta-se que não foi encontrada associação entre a presença de queixas otorrinolaringológicas com a positividade do método da PCR em Tempo Real (p=0,318)
A constante agressão externa pode explicar as alterações histológicas encontradas em todos os contatos. No contato que evoluiu para caso, um ano após o exame da mucosa nasal (Quadro 3), foram encontradas características histológicas na mucosa nasal que permitiram classificá-lo como um quadro de rinite alérgica crônica agudizada. Esse achado poderia reforçar a hipótese da rinite hansênica que ocorre na fase inicial da infecção onde há deposição do bacilo na mucosa nasal2. Nesta fase, os sinais e sintomas clássicos como obstrução nasal e rinorreia seriam desencadeados. Ressalta-se que esta análise foi semiquantitativa e que melhores resultados podem ser obtidos com a análise morfométrica (quantitativa) do exame histopatológico da mucosa destes contatos, exigindo mais estudos nessa área.
A utilização de novas técnicas, como a PCR em Tempo Real, vem contribuir para a detecção do M.leprae e auxiliar os métodos tradicionais de diagnóstico da doença, como a baciloscopia e histopatologia, constituindo um grande avanço em relação ao diagnóstico clínico. Esta técnica permite gerar resultados quantitativos e, consequentemente, mais precisos. Como a doença pode estar relacionada à associação de fatores genéticos e ambientais, além da exposição ao bacilo, a positividade da PCR em amostras de sangue e secreção nasal de contatos não caracteriza obrigatoriamente o adoecimento16. A biópsia da mucosa nasal e a utilização da amplificação do DNA, principalmente pela técnica da PCR em Tempo Real, permitiram encontrar entre os contatos estudados uma positividade para presença de M.leprae de 19,35%. Ao se comparar os resultados obtidos com outros que utilizam a técnica da PCR 9,8%9; 7,8%10; 12,8%14; 4,6%15; 1,7%16; 10,1%17 observa-se que há variações entre o material examinado destes autores (swab do muco ou mucosa) e o teste da PCR adotado (método convencional em placa de gel agarose), variações essas que podem influenciar os resultados. Neste estudo a amostra utilizada foi a menor (n=31), o que pode ter contribuído para o incremento da positividade entre os contatos soropositivos. Mesmo assim, a percentagem obtida (19,35%) se deve ao material adquirido pela biópsia da mucosa e o emprego do método da PCR em Tempo Real, o qual, por sua alta especificidade e sensibilidade, é adotado como padrão no laboratório que analisou estas amostras. Sugere-se mais estudos nessa área além da utilização de uma amostra maior requerida para melhor análise.
A ausência de positividade nos controles negativos comprovou a especificidade e sensibilidade da PCR em Tempo Real nos contatos positivos. O teste da PCR não só identifica o M.leprae mas, também, possibilita a quantificação do DNA que poderia ajudar na elucidação dos casos suspeitos de doença. O contato que adoeceu no ano subsequente ao estudo da mucosa apresentou maior número de cópias do genoma do M.Leprae, com posterior soroconversão de 2+ para 4+. Para Ramaprasad35, o aumento dos níveis sorológicos ocorre após a infecção nasal (PCR +) com posterior disseminação sistêmica e resposta imunológica. No futuro, em trabalhos com tamanho da amostra e tempo de "follow up" maiores, talvez seja possível determinar um valor que indique doença, a partir da quantificação do DNA dos contatos com maior risco.
A demonstração do M.leprae nas cavidades nasais é relativamente comum nas áreas onde a endemicidade é alta. Mesmo assim, a positividade da PCR não difere entre contatos e não contatos como citado anteriormente. Acredita-se ainda, que os bacilos não estejam de forma contínua na mucosa nasal e que a maioria das infecções subclínicas poderia desaparecer espontaneamente, não evoluindo para o estágio de doença. As novas tecnologias como a sorologia, aliada à biologia molecular, têm contribuído para aumentar o conhecimento da epidemiologia da hanseníase, na busca de melhor entendimento do processo de transmissão da doença, que ainda apresenta importantes lacunas.
CONCLUSÃO
Isoladamente, os exames da mucosa nasal não permitiram o diagnóstico precoce de hanseníase. No entanto, a combinação de vários métodos associada ao exame dos contatos pode ajudar a identificar infecção subclínica e monitorar aqueles com maior risco de transmissão da doença como no contato que adoeceu.
Nenhum dos contatos dessa casuística apresentou alterações endoscópicas e histopatológicas específicas de hanseníase ou exame bacteriológico da mucosa positivo para BAAR que permitissem o diagnóstico precoce da doença.
AGRADECIMENTOS
Apoio da Netherlands Leprosy Relief, SMS-DC, FIOCRUZ e de estudantes do PINC da UFRJ.
REFERÊNCIAS BIBLIOGRÁFICAS
1. BARTON, R.P.E.A clinical study of the nose lepromatous leprosy. Lepr Rev. 1974;45:135-44.
2. JOB, C. K., KARAT, A. B., KARAT, S. The histopathological appearance of Leprous rhinitis and pathogenesis of septal perforation in leprosy. J Laryngol Otol. 1966;80(7):718-32.
3. CAMPOS, C. A. H. Da histoarquitetura da mucosa respiratória nasal em indivíduos normais ou com rinite alérgica. 1994. 96p. Dissertação (Doutorado) - Escola Paulista de Medicina, São Paulo, 1994.
4. DOUGLAS, J. T.; WORTH, R. M. Field evaluation of an ELISA to detect antibody in leprosy patients and their contacts. Int J Lepr Other Mycobact Dis. 1984;52:26-33.
5. Bührer-Sekula S, Cunha MG, Ferreira WA, Klatser PR. The use of whole blood in a dipstick assay for detection of antibodies to Mycobacterium leprae: a field evaluation. FEMS Immunol Med Microbiol. 1998;21:197-201.
6. Buhrer-Sekula S, Sarno EN, Oskam L, Koop S, Wichers I, Nery JA, et al. Use of ML dipstick as a tool to classify Leprosy patients. Int J Lepr Other Mycobact Dis. 2000;68(4):456-63.
7. M Y de Wit, J T Douglas, J McFadden and P R Klatser. Polymerase chain reaction for detection of Mycobacterium leprae in nasal sawb specimens. J Clin Microbiol. 1993;31(3):502-6.
8. KLATSER, P.R.; VAN BEERS; MADJID, B. Detection of leprae nasal carries in populations for which leprosy is endemic. J Clin Microbiol. 1993;31:2947-52.
9. PATTYN, S. R.; URSI, D.; LEVEN, M. Detection of Mycobacterium leprae by the polymerase chain reaction in nasal swabs of leprosy patients and their contacts. Int J Lepr Other Mycobact Dis. 1993;61(3):389-93.
10. Van Beers SM, Izumi S, Madjid B, Maeda Y, Day R, et al. An epidemiological study of leprosy infection by serology and polymerase chain reaction. Int J Lepr Other Mycobact Dis. 1994;62(1):1-9.
11. Gertrude P. Chan, Lilia M. Reyes, Brenda Demerre-Lopez, Edgardo M. Gonzaga, Maria Fe A. De Los Santos, Thomas P. Gillis. Leprosy Infection And Disease In The National Capital Region. Phil J Microbiol Infect Dis. 1997;26,(4):159-62
12. VAN BEERS, S. M., HATTA, M., KLATSER, P. R. Patient contact is the major determinant in incident leprosy: implications for future control. Int J Lepr. 1999a;67:119-1281
13. Jadhav RS, Macdonald M, Bjune G, Oskam L; MILEP2 Study Group. Simplified PCR Detection Method for Nasal Mycobacterium leprae. Int J Lepr. 2001;69(4):299-307.
14. GUERRERO, M. I., ARIAS, M.T., GARCES, M. T. Developing and using a PCR test to detect subclinical Mycobacterium leprae infection. Rev Panam Salud Publica. 2002;119(40):228-34.
15. Torres P, Camarena JJ, Gomez JR, Nogueira JM, Gimeno V, Navarro JC, et al. Comparison of PCR mediated amplification of DNA and the classical methods for detection of Mycobacterium leprae in differents types of clinical samples in leprosy patients and contacts. Lepr Rev. 2003;74(1):18-30.
16. Almeida, Elza Carmen de; Martinez, Alejandra Nóbrega; Maniero, Viviane Câmara; Sales, Ana Maria; Duppre, Nádia C; Sarno, Euzenir Nunes; et al. Detection of Mycobacterium leprae DNA by polymerase chain reaction in the blood and nasal secretion of Brazilian household contacts. Mem Inst Oswaldo Cruz. 2004;99(5):509-11.
17. Patrocínio LG, Goulart IM, Goulart LR, Patrocínio JA, Ferreira FR, Fleury RN. Detection of Mycobacterium leprae in nasal mucosa biopsies by polymerase chain reaction. FEMS Immunol Med Microbiol. 2005;44(3):311-6.
18. Alejandra N. Martinez, Constança F. P. C. Britto,José A. C. Nery, Elizabeth P. Sampaio, Márcia R. Jardim,Euzenir N. Sarno et al . Evaluation of real-time and conventional PCR targeting complex 85 genes for detection of Mycobacterium leprae DNA in skin biopsy samples from patients diagnosed with leprosy. J Clin Microbiol. 2006;44(9):3154-9.
19. FINE, P. E. M. Leprosy: The epidemiology of a slow bacterium. Epidemiol Rev. 1982;4:161-88.
20. LOMBARDI, C., FERREIRA, J. História natural da hanseníase. In: LOMBARDI, FERREIRA, MOTTA e OLIVEIRA, editores. Hanseníase: Epidemiologia e controle. São Paulo, Imprensa Oficial do Estado: Arquivo do Estado 1990; p.13-20.
21. TALHARI, S.; NEVES R. G. Dermatologia tropical: hanseníase, 3ª ed., Gráfica Tropical Manaus; 1997. p.97-101.
22. FERREIRA; I. N.; ALVAREZ, R. R. A. Hanseníase em menores de quinze anos no município de Paracatu, MG (1994 a 2001). Rev Bras Epidemiol. 2005;8(1):41-9.
23. CALADO, K.L.S. Inquérito sorológico com Ml Flow em contatos de pacientes de hanseníase no Município de Duque de Caxias/ RJ. 2005. 92p. Dissertação (Mestrado em Dermatologia) - Universidade Federal do Rio de Janeiro, Rio de Janeiro, 2005.
24. Moet FJ, Meima A, Oskam L, Richardus JH. Risk Factors For Development Of Clinical Leprosy Among Contacts And Their Relevance For Target Interventions. Lepr Rev. 2004;75(4):310-26.
25. Chanteau S, Glaziou P, Plichart C, Luquiaud P, Plichart R, Faucher JF, Cartel JL. Low predictive value of PGL-I serology for the early diagnosis of leprosy in family contacts: Results of a 10-year prospective field study in French Polynesia. Int J Lepr. 1993;61:533-41.
26. MATOS, H. J. Modelagem de Dados Epidemiológicos de Contatos de Hanseníase em uma Coorte Acompanhada na Fundação Oswaldo Cruz, Rio de Janeiro, entre 1987 e 1998. 2000. 99p. Dissertação (Doutorado em Saúde Pública) - Escola Nacional de Saúde Pública, Rio de Janeiro, 2000.
27. S. Bührer-Sékula, H. L. Smits, G. C. Gussenhoven,J. van Leeuwen, S. Amador, T. Fujiwara, et al. Simple and fast lateral flow test for classification of leprosy patients and identification of contacts with high risk of developing leprosy. J Clin Microbiol. 2003;41(5):1991-5.
28. Mitie Tada L.R.F. Brasil; Luiz Roberto de Oliveira; Nely S. Rímoli; Sérgio Cavallari F.; Otília S. Gonçalves; Zenaide L. Lessa et al. Sorologia Anti-PGL-1 e risco de ocorrência da hanseníase em área de alta endemicidade do Estado de São Paulo: quatro anos de seguimento. Rev Bras Epidemiol. 2003;6(3):262-71.
29. Roche PW, Britton WJ, Failbus SS, Williams D, Pradhan HM, Theuvenet WJ. Operational value of serological measurements in multibacillary leprosy patients: clinical and bacteriological correlates of antibody responses. Int J Lepr. 1990;58:480-90.
30. S J Brett, P Draper, S N Payne, and R J Rees. Serological activity of a characteristic phenolic glycolipid from Mycobacterium leprae in sera from patients with leprosy and tuberculosis. Clin Exp Immunol. 1983;52(2):271-9.
31. Klatser PR, de Wit MY, Fajardo TT, Cellona RV, Abalos RM, de la Cruz EC, et al.Evaluation of Mycobacterium leprae antigens in the monitoring of a dapsone-based chemotherapy of previously untreated lepromatous patients in Cebu, Philippines. Lepr Rev. 1989;60:178-86.
32. DAVEY, T.F. The nose in Leprosy: Steps for a better understanting. Lepr Rev. 1974;45,(2):97-103.
33. REES, R. J. W., MEADE, T. W. Comparison of the modes of spread and incidence of tuberculosis and leprosy. Lancet. 1974;47-8.
34. NOORDEEN, S. K., Leprosy 1962-1992. Epidemiology and Control of Leprosy - A review of progress over the last 30 years. Trans R Soc Trop Med Hyg. 1993;87:515-17.
35. Ramaprasad P, Fernando A, Madhale S, Rao JR, Edward VK, Samson PD, et al. Transmission and protection in leprosy: indications of the role of mucosal immunity. Lepr Rev. 1997;68,:301-15.
36. FOKKENS, W. J., TRENITE, G. J.N., VIRMOND, M. The nose in leprosy: Immunohistology of the nasal mucosa. Int J Lepr Other Mycobact Dis. 1998;66(3):328-39.
37. SCOLLARD, D. M.; SKINSNES O. K. Oropharyngeal Leprosy In Art, History, And Medicine. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999;87(4):463-70.
38. AZULAY E AZULAY. Dermatologia. 3ª ed. Guanabara Koogan. Rio de Janeiro (RJ), 2004. p.223-233
39. BRITTON, W.J., LOCKWOOD, D.N.J. Leprosy. Lancet. 2004;363:1209-19.
1. Doutora, Otorrinolaringologista da Fundação Oswaldo Cruz/FIOCRUZ - RJ.
2. Doutora, Laboratório de hanseníase do Instituto Oswaldo Cruz - IOC - FIOCRUZ, RJ.
3. Doutora, Curso de Pós-Graduação em Dermatologia, Faculdade de Medicina, UFRJ, RJ.
4. Doutora, Instituto de Patologia Tropical e Saúde Pública- Goiania, GO.
5. Doutora, Departamento de Micobacterioses, Instituto Oswaldo Cruz, FIOCRUZ, RJ.
Fundação Oswaldo Cruz - IOCRUZ Universidade Federal do Rio de Janeiro - FRJ Netherlands Leprosy Relief
Endereço para correspondência:
Ana Cristina da Costa Martins
Rua Gama Malcher 359 Freguesia
Jacarepaguá 22743-580 Rio de Janeiro Brasil
Netherlands Leprosy Relief
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 26 de outubro de 2009. cod. 6739
Artigo aceito em 15 de março de 2010