Ano: 2010 Vol. 76 Ed. 2 - Março - Abril - (11º)
Seção: Artigo Original
Páginas: 213 a 218
Expressão dos genes que codificam as proteínas anexina-1 e galectina-1 nos pólipos rinossinusais e sua modulação pelo glicocorticoide
Expression of genes that encode the annexin-1 and galectin-1 proteins in nasal polyposis and their modulation by glucocorticoid
Autor(es): Atílio Maximino Fernandes1, Erica Babeto2, Paula Rahal3, Paola Jocelan Scarin Provazzi4, Claudia Augusta Hidalgo5, Wilma T. Anselmo-Lima6
Palavras-chave: anexina a1, galectina 1, glucocorticoides, pólipos nasais.
Keywords: annexin a1, galectin 1, glucocorticoids, nasal polyps.
Resumo:
A fisiopatologia da polipose rinossinusal não é totalmente compreendida, apesar de várias hipóteses em relação ao seu processo inflamatório. Objetivos: Estudo prospectivo da expressão dos genes das proteínas, anexina-1 e a galectina- 1, que têm ação anti-inflamatória, e sua modulação pelo glicocorticoide. Material e Métodos: Onze pacientes portadores de polipose rinossinusal tiveram biopsiados seus pólipos em dois momentos: na ausência de glicocorticoide sistêmico, e na sua presença. Nas duas amostras, foi avaliada a expressão desses genes e comparada com a expressão na mucosa nasal normal do meato médio. Resultados: Verificou-se que a média de expressão dos genes que codifica a anexina-1 e galectina-1 estava predominantemente aumentada, independente do uso do glicocorticoide em relação à mucosa nasal controle. Entretanto, nos pólipos sem uso de corticoide, a média de expressão do gene da anexina-1 foi significativamente maior do que nos pólipos que estavam sob uso de glicocorticoide. Com relação à galectina-1 não houve diferença significativa entre as médias de expressão antes e após o uso de glicocorticoide sistêmico. Conclusão: Os genes apresentaram um aumento da expressão na mucosa nasal polipoide, independente do uso do glicocorticoide, porém a relação destes dois genes das proteínas anti-inflamatórias com o glicocorticoide não ocorreu da mesma maneira.
Abstract:
Rhinosinusal polyps physiopathology is not fully understand, despite numerous hypotheses regarding its inflammatory process. Aims: a prospective study regarding the gene expression of proteins: anexin-1 and galectin-1, which has an anti-inflammatory action and is modulated by steroids. Materials and Methods: eleven patients with rhinosinusal polyps suffered a biopsy of their polyps at two moments: in the absence of systemic steroids and during its use. In the two samples we assessed the expression of these genes and compared it to the normal nasal mucosa in the middle meatus. Results: We noticed that the mean expression of the genes which code anexin-1 and galectin-1 was predominantly increased, regardless of the use of steroids in relation to the control nasal mucosa. Notwithstanding, in polyps without the use of steroids, the mean gene expression of anexin-1 was significantly higher than in the polyps which were under the use of steroids. Regarding galectin-1, there was no significant difference between the expression mean values before and after the use of systemic steroids. Conclusion: The genes present an expression increase in the polyp mucosa, regardless of the use of steroids; nonetheless, the relationship of these two genes of anti-inflammatory proteins with steroids did not happen the same way.
![]()
INTRODUÇÃO
A polipose rinossinusal é caracterizada por edema da mucosa rinossinusal associada a uma degeneração de intensidade variável, sendo que se inicia geralmente na região do meato médio bilateralmente, podendo prolapsarse para os seios paranasais e fossas nasais, provavelmente correlacionadas com diferentes entidades clínicas e etiopatogênicas1. Mais recentemente, a polipose rinossinusal foi considerada como um subgrupo de rinossinusite crônica, onde os sintomas de congestão nasal, obstrução nasal, dor facial, secreção nasal anterior ou posterior e redução do olfato são sintomas comuns, porém a polipose rinossinusal se diferencia pela ocorrência de degeneração polipoide no meato médio bilateral2.
A falta de uma definição clara está correlacionada à não compreensão de sua etiopatogenia, pois apesar da consensual ocorrência do processo inflamatório e frequente eosinofilia tecidual, característica principal nos pólipos inflamatórios e edematosos, que correspondem a aproximadamente 90% dos pólipos rinossinusais, os mediadores inflamatórios analisados não correspondem a um processo inflamatório convencional, onde uma resposta inflamatória com padrão eosinofílico se torna persistente e sem relação com os mecanismos de atopia conhecidos. Acredita-se numa causa multifatorial, acarretando consequente degeneração da mucosa rinossinusal de intensidade variável, levando aos sintomas de obstrução nasal, anosmia e rinossinusite de repetição3.
Proteínas anti-inflamatórias, como a anexina-1 e galectina-1, têm sido relacionadas com o processo inflamatório conforme demonstração em modelos animais. Elas parecem intermediar a resposta inflamatória quando da administração do glicocorticoide.4-6
A anexina-1 constitui uma família de 12 proteínas nos mamíferos, com propriedade geral de se ligar a fosfolipídios e ao cálcio. São abundantes nos tecidos dos mamíferos, mas têm uma discreta distribuição em certas células epiteliais, como as do sistema respiratório e urinário, pele, a sinóvia, macrófagos e leucócitos teciduais7. A anexina-1 tem sido implicada em vários processos intracelulares, tais como transdução de sinal intracelular, ligação de membrana do citoesqueleto, proliferação e diferenciação. Sua função anti-inflamatória é atribuída a sua habilidade de inibir a fosfolipase A2 e de sua ligação com receptores de superfície específico dos granulócitos e macrófagos, que resulta na inibição da diapedese de leucócitos7.
Foi demonstrado também que os glicocorticoides podem induzir a síntese da anexina-1 nos monócitos e neutrófilos, porém em outras linhagens celulares onde sua expressão está relacionada com a diferenciação e crescimento celular, os glicocorticoides parecem não exercer a mesma função.
A galectina é de uma família particular das lecitinas que se ligam aos galactosídeos. A galectina-1 foi a primeira a ser descrita, sendo constituída de uma proteína homodimérica; se expressa principalmente em órgãos linfoides, como timo, nódulos linfáticos, além de macrófagos ativados e células T, sugerindo uma importante relação com a geração e manutenção da tolerância imunológica. A precisa função "in vivo" é incerta, devido à ruptura do gene da galectina-1, porém em estudos com inibidores da galectina-1 em ratos, houve uma inibição do processo inflamatório agudo, por provável redução do influxo de polimorfonucleares no processo inflamatório8.
Com relação às doenças inflamatórias, em estudo através de imunoistoquímica, verificou-se uma variabilidade da expressão da galectina na mucosa nasal, quando comparado à mucosa nasal da concha nasal inferior, da concha nasal média e do pólipo nasal, e entre o grupo alérgico do não alérgico. Verificou-se que a galectina-1 é mais expressa nos pólipos do que na concha média e inferior, porém notou-se que há uma maior expressão da galectina-1 na concha nasal inferior quando comparada com a concha média, e há maior expressão nos pacientes alérgicos, porém sem diferença significativa9. Esta variabilidade induz a questionar possíveis relações da galectina-1 nos processos inflamatórios e na formação dos pólipos nasais. Esses autores questionaram se a maior expressão da galectina-1 na concha inferior em relação à concha média não seria um efeito de proteção anti-inflamatória e consequente inibição do crescimento dos pólipos, o que explica a não ocorrência de degeneração polipoide na concha inferior. Com relação à maior expressão no pólipo, acredita-se que seja uma tentativa desenfreada para bloquear o processo inflamatório já instalado. Diante disso decidimos estudar a expressão dos genes que codificam estas duas proteínas com características anti-inflamatórias, a anexina-1 e a galectina-1, na mucosa do pólipo rinossinusal e sua relação quando do uso do glicocorticoide sistêmico.
PACIENTES E MÉTODOS
Os espécimes de pólipo rinossinusal foram obtidos de pacientes portadores de polipose rinossinusal, atendidos no ambulatório de Otorrinolaringologia do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de São José do Rio Preto-SP(FAMERP), que aceitaram participar e assinaram o termo de consentimento do projeto de pesquisa aprovado pelo Comitê de Ética e Pesquisa da instituição supracitada, conforme processo no0220/2001.
Inicialmente participaram do estudo 15 pacientes portadores de polipose rinossinusal diagnosticada pela nasofibroscopia e com confirmação do diagnóstico por estudo histopatológico. Estes pacientes além do diagnóstico clínico de polipose rinossinusal, eram maiores de 18anos, tinham indicação cirúrgica por refratariedade ao tratamento clínico, ou por queixas persistentes de obstrução e anosmia.
De todos os 15 pacientes foram obtidas duas amostras, constituindo dois grupos de amostras de pólipos rinossinusais. O primeiro grupo corresponde às biópsias obtidas quando da primeira consulta com o paciente sem uso de corticosteroide e/ou anti-histamínicos sistêmicos, tópicos ou inalatórios, antileucotrienos, que foi denominado de B-1. O segundo grupo corresponde às biópsias obtidas dos pacientes quando da realização da cirurgia e em uso de corticosteroide sistêmico - acetato de betametasona/fosfato sódico de betametasona - 1 ampola de 1 ml aplicada por via intra-muscular 05 dias antes do procedimento, que foi denominado de B2. Sendo que o tempo entre a primeira e a segunda biópsia variou de acordo com o agendamento da cirurgia, mas sempre a cirurgia foi realizada em vigência do uso de corticosteroide. Deve-se salientar que quando os pacientes faziam uso contínuo de medicação anti-hipertensiva e/ou antiglicemiantes orais, estes foram mantidos para não causar prejuízos funcionais à saúde dos pacientes.
Um terceiro grupo, denominado de controle, foi constituído de 10 biópsias de mucosa nasal, obtidas da região do meato médio de cadáveres frescos, do serviço de verificação de óbitos da FAMERP, que estavam internados e faleceram por outro motivo, sem qualquer história de doença rinossinusal, nem queixas nasais.
Todas as biópsias, tanto as obtidas no ambulatório quando da primeira consulta, B-1, como as obtidas no centro cirúrgico no ato da cirurgia, B-2, e de mucosa nasal normal de cadáveres - grupo controle, foram acondicionadas rapidamente em bujão de nitrogênio líquido e posteriormente transportadas para o laboratório onde foram processadas para a extração do RNA, e consequente verificação da expressão dos genes que codificam as proteínas anexina-1 e galectina-1, pela metodologia do RT-QPCR10.
Durante o processo de extração do RNA, quatro pacientes foram retirados do estudo devido à degradação parcial do RNA das amostras, finalizando assim 11 pacientes, com duas amostras pareadas, uma sem uso de corticoide e outra com o uso de corticoide.
Para a extração do RNA total foi utilizado o Reagente Trizol®, (Invitrogen®). A próxima etapa foi à determinação da concentração dos RNAs, através dos comprimentos de ondas: DO260/DO280. Uma 1µg de cada amostra foi submetida a uma corrida eletroforética em gel de agarose 1% para análise da presença ou não de RNA degradado.
A análise do gel, sob luz ultravioleta, deveria mostrar um rastro de RNA, com bandas específicas de 28S e 18S representando o RNA ribossomal.
A partir do RNA total extraído foi obtido cDNA utilizado o Kit High Capacity cDNA (Applied Biosystems), com adição de 1,25µL de oligo (dT) ancorado (500µg/mL) e 2µL de RNAse Out (40U/µL). A qualidade do cDNA foi avaliado por meio da amplificação por PCR de um fragmento de 613pb do gene b-ACTINA, o qual serve como controle para transcritos abundantes. As sequências de bases de oligonucleotídeos utilizados para amplificação do fragmento foram F 5' GGCATCGTGATGGACTCCG 3' e R 5'GCTGGAAGGTGGACAGCG 3'.
As reações de PCR em Real Time Quantitativo foram realizadas em equipamento para PCR em tempo real ABI Prism® 7300 (Applied Biosystem). As amostras controle foram realizadas um pool para minimizar as variações, já que não eram amostras controle do mesmo paciente.
O cDNA das amostras foram testadas em triplicata utilizando Kit Power SyberGreen PCR Core Reagent (Applied Biosystems). Os oligonucleotídeos iniciadores para o gene ANX1 são: F 5' AGAAGATGTATGGTATCTCCCTTTGC 3' e R 5' GAGCCACCAGGATTTTCTCATAA 3'. Os oligonucleotídeos iniciadores para o gene GAL1 são: F 5' CAGCGGGAGGCTGTCTTTC 3' e R 5' CCTGGTCGAAGGTGATGCA 3'. O gene Beta-tubulina foi utilizado como controle endógeno da reação. A sequência dos oligonucleotídeos para o gene da Beta-Tubulina são F 5' TCAACACCTTCTTCAGTGAAACG 3' e R 5' AGTGCCAGTGCGAACTTCATC 3'. O valor da expressão relativa dos genes Anexina 1 e Galectina 1 foram calculados de acordo com o trabalho de Pfaffl10.
RESULTADOS
Avaliando-se as características clínicas dos 11 pacientes que tiveram uma boa qualidade do RNA extraído e, portanto, que preencheram os critérios para o desenho do estudo, observou-se 8 (72,7%) pacientes do sexo masculino e 3 (27,2%) do sexo feminino, com idades variando entre 35 e 72 anos, com média de 53,9 anos.
A asma estava presente em somente um indivíduo (9,0%), a intolerância ao AAS em dois indivíduos (18,1%), cirurgias prévias ocorreram em três pacientes e dois pacientes apresentavam hipertensão arterial sistêmica (HAS), um diabetes e um hipotireoidismo, como mostrado na Tabela 1.
Os valores de expressão dos genes que codificam as proteínas estudadas foram demonstrados por uma razão denominada R, que significa a quantidade de vezes que determinada proteína em um determinado grupo foi mais expressa em relação a outro grupo. Para se chegar à razão R, uma mesma amostra foi processada três vezes, e realizou-se uma média destas três reações; desse modo, pode-se definir a razão R como uma média da expressão do gene que codifica uma determinada proteína nas três reações em um determinado paciente, e denomina-se de DESVIO DCT o desvio padrão desta média nas três reações. Para uma melhor padronização gráfica dos valores de R,optou-se por utilizar os valores da expressão em seu log2 quando da confecção dos Gráficos.
Considera-se que houve um aumento da expressão gênica quando o valor da razão entre o grupo estudado e o controle for maior que 2 ou valor de 1 quando usado a expressão de log2; abaixo ou igual a essa razão, considerase que o aumento de expressão não foi significativo. Esta mesma relação vale para os valores negativos, ou seja, nos pacientes onde ocorreu a diminuição da expressão gênica.
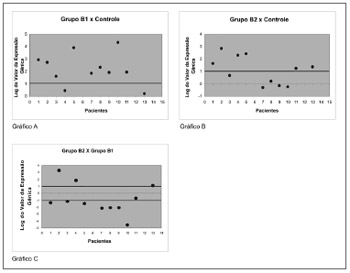
Dessa forma, verificou-se que nos pólipos livres de corticosteroide, quando comparado com a mucosa nasal controle, a proteína anexina-1 apresentou um aumentoda expressão em 9 dos 11 indivíduos (81,8%), conforme Gráfico A da Figura 1. A análise dos pólipos de indivíduos em uso de corticosteroide comparados com mucosa nasal controle mostrou um aumento de expressão em 6 dos 11 indivíduos (54,5%) conforme Gráfico B da Figura 1, e quando se compara os pólipos de indivíduos em uso de corticosteroide com os pólipos livres de corticosteroide verifica-se que apenas 3 indivíduos (27,2%) apresentaram um aumento da expressão gênica significativa, porém 7 dos 11 indivíduos (63,6%) apresentaram uma diminuição significativa da expressão da proteína, conforme Gráfico C da Figura 1.
Figura 1. Valor da expressão gênica em log2 da proteína anti-inflamatória Anexina-1 em pólipos nasais. RT-QPCR foi usado para medir os níveis de RNAm do gene codificador dessa proteína em amostras de mucosa nasal normal - grupo controle, pólipo sem uso de corticoide - grupo B1 e pólipo em uso de corticoide - grupo B2. A expressão gênica da proteína Anexina-1 em tecidos de pólipo sem corticoide em relação a tecidos de controle (Gráfico A), pólipos com uso de corticoide em relação ao controle (Gráfico B) e pólipos com uso de corticoide em relação a pólipos sem uso de corticoide (Gráfico C).
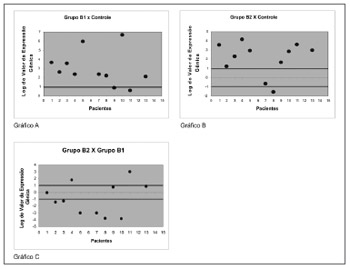
Quando a proteína galectina-1 foi avaliada, verificou- se que 9 de 11 pacientes (81,9%) apresentaram um aumento de expressão quando comparados os pólipos livre de corticosteroide com a mucosa nasal controle, conforme Gráfico A da Figura 2. Verificou-se que 9 de 11 pacientes (81,9%) apresentaram um aumento de expressão na comparação dos pólipos de pacientes em uso de corticosteroide com a mucosa nasal controle conforme Gráfico B da Figura 2, e quando comparamos os pólipos de indivíduos em uso de corticosteroide com os pólipos livres de corticosteroide verificamos que apenas 3 pacientes (27,2%) apresentaram um aumento significativo da expressão do gene que codifica a galectina-1, porém verifica-se que 6 de 11 pacientes (54,5%) apresentaram uma diminuição significativa da expressão da proteína galectina-1, como pode ser verificado no Gráfico C da Figura 2.
Figura 2. Valor da expressão gênica em log 2 da proteína antiinflamatória Galectina-1 em pólipos nasais. RT-QPCR foi usado para medir os níveis de RNAm do gene codificador dessa proteína em amostras de mucosa nasal normal - grupo controle, de pólipo sem uso de corticoide - grupo B1 e pólipo em uso de corticoide - grupo B2. A expressão gênica da proteína Anexina-1 em tecidos de pólipo sem corticoide em relação a tecidos de controle (Gráfico A), pólipos com uso de corticoide em relação ao controle (Gráfico B) e pólipos com uso de corticoide em relação a pólipos sem uso de corticoide (Gráfico C).
DISCUSSÃO
A ação anti-inflamatória da anexina-1 pode ser demonstrada como no modelo de estudo em rato que teve o gene para a anexina-1 suprimido4. Neste estudo, foi verificado que quando da supressão da expressão da anexina-1 ocorre um aumento de expressão do RNAm para as citocinas pró-inflamatórias, como a IL-1β, TNF-α, IL-6 e MIF nas células sinoviais quando da indução do processo inflamatório.
Em outros estudos11,12, ficou demonstrado que a administração de anticorpos antianexina-1 bloqueia a inibição induzida pelo glicocorticoide no recrutamento de neutrófilos e monócitos, e também induz a uma exacerbação do processo inflamatório, sugerindo assim que o glicocorticoide age no tecido inflamado mediante a presença concomitante da anexina-1, potencializando seu efeito anti-inflamatório.
Entretanto, em estudo imunoistoquímico avaliando a ocorrência da anexina-1 na mucosa nasal verificou-se que ocorreu uma alteração da expressão da anexina-1 de acordo com o tipo celular, sua localização, e seu estado de diferenciação, porém não houve uma diferença de expressão entre a mucosa nasal normal e a mucosa nasal inflamada, seja na rinite perene ou na polipose rinossinusal, sugerindo assim que a expressão da anexina-1 não foi alterada na mucosa nasal cronicamente inflamada7.
Neste estudo, verificou-se através da técnica do RTQPCR, que a maioria dos pacientes, 81,8%, apresentou um aumento significativo da expressão do gene que codifica a anexina-1 quando comparado com a mucosa nasal normal, mostrando assim que ela deve participar do processo inflamatório na mucosa polipoide, pois independente do pólipo estar ou não sob ação do corticosteroide sistêmico houve um aumento de sua expressão quando comparado com a mucosa nasal normal. Porém, verificou-se que a média de expressão da anexina-1 diminuiu quando do uso de glicocorticoide, ao contrário do demonstrado em modelos animais em que a dexametasona aumentou a expressão da proteína anexina-1.
Apenas dois de 11 pacientes neste estudo apresentaram um aumento significativo da anexina-1 após a administração do glicocorticoide. O fato de não ter ocorrido um aumento da expressão na maioria dos pacientes parecer ser incoerente por ser a anexina uma proteína anti-inflamatória, porém em estudos com células MCF-7 que foram incubadas e tratadas com dexametasona ou hidrocortisona não foi verificada alteração da expressão ou distribuição celular da anexina13.
Parece que sua ação está mais relacionada à fase aguda, onde ocorre uma participação preponderante dos neutrófilos11, ao contrário do que ocorre na mucosa polipoide que tem um estado inflamatório crônico e com predomínio de infiltração eosinofílica. Entretanto, a participação de polimorfonucleares pode ser variável de acordo com a intensidade do processo inflamatório, o que parece ser pertinente neste estudo, pois se verifica que a média de expressão da anexina-1 é maior no Grupo B1 do que no Grupo B2, sendo que a intensidade do processo infeccioso no primeiro grupo é maior, e no segundo a intensidade do processo infeccioso diminuiu apesar de ainda manter o estado inflamatório, pois os pacientes tinham feito uso de glicocorticoide.
Com relação à galectina-1, em estudo de modelo experimental de artrite reumatoide6, induzida pela infiltração de colágeno, a galectina-1 pareceu suprimir a resposta inflamatória crônica, pois a injeção de fibroblastos modificados para secretar galectina-1 ou a administração contínua de galectina recombinante aboliu a manifestação clínica e histopatológica da artrite.
Em estudo avaliando-se a ocorrência da galectina-1 na mucosa nasal e polipoide, através da técnica de imunoistoquímica, verificou-se que os pólipos apresentaram um aumento da expressão da galectina-1, quando comparado com a mucosa de concha nasal média e inferior. Houve, porém, uma tendência de maior expressão nos pacientes alérgicos e nas conchas inferiores, fato este que poderia ser questionado sendo uma proteção anti-inflamatória e consequentemente de inibição do crescimento dos pólipos, pois é consensual que não há degeneração polipoide na concha inferior.
Neste estudo, também se verificou uma maior expressão da galectina-1 nos pólipos quando comparado com a mucosa nasal normal, porém não houve a preocupação de separar em grupos de alérgico e não alérgicos, pois é referido que a incidência de alérgicos nos pacientes com polipose rinossinusal é semelhante na população em geral14.
Sabe-se que o efeito anti-inflamatório do glicocorticoide está no aumento da transcrição de genes antiinflamatórios, como a da proteína inibidora de leucócitos,e da diminuição da transcrição de genes inflamatórios,5 como o fator estimulador de colônias de macrófago e granulócitos, porém seu mecanismo de ação na polipose não é totalmente compreendido. No estudo que se avaliou a relação da galectina-1 com a administração de budesonida via nasal nos pacientes com polipose15, verificou-se que a budesonida aumentou significativamente a expressão da galectina-1 nos pólipos dos pacientes alérgicos; entretanto esses resultados não se repetiram com os pacientes não alérgicos. Nos resultados deste estudo foram encontrados dois de quatro pacientes alérgicos que também apresentaram um aumento de expressão do gene que codifica a galectina-1, porém nos outros dois pacientes houve uma diminuição da expressão, apesar deles ainda apresentarem um aumento significativo da expressão gênica quando comparados com os indivíduos normais.
Neste estudo verificou-se também que tanto a anexina- 1 como a galectina-1 estão aumentadas na maioria dos pólipos de pacientes, independentes de estarem em uso ou não de glicocorticoide sistêmico, porém verificamos que quando do uso de glicocorticoide ocorreu uma diminuição significativa da média de expressão da proteína anexina-1 pela metodologia do RT-QPCR. Entretanto, não houve uma diminuição significativa do número de pacientes que tiveram a expressão das proteínas diminuídas. Com relação à galectina-1, também houve uma diminuição da média de sua expressão após o uso de glicocorticoide, porém esta diminuição não foi significativa, sugerindo que a relação destas duas proteínas anti-inflamatórias com o glicocorticoide não ocorre da mesma maneira.
Inicialmente, esperava-se que o corticoide aumentasse a expressão destas proteínas anti-inflamatórias, porém observou-se que o pólipo sem corticoide deve apresentar um estado inflamatório muito acentuado, com uma super expressão destas proteínas, provavelmente com o objetivo de diminuir o processo inflamatório. Quando administrado o glicocorticoide ocorreu uma diminuição do estado inflamatório e consequente queda da expressão, porém esta expressão ainda manteve-se elevada em relação à mucosa nasal controle.
CONCLUSÃO
Conclui-se que os pólipos rinossinusais apresentam um aumento da expressão dos genes que codificam as proteínas anti-inflamatórias anexina-1 e galectina-1, e que após o uso de glicocorticoide sistêmico a média de expressão do gene da anexina-1 diminuiu significativamente, porém o da galectina-1 não sofreu alteração significativa da sua expressão.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Settipane AG. Epidemiology of nasal polyps. Allergy Asthma Proc. 1996;17(5):231-6.
2. Fokkens W, Lund V, Bachert C, Clement P, Hellings P, Holmstrom M et al. European position paper on rhinosinusitis and nasal polyps. Rhinology. 2005;Suppl. 18:1-88.
3. Fernandes AM. Estudo Cariométrico comparativo entre o epitélio glandular da mucosa nasal e da polipose nasossinusal. (Dissertação) Ribeirão Preto: Faculdade de Medicina - Universidade de São Paulo; 2001.
4. Yang YH, Morand EF, Getting SJ, Paul-Clarck M, Liu DL, Yona S et al. Modulation of inflammation and response to dexamethasone by annexin 1 in antigen-induce arthritis. Arthritis Rheum. 2004;50(3): 976-84.
5. Benson M. Pathophysiological effects of glucocorticoids on nasal polyps: an update. Curr Opin Allergy Clin Immunol. 2005;5:31-5.
6. Rubinstein N, Llarregui JM, Toscano MA, Rabinovick GA. The role of galectins in the initiation, amplification and resolution of the inflammatory response. Tissue Antigens. 2004;64(1):1-12.
7. Rodrigo JP, Garcia-Pedrero JM, González MV, Fernandez MP, Suarez C, Herrero A. Expression of annexin A1 in normal and chronically inflamed nasal mucosa. Arch Otolaryngol Head Neck Surg. 2004;130:211-5.
8. La M, Cao TV, Cerchiaro G, Chilton K, Hirabayashi J, Kasai K et al. A novel Biological activity for galectin-1: Inhibition of leukocyteendothelial cell interations in experimental inflammation. Am J Pathol. 2003;163(4):1505-15.
9. Delbrouck C, Gabius HJ, Kaltner H, Decasestecker C, Hassid S, Kiss R. Expression patterns of gallectin-1 and galectin-3 in nasal polyps and middle e inferior turbinates in relation to growth regulation and immunosupression. Arch Otolaryngol Head Neck Surg. 2003;129(6):665-9.
10. Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 2001;29(9):2002-7.
11. Roviezzo F, Getting SJ, Paul-Clarck M, Yona S, Gavins FNE, Perretti M et al. The annexin-1 knockout mouse: what it tells us about the inflammatory response. J Physiol Pharmacol. 2002;53(4):541-53.
12. Perretti M, Croxtall JD, Wheller SK, Goulding NJ, Hannon R, Flower RJ. Mobilisation of lipocortin 1 in adherent human polymorphonuclear leukocytes negatively modulates their transmigration by dexamethasone. Nat Med. 1996;2:1259-62.
13. Frey BM, Reber BFX, Vishwanath BS, Escher G, Frey F J. Annexin I modulates cell functions by controlling intracellular calcium release. FASEB J. 1999;13:2235-45.
14. Delbrouck C, Doyen I, Belot N, Decasestecker C, Ghanooni R, Lavareile A. Galectin-1 is overexpressed in nasal polyps under budesonide and inhibits eosinophil migration. Lab Invest .2002;82(2):147-58.
15. Oliani SM, Christian HC, Manston J, Flower RJ, Perreti M. An Immunocytochemical and In Situ Hybridization Analysis of Annexin 1 expression in rat mast cells: Modulation by inflammation and dexamethasone. Lab Invest. 2000;80(9):1429-38.
1. Doutor, médico do Depto. Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Famerp. São José do Rio Preto - SP.
2. Mestre em genética, aluno da pós-graduação nível doutorado do Depto. de Biologia - Ibilce/UNESP - São José do Rio Preto.
3. Doutora, professora doutora do Depto. de Biologia - Ibilce/UNESP - São José do Rio Preto.
4. Mestre, aluno da pós-graduação nível doutorado do Depto. de Biologia - Ibilce/UNESP - São José do Rio Preto.
5. Doutora, professora doutora de Matemática da UNIP - São José do Rio Preto.
6. Livre-docência, professora associada de Depto. de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 30 de maio de 2009. cod. 6420
Artigo aceito em 24 de julho de 2009