Ano: 2010 Vol. 76 Ed. 1 - Janeiro - Fevereiro - (15º)
Seção: Artigo Original
Páginas: 91 a 95
Cocleotoxicidade da gentamicina por doses habituais para neonatos - estudo funcional
A functional study on gentamicin-related cochleotoxicity in its conventional dose in newborns
Autor(es): Carla Luiza Baggio1, Aron Ferreira da Silveira2, Miguel Angelo Hyppolito3, Flávia Fiacadori Salata4, Maria Rossato5
Palavras-chave: audição, gentamicinas, recém-nascido, toxicidade.
Keywords: hearing, gentamicin, infant, toxicity.
Resumo:
A identificação precoce das alterações auditivas possibilita a intervenção ainda no "período crítico" e ideal de estimulação da linguagem e da audição. A ototoxicidade infantil é um tema bastante controverso. Têm sido relatadas percentagens variáveis de casos de ototoxicidade em crianças com vários antibióticos aminoglicosídeos. Os principais grupos pediátricos que recebem antibióticos aminoglicosídeos são recém-nascidos com infecções graves na UTI neonatal. Objetivos: Verificar o aspecto funcional das células ciliadas externas da cóclea a esquemas terapêuticos utilizados para o tratamento de infecções no período neonatal. Forma de Estudo: Experimental. Material e Método: Foram estudadas 26 cobaias albinas, através das emissões otoacústicas por produto de distorção, prévia e posteriormente a aplicação de gentamicina. Resultados: Em todas as avaliações, o estado funcional das células ciliadas externas, estudadas pelas emissões otoacústicas por produto de distorção, mostraramse preservadas. Conclusão: Neste experimento não foram observadas alterações no funcionamento das células ciliadas externas de cobaias albinas sob tratamento com gentamicina nas doses de 4 mg/Kg/dia e 2,5 mg/Kg/dia a cada 12 horas, por 10 e 14 dias.
Abstract:
The early identification of hearing impairment allows for an intervention still in the "critical" and ideal period of hearing and language stimulation. Pediatric ototoxicity is a very controversial topic. There have been variable percentages of ototoxicity cases in children with different aminoglycosides antibiotics. The main pediatric groups whom receive aminoglycosides are newborns with severe infections on the neonatal ICU. Aim: to check the functional aspect of the cochlear external hair cells and treatment regimens used to treat infections during the neonatal period. Study design: Experimental. Materials and Methods: we studied 26 albino guinea pigs, through distortion product otoacoustic emissions, before and after the use of gentamicin. Results: in all the assessments, the external hair cells functional status, studied by means of the distortion product otoacoustic emissions, proved preserved. Conclusion: In the present study, we did not notice changes in outer hair cell function in the albino guinea pigs treated with gentamicin in the doses of 4 mg/Kg/ day and 2.5 mg/Kg/day every 12 hours for 10 and 14 days.
![]()
INTRODUÇÃO
Nossa audição assume um papel muito importante na comunicação humana. A deterioração da sensibilidade auditiva pode acarretar alterações psicossociais no indivíduo, uma vez que a perda da compreensão da fala significa romper uma forma de contato com o mundo e com as pessoas1.
A identificação precoce das alterações auditivas possibilita a intervenção ainda no "período crítico" e ideal de estimulação da linguagem e da audição. O processo de maturação do sistema auditivo central ocorre durante os primeiros anos de vida. A experiência auditiva neste período de maior plasticidade cerebral, onde novas conexões neurais se estabelecem, é imprescindível para garantir o desenvolvimento da audição e da linguagem2.
Do ponto de vista fisiológico, a estrutura receptora auditiva é formada por células de sustentação e células receptoras ciliadas, localizadas no órgão de Corti. As células ciliadas externas não têm capacidade de receber o estímulo sonoro, mas tem a capacidade de contrair-se de forma rápida e lenta devido as suas propriedades biomecânicas3.
As células ciliadas externas constituem o amplificador coclear, sendo importante no mecanismo de amplificação do estímulo para determinar o funcionamento das células ciliadas internas, que são as unidades receptoras e codificadoras cocleares com papel importante na seletividade frequencial da cóclea4.
Quando o estímulo vibratório-mecânico atinge a cóclea estimula as células ciliadas externas. Esse estímulo vai ser amplificado em direção às células ciliadas internas. Assim, cria-se um eco (emissão otoacústica) que pode ser medido5.
As Emissões Otoacústicas (EOA) são energias sonoras de fraca intensidade que são amplificadas pela contração das células ciliadas externas, na cóclea, podendo ser captadas no meato acústico externo. Foram descobertas em 1978 pelo professor de biofísica da Audição da University College, em Londres, Dr. David T. Kemp. Podem ser classificadas em: espontâneas - se captadas no meato acústico externo na ausência de estimulação acústica; evocadas - quando há liberação da energia captada no meato acústico externo em resposta a um estímulo acústico. As EOA evocadas classificam-se em transitórias - evocadas por estímulo acústico breve de espectro amplo que abrange uma gama de frequências - clique ou tune burst; produto de distorção - evocadas por dois tons puros simultâneos (F1 e F2) que por intermodulação produzem como resposta um produto de distorção (2F1- F2); estímulo-frequência, evocadas por sinal continuo de fraca intensidade na frequência do estimulo apresentado: são menos usadas clinicamente4.
A perda auditiva pode ser congênita ou adquirida, podendo apresentar-se em diferentes graus e tipos. Dentre as causas adquiridas está o uso de drogas ototóxicas, que são medicamentos que causam reações tóxicas às estruturas da orelha interna afetando o sistema auditivo e/ou vestibular.
A ototoxicidade infantil é um tema bastante controverso. Têm sido relatadas percentagens variáveis de casos de ototoxicidade em crianças com vários antibióticos aminoglicosídeos, como a estreptomicina, a diidrostreptomicina, a canamicina, a amicacina e a gentamicina, sendo esta uma importante droga no tratamento de muitas infecções causadas por bacilos gram-negativos6.
A gentamicina é o primeiro aminoglicosídeo de escolha por causa do seu baixo custo e por ser ativo na maioria dos bacilos gram-negativos aeróbicos resistentes7. Os principais grupos pediátricos que recebem antibióticos aminoglicosídeos são recém-nascidos com infecções graves na UTI neonatal6.
Os aminoglicosídeos provocam danos como o comprometimento das células ciliadas externas, lesando inicialmente as células da espira basal da cóclea. A incidência de ototoxicidade causada pela gentamicina varia de 6% a 16%8.
Estudos em animais têm papel essencial no desenvolvimento da ciência. Pesquisas experimentais com animais têm sido importantes para o desenvolvimento de novas drogas, no aprimoramento do conhecimento acerca dos mecanismos fisiopatológicos de doenças, para empreender ensaios terapêuticos com novos fármacos, estudar marcadores biológicos e avaliar técnicas com perspectivas de aplicabilidade na espécie humana9.
A realização deste trabalho justifica-se pela importância de pesquisas que contribuam para um conhecimento mais aprofundado deste tema, possibilitando aos profissionais da saúde a adoção de procedimentos que busquem a manutenção da integridade auditiva para uma melhor qualidade de vida.
Fundamentado na literatura e procurando conhecer os resultados do uso da gentamicina em dosagens utilizadas na UTI neonatal, este estudo teve como objetivo verificar o aspecto funcional das células ciliadas externas da cóclea a esquemas terapêuticos utilizados para o tratamento de infecções no período neonatal.
MATERIAL E MÉTODOS
Neste experimento foram utilizadas 26 cobaias fêmeas, albinas, pesando em torno de 400 a 550 gramas, com reflexo de Preyer normal. Os animais foram usados de acordo com as diretrizes desta instituição que está baseado no guia para o cuidado de animais de laboratório do Institute of Laboratory Animal Resources, Comission on Life Sciences, National Research council, National Academy Press, Washington, D. C., 1996. Este estudo foi aprovado pelo Comitê de Ética em experimentação Animal (CETEA) sob o protocolo 073/2007.
A droga utilizada nesta pesquisa foi o antibiótico aminoglicosídeo gentamicina (geramicin, 60 mg/ml, Laboratório Schering) administrado por via intramuscular. Os animais foram pesados a cada dois dias para controle da dosagem da droga. As cobaias foram submetidas à avaliação por emissões otoacústicas por produto de distorção em cabine com isolamento acústico e sob anestesia com cloridrato de cetamina (Ketamin 50mg/ml, Laboratório Cristália,) 40 mg/kg e xilazina (Dopaser 20 mg/ml, Laboratório Calier do Brasil,) 10 mg/kg, pré e pós-aplicação da gentamicina. O equipamento utilizado foi o ILO 92 CAE System Otodynamics LTD.
As cobaias foram divididas em 5 grupos:Grupo 1 - grupo controle (placebo) - constituído de duas cobaias (quatro cócleas) que receberam soro fisiológico na dosagem de 1,0 ml de 12 em 12 horas, por via intramuscular, pelo período de 14 dias; Grupo 2: constituído de 6 cobaias (12 cócleas) que receberam gentamicina na dosagem de 4 mg/kg/dia pelo período de 10 dias; Grupo 3: constituído de 6 cobaias (12 cócleas) que receberam gentamicina na dosagem de 4 mg/kg/dia pelo período de 14 dias; Grupo 4: constituído de 6 cobaias (12 cócleas) que receberam gentamicina na dosagem de 2,5 mg/kg/dia de 12 em 12 horas, pelo período de 10 dias; Grupo 5: constituído de 6 cobaias (12 cócleas) que receberam gentamicina na dosagem de 2,5 mg/kg/ dia de 12 em 12 horas pelo período de 14 dias.
Neste estudo foram consideradas para análise as emissões otoacústicas nas frequências a partir de 1500 Hz que avaliam o estado funcional das células ciliadas externas na espira basal da cóclea, verificando a relação sinal/ruído das emissões. Para análise estatística foi utilizado em primeira instância o teste de normalidade (Shapiro Wilk). Com a não normalidade dos dados optou-se pelos testes não paramétricos: variáveis dependentes (Wilcoxon) e independentes (Kruskal Wallis). O nível de significância utilizado foi de 5%.
RESULTADOS
Considerando a dose de Gentamicina utilizada, de 4 mg/Kg/dia, por 10 dias de tratamento consecutivo (grupo 2), não foram observadas alterações nas emissões otoacústicas por produto de distorção pré e pós-tratamento, em uma análise qualitativa, as emissões otoacústicas se mostraram presentes, nas duas situações.
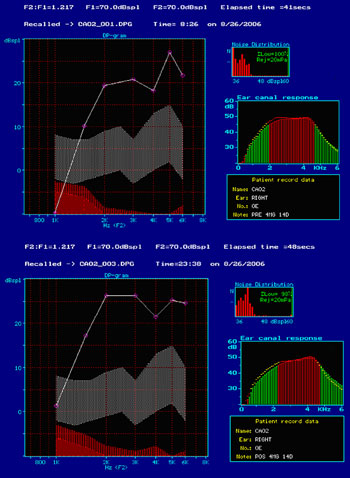
Quanto às emissões otoacústicas no grupo 3, cobaias albinas tratadas com Gentamicina, 4 mg/Kg/dia, por 14 dias, não foram observadas alterações nas emissões otoacústicas por produto de distorção pré e pós-tratamento. A Figura 1 mostra um exemplo de emissões otoacústicas por produtos de distorção presentes, nas situações, pré e pós-tratamento para o grupo 3 e que foi observada em todos os grupos de estudo. Nos grupos 4, tratado com Gentamicina 5 mg/Kg/dia, por 10 dias - pré e póstratamento e 5, gentamicina 2,5 mg/Kg/dia de 12 em 12 horas, via intraperitoneal por 14 dias pré e pós-tratamento as emissões otoacústicas por produtos de distorção estiveram presentes.
Figura 1. Foto da tela do programa ILO 92 onde verificamos a presença de resposta s emissões otoacústicas por produto de distorção no grupo tratado com gentamicina 4 mg/Kg/dia por 14 dias, pré (A) e pós (B) tratamento (no dia do sacrifício).
Foram consideradas como presentes as emissões otoacústicas por produto de distorção a partir de 1,5 kHz, pois as dimensões do conduto auditivo externo da cobaia fazem com que haja uma dificuldade de detecção das emissões otoacústicas abaixo desta frequência, obtendo respostas que coincidem com as respostas do ruído.
Em todas as avaliações, o estado funcional das células ciliadas externas, estudadas pelas emissões otoacústicas por produto de distorção, mostraram-se preservadas.
Com relação à análise estatística dos dados apresentados, para comparar a relação sinal/ruído pré e póstratamento com gentamicina, entre os grupos 2, 3, 4 e 5, foi utilizado o teste não paramétrico de Kruskal-Wallis.
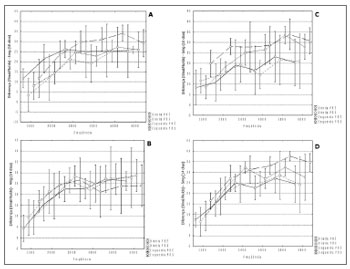
O resultado do teste foi p > 0,05 não mostrando diferença estatisticamente significante entre os grupos. Os dados referentes à relação sinal/ruído observada nos grupos 2, 3, 4 e 5 estão representados na Figura 2 A, B, C e D, respectivamente.
Figura 2. A, B, C e D. Distribuição da relação sinal/ruído (Y) em dB NPS e frequências estudadas a emissão otoacústica por produtos de
distorção (X) em Hz, para os diferentes grupos de estudo (2, 3, 4 e 5, respectivamente).
DISCUSSÃO
Após realizar um experimento utilizando emissões otoacústicas por produto de distorção em cobaias albinas tratadas com gentamicina, com o objetivo de verificar a funcionalidade das células ciliadas externas, constatamos que os resultados obtidos corroboram com os estudos já realizados sobre este tema.
Não há dúvidas de que o monitoramento auditivo deve ser utilizado quando há exposição à medicação ototóxica por meio de procedimentos que apresentem elevada sensibilidade e especificidade. De acordo com a autora, para o monitoramento auditivo da população pediátrica, é recomendada a utilização das emissões otoacústicas as quais permitem constatar alterações auditivas antes que as frequências mais significativas para a percepção da fala sejam afetadas, o que pode prevenir dificuldades no desenvolvimento psicossocial e acadêmico dos indivíduos10.
As drogas ototóxicas podem potencialmente alterar a biomecânica coclear afetando a audição11. O teste de emissões otoacústicas é importante por avaliar a função das células ciliadas externas ao longo do órgão de Corti, possibilitando uma identificação tonotópica da lesão às células ciliadas cocleares. É útil para monitorar os estados de risco para a audição12.
De acordo com Amatuzzi et al.13, a incidência de perda auditiva sensorioneural em recém-nascidos tratados em Unidades de Terapia Intensiva (UTIs) é de 2% a 4%, cerca de 13 vezes maior que em recém-nascidos normais. Os fatores de risco para perda auditiva, como infecções congênitas, anoxia neonatal, hiperbilirrubinemia e uso de ototóxicos têm sido estudados por autores como Kountakis et al.14 e Hoog et al.15.
McCracken apud Matz16 avaliou o potencial ototóxico dos aminoglicosídeos estreptomicina, kanamicina e gentamicina em sete estudos prospectivos com mais de 1300 recém-nascidos. Os resultados indicaram que o risco dos recém-nascidos desenvolverem clinicamente uma significante alteração auditiva após 3 a 7 dias do uso da gentamicina é muito pequeno. O referido autor concluiu que os aminoglicosídeos têm sido utilizados com um grau elevado de segurança e eficácia em neonatos e crianças por mais de duas décadas, o que está de acordo com os achados nesse experimento.
No estudo de Agarwal et al.17, conduzido na Unidade de Terapia Intensiva Neonatal do Cook Country Children's Hospital IL, Chicago em 1999, foi comparada a farmacocinética da gentamicina 4 mg/Kg dose diária única com 2,5 mg/Kg a cada 12 horas em crianças com idade menor a 7 dias. Todas as crianças passaram por uma triagem auditiva usando o equipamento ALGO Natus. Os resultados foram distribuídos como Passou/Falhou em cada orelha. A sensibilidade dos resultados é de 98% e a especificidade de 96%. Todas as crianças passaram por um teste de acuidade auditiva antes da alta hospitalar. Neste estudo os autores concluíram que uma dose diária de 4 mg/Kg de Gentamicina apresentou um pico de concentração sérica significativamente maior, seguro e constante em todas as crianças comparada com o esquema de duas doses diárias de 2,5 mg/Kg de 12 em 12 horas.
A gentamicina ganha os tecidos da orelha interna após sua administração sistêmica em concentrações que não excedem sua concentração plasmática, portanto não sendo ativamente acumulada na orelha interna. Sua concentração é menor na endolinfa que na perilinfa. Em aproximadamente 12 horas a gentamicina administrada sistemicamente atinge os líquidos da cóclea, levando em torno de 24 dias para a redução de seus níveis significativamente18.
A polaridade positiva do potencial endococlear parece favorecer a entrada de substâncias catiônicas como a gentamicina na escala média da cóclea. A comunicação entre o sistema vascular e os fluídos cocleares ocorre dos leitos capilares do ligamento espiral e stria vascularis da parede lateral da cóclea. As escalas vestibulares e timpânica comunicam-se prontamente com os espaços do ligamento espiral, sendo que o espaço endolinfático pode ser atingido pela passagem indireta de drogas catiônicas das escalas vestibular e timpânica e diretamente pela stria vascularis19.
Conforme Martins20, em seus estudos, quanto à duração do tratamento da septicemia neonatal, é recomendado um período variável de sete a 14 dias para os esquemas terapêuticos clínicos. Com as doses propostas neste experimento, não encontramos alterações significativas na relação sinal/ruído das EOAPD, sem alteração significativa na amplitude das mesmas, o que está em concordância com o que é mostrado na literatura.
A literatura ainda é insuficiente para explicar completamente os efeitos ototóxicos de drogas como a gentamicina, principalmente em neonatos. Fatores de risco pré e perinatais associados ao uso de drogas ototóxicas, alterações do "clearance" renal e associação com múltiplas outras drogas aumentam o potencial de toxicidade da gentamicina.
A pesquisa otológica frequentemente exige o uso de modelos experimentais, principalmente cobaias e ratos devido à facilidade de manejo e similaridade com a orelha humana9. É importante ressaltar que o resultado deste estudo se reserva à amostra estudada (cobaias albinas), pois, conforme Salt21, a interpretação de estudos experimentais muitas vezes é complicada pela diferença entre as dimensões cocleares dos seres humanos e da maioria dos animais experimentais, o que deve ser considerado.
Uma diversidade de estudos experimentais tem sido proposta para encontrar terapias menos tóxicas e meios de prevenção eficientes na proteção da cóclea contra agressão por agentes químicos e físicos11. De maneira semelhante no presente experimento, foram considerados os aspectos de segurança na utilização de antibioticoterapia.
CONCLUSÃO
Neste experimento não foram observadas alterações no funcionamento das células ciliadas externas de cobaias albinas sob tratamento com gentamicina nas doses de 4 mg/Kg/dia e 2,5 mg/Kg/dia a cada 12 hs, por 10 e 14 dias.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Jacob LCB, Stumpf CC, Bitencourt R,F, Marques JM, Puppi C, Gonçalves PT. Avaliação audiológica em indivíduos com neoplasias expostos a agentes quimioterápicos. Fono Atual. 2005;31(8):12-25.
2. Borges CAB, Moreira LMO, Pena GM, Fernandes FR, Borges BCB, Otani BH. Triagem Auditiva Neonatal Universal. Arq Int Otorrinolaringol. 2006;10(1):28-34.
3. Zorzetto NL. Órgão vestíbulo-coclear. Marília: [s.n.], 1999.
4. Figueiredo MS. Conhecimentos essenciais para entender bem Emissões otoacústicas e Bera. 1ª ed. São José dos Campos: Pulso, 2003.
5. Bento RF. Tratado de otologia. SP: USP: Fundação Otorrinolaringologia: FAPESP, 1998.
6. Oliveira JAA, Bernal TMO. Prevenção contra aminoglicosídeos e otoproteção experimental. In: COSTA, S. S. et al. Otorrinolaringologia Princípios e Prática. 2ª ed. Porto Alegre: Artemed; 2006.
7. Chambers HF, Sande MA. Antimicrobial agents (continued): the aminoglicosídeos. In: Hardman JG, Gilman AG, Limbrid LE. (Ed.) Godman & Gilman's the pharmacological basis of therapeutics. 9th ed. New York: Macmilian publishing; 1995. p. 1003-1121.
8. Hyppolito MA, Oliveira JAA. Ototoxicidade, Otoproteção e Autodefesa das Células Ciliadas da Cóclea. Medicina (Ribeirão Preto) 2005;38(3/4):279-89.
9. Albuquerque AS. Estudo Comparativo da Estrutura da Orelha Interna de Ratos e Cobaias Através da Microscopia Eletrônica de Varredura. 2006. 59 p. Monografia - Ciências Agrárias e Veterinárias - UNESP. Universidade de São Paulo, Jaboticabal.
10. Jacob LCB, Aguiar FP, Tomiasi AA, Tschoeke SN, Bitencout RF. Monitoramento auditivo na ototoxicidade. Braz J Otorhinolaryngol. 2006;72(6):836-44.
11. Oliveira JAA, Canedo DM, Rossato M. Otoproteção das células ciliadas auditivas contra a ototoxicidade da amicacina. Rev Bras Otorrinolaringol. 2002;68:7-14.
12. Munhoz MSL, Caovilla HH, Silva MLG, Ganança MM. Otoemissões acústicas. In: Audiologia Clínica. Vol II. Cap. 9. Série Otoneurológica. São Paulo: Ateneu: 2000; p. 121-148.
13. Amatuzzi MG, Northrop C, Bento R, Eavey R. Bases Histopatológicas da Perda Auditiva em Recém-nascidos de Alto Risco. Arq Int Otorrinolaringol. 2005;9(3):213-9.
14. Kountakis SE, Skoulas I, Phillips D, Chang J. Risk Factors for hearing loss in neonates: A prospective study. Am J Otolaryngol. 2002;23:133-7.
15. Hoog M, Zanten BA, Hop WC, Overbosh EWeisglas-Kuperus N, Anker JN. Newborn hearing screening: Tobramycin and Vancomycin are not risk factors for hearing loss. J Pediatr. 2003;142:41-6.
16. Matz GJ. Aminoglycoside cochlear ototoxicity. Otolaryngol Clin North Am. 1993;26(5):705-12.
17. Agarwal G, Rastogi A, Pyati S, Wilks A, Pildes RS. Comparison of Once-Daily Versus Twice-Daily Gentamicin Dosing Regimens in Infants > 2500 g. J Perinatol. 2002;22:268-74.
18. Tran Ba Huy P, Manuel C, Meulemans A, Sterkers O, Wassef M, Amiel C. Ethacrynic acid facilitates gentamicin entry into endolymph of the rat. Hear Res. 1983;11:191-202.
19. Salt AN, Ohyama K & Thalmann R. Radial communication between the perymphatic scalae of the cochlea. I. Estimation by tracer perfusion. Hear Res. 1991;56:29-36.
20. Martins MAP, Starling SM, Borges SA. Utilização de gentamicina no tratamento de neonatos em uma maternidade pública da região metropolitana de Belo Horizonte, Minas Gerais (1999). Rev Bras Cienc Farm. 2005;41(1):109-17.
21. Salt AN. Pharmacokinetics of Drug Entry into Cochlear Fluids. Volta Rev. 2005;105(3):277-98.
1. Mestre em Distúrbios da Comunicação Humana pela UFSM, Fonoaudióloga.
2. Doutor em Medicina Veterinária Docente do Programa de Pós-graduação em Distúrbios da Comunicação Humana, Professor Doutor do Departamento de Morfologia da UFSM.
3. Doutor em Ciências Médicas pela USP, Doutor Otorrinolaringologista, Professor Doutor do Departamento de Oftalmologia, Otorrinolaringologia e CCP Divisão de Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, FMRPUSP.
4. Bióloga, Bióloga Auxiliar do Laboratório de Neurobiologia da Audição do Departamento de Oftalmologia, Otorrinolaringologia e CCP - Divisão de Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, FMRPUSP.
5. Técnica de Laboratório, Técnica do Laboratório de Neurobiologia da Audição do Departamento de Oftalmologia, Otorrinolaringologia e CCP - Divisão de Otorrinolaringologia da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, FMRPUSP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 15 de março de 2009. cod. 6314
Artigo aceito em 1 de setembro de 2009.