Ano: 2010 Vol. 76 Ed. 1 - Janeiro - Fevereiro - (13º)
Seção: Artigo Original
Páginas: 78 a 84
A frequência do HPV na mucosa oral normal de indivíduos sadios por meio da PCR
The frequency of human papillomavirus findings in normal oral mucosa of healthy people by PCR
Autor(es): David Esquenazi1, Ivo Bussoloti Filho2, Maria da Gloria da Costa Carvalho3, Fernando Souza de Barros4
Palavras-chave: boca, infecções por papilomavírus, mucosa bucal.
Keywords: mouth, papillomavirus infections, mouth mucosa
Resumo:
Os papilomavírus humanos (HPV) são DNA vírus pertencentes à família papilomaviridae com grupos de baixo e alto risco que infectam a pele e a mucosa podendo induzir a formação de tumores epiteliais benignos e malignos. Na mucosa oral, estes vírus têm sido associados a papilomas orais, hiperplasias epiteliais focais, leucoplasias e neoplasias orais. Objetivo: Estudar a frequência do HPV em mucosa oral de indivíduos normais. Material e Método: Trabalho prospectivo em coorte transversal. Participaram desse estudo 100 indivíduos voluntários, faixa etária de 20 a 31 anos, estudantes universitários, sem história, queixas ou lesões visíveis ao exame físico de cavidade oral e orofaringe. Foram submetidos a questionário com perguntas referentes à epidemiologia da infecção pelo HPV. Foi colhido material de mucosa oral por raspado com escova e analisado pelo PCR. Resultados: Os resultados mostraram ausência de HPV em todas as amostras. Conclusão: Parece ter havido participação do alto nível socioeconômico com alimentação rica em carotenoides e vitamina C, baixo consumo tabágico e etílico e comportamento heterossexual predominantemente monogâmico com uso regular de preservativos.
Abstract:
The human papillomavirus (HPV) is a DNA virus, which belongs to papillomaviridae family, being of low and high risk, which infect the skin and mucous membranes and can induce benign and malign tumor formation. In the oral mucosa they have been associated with oral papilloma, focal epithelial hyperplasia, leucoplakia and oral neoplasia. Aim: to study the frequency of HPV finding in oral mucosa of normal people. Materials and methods: Prospective study, cross-sectional cohort. One hundred volunteers, young adults, healthy, aged between 20 and 31 years, university students with no history, no complains, without oral or oropharyngeal lesions. They were submitted to a questionnaire with questions regarding HPV infection epidemiology. The samples were harvested by brushing and analyzed by PCR. Results: The results were negative for HPV in all samples. Conclusion: It seems we had high social and economical class individuals, with nutrition rich in carotenoyds and vitamin C, low smoking and alcohol consumption and heterosexual habits with predominant monogamy and regular use of condoms.
![]()
INTRODUÇÃO
Papilomavírus humano é um vírus que tem a pele e mucosa como principais sítios de infecção. Associa-se frequentemente com neoplasias benignas e malignas de cavidade oral, sendo, destas últimas, o carcinoma espinocelular o mais comum. O seu achado em epitélio de mucosa oral normal, divulgado na literatura, não permite inferências mais precisas quanto ao seu papel na carcinogênese, se agente etiológico principal, coadjuvante ou simples habitante do epitélio oral. Apesar do aprimoramento das técnicas de detecção do HPV nas lesões de mucosa oral, o seu envolvimento direto com os carcinomas orais ainda não foi devidamente comprovado1. Porém, considerando, a prevalência do HPV confirmada nas lesões associadas ao vírus2, sua participação na carcinogênese não pode ser descartada.
Os papilomavírus humanos (HPV) são vírus pertencentes ao gênero papilomaviridae, família papovaviridae e possuem uma dupla cadeia de DNA circular com aproximadamente oito mil pares de bases3. São vírus pequenos, não envelopados e o genoma possui seus genes codificados. O capsídeo é icosaédrico com um diâmetro de 50nµ a 60nµ, não revestido por um envelope lipídico, possui 72 capsômeros e determinantes antigênicas espéciesespecíficas na superfície externa e internamente. Encerram uma cadeia dupla de genoma de DNA dividida em proteínas precoces (E), tardias (L) e regiões reguladoras. A região precoce (E1-E8) codifica genes para replicação viral e transformação de células hospedeiras. As E6 e E7, proteínas codificadas para tipos de HPV oncogênicos tem demonstrado papel no desajuste do ciclo celular por meio da ligação e inativação dos genes supressores de tumores p53 e pRB. As regiões tardias codificam L1 e L2 que são proteínas do capsídeo. L1 é o maior capsídeo e é altamente conservado entre os tipos de HPV. A região de longo controle (LCR) é uma região reguladora que contém a origem da replicação viral que ocorre exclusivamente no núcleo da célula do hospedeiro1,4-7. De acordo com a composição desses segmentos, são identificados vários tipos de HPV com diferentes características patogênicas. As lesões orais benignas estão associadas ao HPV de baixo risco, tipos 2, 4, 6, 7, 11, 13 e 32, que apresentam baixo potencial de transformação maligna. As lesões orais malignas estão associadas aos HPV de alto risco tipos 16, 18, 31, 33, 35, 39, 42, 45, 51, 52, 56, 58, 59 e 66.8-11 Considerando a presença em mucosa oral normal sob forma de infecção latente, as fortes evidências do envolvimento do HPV em lesões benignas que podem evoluir de forma agressiva e na participação dos mecanismos carcinogênicos, o conhecimento limitado e por vezes contraditório de seu comportamento em indivíduos normais ou doentes e ainda, as evidências de aumento de risco de desenvolvimento de lesões malignas em portadores de HPV de alto risco, é de grande importância pesquisar o HPV na mucosa oral macroscopicamente normal de cavidade oral de indivíduos sãos.
O HPV é incapaz de penetrar através de epitélio escamoso intacto. Infecta, in-vivo, a camada celular basal da pele ou mucosa mitoticamente ativa, por meio de micro abrasões ou feridas no epitélio.12 Disseminase pelo contato direto célula-célula sem uma viremia clássica.13 Após a penetração na célula, o genoma viral é transportado para o núcleo onde é traduzido e transcrito. Os genomas virais são replicados nos seguintes estágios: primeiro, inicia-se a síntese de proteínas precoces (E1 e E2). Por ação das mesmas, replicam-se em cerca de dez a 200 cópias dos genomas por célula. No segundo estágio, durante o ciclo celular, ocorre replicação em células filhas em igual número. A expressão dos genes E6 e E7 conduz à transformação ou diferenciação celular. A célula passa a apresentar um ciclo de vida mais rápido e a dividir-se mais frequentemente, originando a formação de tumores benignos. Nesse estágio, o vírus promove sua proliferação no tecido, sem destruir a célula que o aloja. No terceiro estágio, denominado produtivo, as proteínas E1 e E2, em grande quantidade, passam a gerar milhares de cópias de ácido desoxirribonucleico viral (vDNA). Por outro lado há produção das proteínas tardias (L1 e L2) fundamentais na montagem de novos vírus. A libertação dos vírus ocorrerá nos queratinócitos localizados mais superficialmente.6,12
Em infecções por vírus de alto risco, as proteínas virais E6 e E7, chamadas oncoproteínas, integradas, são muito ativas e interferem profundamente no ciclo celular. Isso resulta em uma divisão celular mais rápida do que em infecções por vírus de baixo risco, aumentando a probabilidade de ocorrer integração do vDNA no genoma celular. Essa integração parece ser a causa da carcinogênese.4-6,10
O contato sexual é o principal modo de transmissão do HPV.14 Em relação à transmissão para a cavidade oral, parece existir uma via materno-fetal e após o período neonatal, outros mecanismos podem estar envolvidos, como a inoculação a partir de lesões cutâneas para outro indivíduo ou autoinoculação15,16. Alguns autores consideram que, em adultos, a principal via de contágio da infecção oral pelo HPV parece ser por meio da prática do sexo orogenital17, porém, a transmissão do trato genital para a mucosa oral ou vice-versa não está esclarecida. Outros consideram que a infecção genital pelo HPV é considerada a doença viral mais frequente na população ativa sexualmente.18 Em estudos sobre a ocorrência de concomitância da presença do HPV em área ginecológica com HPV oral, o vírus foi encontrado em biópsias de mucosa oral normal de mulheres com HPV genital, pelo método hibridização Southern Blot (SBH), 15,6% (33/212) e pela reação em cadeia pela polimerase (PCR) 23,1% (18/78) de positividade para o HPV oral (tipos 6, 11, 16 e 18).19 Foi observado ainda 0% de positividade para o HPV oral em raspados de mucosa oral normal de 30 portadoras de HPV ginecológico confirmado pelo PCR2 e em homens (n=27) com lesão anogenital e sem lesão oral, a frequência do HPV na mucosa oral normal também foi de 0%. Neste mesmo trabalho, mesmo em caso de material colhido de três indivíduos com lesões anogenitais e lesões orais concomitantes, apenas um apresentou HPV positivo.13
No que se refere às evidências de carcinogênese, por meio de hibridização in situ, foi encontrada a presença do HPV tipo 16 e 18 em carcinoma de células escamosas de cavidade oral.20 Em revisão bibliográfica sobre carcinogênese oral, autores encontraram evidências de que os HPV dos tipos 16 e 18 estão associados às proteínas precoces que se ligam, sequestram e degradam genes supressores de tumor sendo que E6 age sobre o p53, e E7 que age de forma similar com a pRB1. Observa-se ainda, que o vDNA integrado nas células tumorais após sua divisão sugere sua participação na oncogênese.21,22
Com relação à interferência de hábitos alimentares, menção relativa à ingestão regular de papaya, rico em carotenoides (luteina/zeaxantina e β-criptoxantina) e cítricos, ricos em vitamina C, indicou redução na persistência da infecção pelo HPV 23 e evidências de que o aumento nos níveis de ácido fólico é inversamente proporcional à infecção pelo HPV de alto risco.24
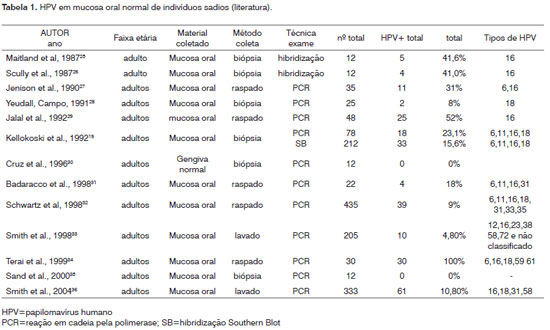
A frequência do HPV na mucosa oral normal pode variar bastante na literatura. Em nosso levantamento encontramos valores que variaram de 0% a 100%19,25-36, conforme a Tabela 1.
OBJETIVO
O objetivo deste trabalho visa aumentar o conhecimento da epidemiologia e da frequência de HPV em pessoas sadias para que, em estudos posteriores, seja possível determinar quais os fatores de proteção eventualmente existentes nestes indivíduos, quais mecanismos e de que modo tais vírus participam na gênese dos tumores para que medidas práticas profiláticas ou terapêuticas sejam tomadas em benefício de populações maiores.
CASUÍSTICA, MÉTODO E ASPECTOS ÉTICOS
O trabalho, prospectivo, em coorte transversal foi realizado durante o período de 17 de maio de 2006 a 11 de abril de 2007. Participaram desse estudo, 100 indivíduos adultos jovens, voluntários, faixa etária de 20 a 31 anos, estudantes universitários. Como critério de inclusão, somente indivíduos sem história, queixas ou lesões visíveis macroscopicamente ao exame físico de cavidade oral e orofaringe. Todos os indivíduos responderam a um questionário padronizado, não identificado, numerado de acordo com as amostras colhidas. Foram abordados fatores epidemiológicos relacionados com a transmissão e persistência da infecção pelo HPV, tais como idade, sexo, cor, tabagismo, etilismo, consumo de outras drogas, hábitos sexuais, número de parceiros, uso de preservativos sexuais e hábitos alimentares relativos ao consumo de alimentos ricos em vitamina C (cítricos) e carotenoides (papaia). Após exame físico cuidadoso de cavidade oral e orofaringe com iluminação direta com fotóforo, foi colhido material de mucosa oral, área mastigatória, por raspado com escova da marca Endobrush®. O material, mantido em embalagens estéreis, lacradas, numeradas e sob refrigeração, foi enviado ao Laboratório de Expressão Gênica do Instituto de Biofísica Carlos Chagas Filho e analisado pela Reação em Cadeia pela Polimerase (PCR). A PCR foi realizada utilizando primers GP5+/GP6+ e MY09/MY11 adicionados à amostra de DNA junto com a enzima, Taq polimerase, em meio à mistura de reação contendo os demais componentes necessários para síntese de DNA. A seguir, a mistura da reação, colocada no termociclador e submetida a ciclos repetidos de amplificação a temperaturas diferentes obedecendo às seguintes fases da reação: desnaturação a 94°C, hibridização a 60°C e síntese a 72°C. O produto final amplificado foi analisado por eletroforese em gel de poliacrilamida. Todas as reações incluíram controle negativo (contendo todos os componentes, exceto o DNA) e controle positivo (onde foi amplificado um gene padrão conhecido).
O trabalho foi submetido previamente à apreciação e aprovação do Comitê de Ética em Pesquisa (CEP) do Hospital Universitário Clementino Fraga Filho e cadastrado na Comissão de Investigação Científica (CIC) com as seguintes numerações: CEP:090/06 e CIC:062/06.
RESULTADOS
Resultado dos questionários - caracterização da amostra:
Dentre os 100 indivíduos que participaram da pesquisa, 40 eram do sexo masculino e 60 do sexo feminino, sendo 86 autoalegados da raça branca, nove pardos e cinco negros com idade entre 20 e 31 anos com a média de 22,65 anos. Com relação ao consumo de fumo, 97/100 não consomem e 3/100 consomem. Referente ao consumo de álcool, 31/100 não consomem, 56/100 o fazem uma vez por semana e 3/100 2 vezes por semana 6/100 três vezes por semana e 4/100 não responderam. Quanto aos hábitos sexuais, 100/100 alegaram ser heterossexuais, 85/100 com apenas um parceiro e 13/100 com mais de um parceiro sendo que 69/100 praticam o sexo orogenital, 22/100 não praticam e 9/100 não responderam. 46/100 sempre usam preservativos sexuais, 26/100 usam às vezes, 20/100 nunca usam e oito não responderam. Em hábitos alimentares, quanto ao consumo de cítricos (vit C) 47/100 consomem uma vez por semana, 26/100 duas vezes por semana, 15/100 três vezes por semana e 2/100 não responderam. Quanto ao consumo de mamão (carotenoides), 29/100 consomem uma vez por semana, 5/100 duas vezes por semana, 5/100 três vezes por semana, 53/100 não consomem e 08/100 não responderam.
Resultados da PCR
Os resultados obtidos nos questionários com a caracterização da amostra estão demonstrados na Tabela 2. Os resultados da PCR foram negativos em 100% dos indivíduos.
DISCUSSÃO
Fatores socioeconômicos: Infecções anogenitais pelo HPV parecem ter relação direta com fatores socioeconômicos.14,35,36 Os autores relatam que as adolescentes virgens usualmente não apresentam HPV anogenital detectável e, por outro lado, aquelas com vida sexual iniciada precocemente, assim como a prostituição, são fatores predisponentes de doenças sexualmente transmissíveis, incluindo aí, o HPV. Baixos níveis de infecção pelo HPV parecem estar relacionados com os altos níveis socioeconômicos da população europeia.37 Em nossa amostra, os alunos, estudantes universitários com bom nível socioeconômico apresentaram resultados negativos para a PCR.
Hábitos nutricionais: Menção relativa à ingestão regular de carotenoides (luteina/zeaxantina e β-criptoxantina) e vitamina C, indicou redução na persistência da infecção pelo HPV23 e evidências de que o aumento nos níveis de ácido fólico é inversamente proporcional à infecção pelo HPV de alto risco24. Em nossa amostra, o consumo de nutrientes (vitamina C e carotenoides) apareceu com frequência considerável, sendo que 88% (88/100) alegaram consumir cítricos (fontes de vitamina C), entre uma e três vezes por semana e 39% (39/100) alegaram consumir papaia (fonte de carotenoides) entre uma e três vezes por semana. Fatores esses que podem ter contribuído na redução da frequência do HPV na amostra.
Hábitos sexuais: Em nossa amostra, nas questões relativas aos hábitos sexuais, todos alegaram ser heterossexuais (100%, 100/100). Considerando que a multiplicidade de parceiros é usualmente maior em homossexuais, poderíamos supor que a heterossexualidade tivesse contribuído para a redução da frequência das taxas do vírus em nossa amostra, porém, não encontramos estudos específicos sobre a frequência do HPV em homossexuais. Nesta, os indivíduos apresentaram hábitos predominantemente monogâmicos em seus resultados onde 6% (6/100) alegaram menos de um parceiro por semana, 85% (85/100) apenas um parceiro por semana, 5% (5/100) dois a três parceiros por semana, 2% (2/100) mais que três parceiros por semana e 2%(2/100) não informaram. Esses dados são reforçados com os resultados onde 92% (92/100) dos indivíduos alegaram contato com apenas um parceiro por semana, no que se refere ao beijo na boca. Sabemos do hábito caracterizado por multiplicidade de contatos em um mesmo dia, bastante comum atualmente entre os jovens na nossa sociedade (daí a inclusão dessa pergunta no questionário). Além disso, temos que considerar a importância da frequência do uso alegado de preservativos sexuais, sempre em 46% (46/100) e às vezes 26% (26/100). Os poucos indivíduos, 3% (3/100), que admitiram um contato sexual com três parceiros por semana e não utilizando, 1% (1/100), ou utilizando preservativos às vezes, 2% (2/100), também apresentaram seus resultados negativos para o HPV. As características predominantemente monogâmicas e de uso de preservativos pelos indivíduos componentes da amostra podem ter contribuído para a ausência do HPV em seus testes. Apesar do hábito frequente do sexo orogenital, em 69% (69/100) considerada por alguns a principal via de contágio do HPV oral 17, outros autores concluem não haver uma indicação clara nem comprovada, de que a prática de sexo desta forma resulte em maior predisposição à infecção oral pelo HPV 7,13.
Influência do fumo e do álcool: Diferente do observado em câncer genital 38 a influência do fumo no desenvolvimento do HPV de alto risco em cânceres de cavidade oral e orofaringe apresenta maior controvérsia, ora havendo evidências de sua não interferência39, ora do aumento40 e ora da redução da mesma41-43. Apesar de relatos indicarem que o fumo e o álcool podem ser fatores de risco para os carcinomas orais e faríngeos, o aumento da incidência do CEC em populações onde o consumo tabágico e alcoólico reduziram em algum período, indica probabilidade de existência de outros fatores de risco43. Reforçando essa ideia, foi observado que em pacientes do sexo masculino com CEC de cavidade oral e orofaringe, quanto maior o consumo tabágico, menor os índices de infecção pelo HPV44.
Parece haver um efeito preventivo do tabaco na infecção por HPV na cavidade oral e orofaríngea, provavelmente resultante do aumento da queratinização nas superfícies mucosas, o que as tornaria mais resistentes a traumatismos pequenos e menos susceptíveis à infecção das células da camada basal pelo HPV6.
Com relação ao hábito de fumar em nossa amostra, apenas 3% (3/100) se declararam consumidores, o que, certamente, não influiu nos resultados.
Quanto ao quanto ao consumo de álcool, 32% (32/100) alegaram não consumir, 55% (55/100) alegaram ser consumidores esporádicos (uma vez por semana), 3% (3/100) alegaram consumir duas vezes por semana, 6% (6/100) alegaram consumir três vezes por semana e 4% (4/100) não responderam. Vê-se, portanto, que a incidência do consumo alcoólico também foi reduzida e pouco expressiva. Em casos de grandes consumidores de álcool, parece haver uma ação sinérgica do uso com a infecção pelo HPV de alto risco 39, o que não se aplica na amostra utilizada neste trabalho.
Observamos, portanto, que há contradições no comportamento da infecção pelo HPV na mucosa oral, no que se refere à interferência do consumo de fumo e de álcool, que ainda não estão esclarecidas.
Persistência da infecção pelo HPV e aspectos imunológicos: O contágio pelo HPV acontece no início da vida sexual, na adolescência, ou por volta dos 20 anos. Na maioria das vezes, esta infecção deverá ser transitória, sem evidência clínica da doença que poderá ser suprimida ou até curada, salvo se houver uma incompetência imunológica. Algumas dessas infecções persistentes, com tipos virais de alto risco, poderão progredir para câncer genital. O diagnóstico dessa infecção será feito em sua maior parte entre os 25 e 29 anos45. Há evidências de que a infecção pelo HPV é um fenômeno transitório ou intermitente, com uma duração média de 12 meses6. Parece haver diferença na atividade biológica do vírus entre homens e mulheres, sendo que os homens têm maior tendência flutuante da infecção com períodos de remissão espontânea que pode ser decorrente da situação imunológica, fatores locais e das diferentes formas de organização do epitélio genital em ambos os sexos13. Nossa casuística estudou indivíduos que, em sua maioria, compunha uma faixa etária relativamente estreita, sendo a média de idade de nossa amostra de 22,65 anos, de ambos os sexos (60 mulheres e 40 homens), podendo a colheita do material ter coincidido em período de cura.
Influência das limitações dos métodos de diagnóstico: Há ainda, variação nas taxas de detecção, dependendo do método de colheita do material da mucosa, se com raspado, lavado ou biópsia e do método de realização da PCR46. Apesar da utilização do raspado, mantendo o material fresco sob refrigeração, que apresentaria maior positividade na detecção do DNA do HPV47,48, este método extrai somente células superficiais do epitélio que se infectam na vigência de infecção subclínica e clínica. Não há, portanto, remoção de células da camada basal e suprabasal onde o vírus se aloja nas infecções latentes29. Foram utilizados os primers MY09 e MY11 e GP5+/GP6+ na realização deste trabalho, os mais rotineiramente utilizados em pesquisa de DNA do HPV e que detectam um painel de diferentes tipos do vírus, em uma única reação7,49. Há relato de diferença nos resultados obtidos com diferentes primers para uma mesma amostra, significando que diferentes primers amplificam diferentes genótipos do HPV. A detecção das infecções mistas só poderia ser realizada com uso de vários pares de primers na realização da PCR50. Considerando essa limitação, a não utilização de vários pares de primers em nosso trabalho seria uma possibilidade a mais, na origem de resultados falso-negativos. A grande variação nas taxas de frequências observadas nos diferentes trabalhos pode ser parcialmente explicada pela diferença de sensibilidade nos métodos de detecção do HPV. Resultados bastante diferentes foram encontrados em biópsias de pacientes normais e com lesão, com diferentes métodos (SB e PCR)19. Aí, porém, não foi utilizada a mesma amostra para testar ambos os métodos, o que daria elementos comparativos mais consistentes. Observação semelhante, embora utilizando casuística pequena, encontrou positividade para o HPV por meio do PCR em três pacientes, sendo que pelo SB, os exames dos mesmos pacientes foram negativos17. Isso reforça a assertiva inicial de que os resultados dependerão da sensibilidade de cada teste.
A existência de fatores locais, como o fato de que de que a saliva possui componentes que poderiam ter algum efeito protetor como a presença de lisozimas, lactoferrina, IgA e citocinas13 poderia explicar a baixa transmissibilidade pela autoinoculação e pelo sexo orogenital7.
Apesar da frequência do vírus variar de 0% a 100% em indivíduos normais sugerir a possibilidade de a mucosa oral atuar como reservatório19,34, o HPV pode ser considerado como um fator de risco para o câncer oral. Distúrbios imunológicos determinariam a direção da influência da infecção pelo HPV para a latência, a cura ou a carcinogênese. O fato dos HPV dos tipos 16 e 18 estarem associados às proteínas precoces (E6 e E7) que inibem os genes supressores de tumor (p53 e a pRB)1 induz ao aumento da velocidade de mitose o que aumentaria a possibilidade de integração do DNA viral ao celular. A integração do DNA do HPV encontrado no genoma do CEC aponta para a tese de que o vírus seria um importante fator etiológico na histogênese de alguns dos carcinomas da região de cabeça e pescoço21,22.
CONCLUSÃO
Em nossa amostra, não foi encontrado o HPV com o método utilizado. A grande variação (de 0 a 100%) da frequência do HPV na mucosa oral normal de indivíduos sadios observada na literatura pode indicar que os métodos utilizados para sua detecção necessitam reavaliação. Acreditamos que outros estudos devam ser realizados buscando desenvolver novos métodos que possam trazer elementos para esclarecer de que modo o HPV se comporta na infecção da mucosa oral.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Oliveira MC, Soares RC, Pinto LP, Costa ALL. HPV e carcinogênese oral: revisão bibliográfica. Rev Bras Otorrinolaringol. 2003;69:553-9.
2. Castro TMPPG, Bussoloti Filho I, Prevalência do papilomavírus humano (HPV) na cavidade oral e na orofaringe. Braz J Otorhinolaryngol. 2006;72:272-82.
3. Collier B, Goodbar-Larson L, Sokolowski, Schwartz S. Translationl Inhibition in Vitro of Human Papillomavirus Type 16 L2 mRNA Mediated trough Interaction with Heterogenous Ribonucleoprotein K and Poly (rC)- binding Proteins 1 and 2. J Biol Chem. 1998;273:22648-56.
4. Baker TS, Newcomb WW, Olson NH, Cowsert LM, Olson C, BrownJC. Structures of bovine and human papillomaviruses. Biophys J. 1991;60:1445-56.
5. Swygart C. Human papillomavirus: disease and laboratory diagnosis. Br J Biomed Sci. 1997;54:299-303.
6. Sinogas C, Rodrigues A, Reis D. Papilomavírus Humano Biologia e Epidemiologia. Universidade de Évora, Departamento de Biologia. http://evunix.uevora.pt/~sinogas/TRABALHOS/2004/papiloma.htm
7. Castro TMPPG. A frequência de papilomavírus humano (HPV) na mucosa oral de mulheres portadoras de HPV genital confirmado pela PCR. Tese (Doutorado). São Paulo. Faculdade de Ciências Médicas da Santa Casa de São Paulo; 2007.
8. Garlick JÁ, Taichman LB. Human papillomavirus infection of the oral mucosa. Am J Dermatopathol. 1991;13:386-95.
9. Summersgill KF, Smith EM, Levy BT, Allen JM, Haugen TH, Turek LP. Human papillomavirus in the oral cavities of children and adolescents. Oral Surg Oral Med Oral Pathol. 2001;91:62-9.
10. Hou SY, Wu SY, Chieng C. Transcriptional activity among high and low risk human papillomavirus E2 proteins correlates with DNA binding. J Biol Chem. 2002;277:45619-29.
11. Tinoco JA, Silva AF, Oliveira CAB, Rapoport A, Fava AS, Souza RP. Correlação da infecção viral pelo papilomavírus humano com as lesões papilomatosas e o carcinoma epidermoide na boca e orofaringe. Rev Assoc Med Bras. 2004;50:252-6.
12. Ozbun MA. Infectious human papillomavirus type 31b: purification and infection of an immortalized human keratinocyte cell line. J Gen Virol. 2002:2753-63.
13. Xavier SD, 2007, Frequência de aparecimento do papilomavírus humano (HPV) na mucosa oral de homens com HPV genital confirmado por biologia molecular. Tese (Mestrado). São Paulo; 2007.
14. Zur Hausen, de Villiers EM. Human Papillomaviruses. Annu Rev Microbiol. 1994;48:427-47.
15. Gutman LT, Herman-Giddens ME, Phelps WC. Transmission of human genital papillomavirus disease: comparison of data from adults and children. Pediatrics. 1993;91:31-8.
16. Cason J, Kaye JN, Jewers RJ, Kambo PK, Bible JM, Kell B et al. Perinatal infection and persistence of human papillomavirus types 16 and 18 in infants. J Med Virol. 1995;47:209-18.
17. Tominaga S, Fukushima K, Nishizaki K, Watanabe S, Masuda Y, Ogura H. Presence of human papillomavirus type 6f in tonsilar condiloma acuminatum and clinically normal tonsillar mucosa. Jpn J Clin Oncol. 1996;26:393-6.
18. Okada MMK, Gonçalves MAG, Giraldo PC. Epidemiologia e patogênese do papilomavírus humano (HPV).In: 1º Consenso Brasileiro de HPV 2000. 1ª edição: São Paulo; Editora BG. 2000:01-6.
19. Kellokoski JK, Sirjänen SM, Chang F, Yliskoski M, Syrjänen KJ. Southern blot hybridization and PCR in detection of oral human papillomavirus (HPV) infections in women with genital HPV infections. J Oral Pathol Med. 1992;21:459-64
20. Soares CP, Malavasi I, Reis RI, Neves, KA, Zuanon JAS, Benatti Neto C, Spolidório LC, Oliveira MRB. Presença de papilomavírus humano em lesões malignas de mucosa oral. Rev Soc Bras de Med Trop. 2002;35:439-44.
21. Dekmezian RH, Batsakis JG, Goepfert H. In situ hibridization of papillomavirus DNA in head and neck squamous cell carcinomas. Arch Otolaryngol Head Neck Surg. 1987;113:819-21.
22. Alvarez IA, Lazo PS, Gonzalez SR, Tapia PR, Batalla FN, Nieto CS. Using polymerase chain reaction to human papillomavirus in oral and pharyngolaryngeal carcinomas. Am J Otolaryngol. 1997;18:375-81.
23. Giuliano AR, Siegel EM, Roe DJ, Ferreira S, Baggio ML, Galan L. Dietary Intake and Risk of Persistence Human Papillomavirus (HPV) Infection: The Ludwig-McGill HPV Natural History Study. J Infect Dis. 2003;188:1508-16.
24. Piyathilake CJ, Henao OL, Macaluso M, Cornwell PE, Meleth S, Heimburger DC et al. Folate is associated with the natural history of high-risk human papillomaviruses. Cancer Res. 2004;64:8788-93.
25. Maitland NJ, Cox MF, Lynas C, Prime SS, Meanwell CA, Scully C. Detection of human papillomavirus DNA in biopsies of human oral tissue. Br J Cancer. 1987;56:245-50.
26. Scully C, Maitland NJ, Cox MF, Prime SS. Human papillomavirus DNA and oral mucosa. Lancet. 1987:336
27. Jenison AS, Xiu-ping Y, Valentine J, Koutsky LA, Christiansen AE, Beckman AM et al. Evidence of prevalent genital-type human papillomavirus infections in adults and children. J Infect Dis. 1990;162:60-9.
28. Yeudall WA, Campo MS. Human papillomavirus DNA in biopsies of oral tissues. J Gen Virol. 1991;72:173-6.
29. Jalal H, Sandres CM, Prime SS, Scully C, Maitland NJ. Detection of human papilloma vírus type 16 DNA in oral squames from normal young adults. J Oral Pathol Med. 1992;21:465-70.
30. Cruz IBF, Snijders PJF, Steenbergen RDM, Meijer CJLM, Snow GB, Walboomers JMM. Age dependence of human papilloma vírus DNA presence in oral squamous cell carcinomas. Oral Oncol Eur J Cancer. 1996;32B:55-62.
31. Badaracco G, Venuci A, Leonardo AD, Scambia G, Mozzetti S, Panici PB et al. Concurrent HPV infection in oral and genital mucosa. J Oral Pathol Med. 1998;27:130-4.
32. Schwartz SM, Daling JR, Doody DR, Wipf GC, Carter JJ, Madeleine MM, et al. Oral Cancer Risk in Relation to Sexual History and Evidence of Human Papillomavirus Infection. J Natl Cancer Inst. 1998;90:1626:36.
33. Smith EM, Hoffman HT, Summersgill KS, Kirchner HL, Turek L, Haugen TH. Human papillomavirus and risk of oral cancer. Laryngoscope. 1998;108:1098-103.
34. Terai M, Hashimoto K, Yoda K, Sata T. High prevalence of human papillomaviruses in the normal oral cavity of adults. Oral Microbiol Immunol. 1999;14:201-5.
35. Creatsas G. Sequelae of premature sexual life. J R Soc Med. 1995;88:369-71.
36. Cañadas MP, Bosh FX, Junqueira ML, Ejarque M, Font R, Ordoñez E, Sanjosé S. Concordance of prevalence of human papillomavirus DNA in anogenital and oral infections in a high risk population. J Clin Microbiol. 2004:1330-2.
37. Centurioni MG, Puppo A, Merlo DF, Pasciucco G, Cusimano ER, Sirito R et al. Prevalence of human papillomavirus cervical infection in an Italian asymptomatic population. BMC Infect Dis. 2005;5:77.
38. Minkoff H, Feldman JG, Strickler HD, Watts DH, Bacon MC, Levine A, et al. Relationship between Smoking and Human Papillomavirus Infections in HIV-Infected and -Uninfected Women. J Infect Dis. 2004;189:1821-8.
39. Smith EM, Ritchie JM, Summersgill KF, Hoffman HT, Wang DH, Haugen TH et al. Human Papillomavirus in Oral Exfoliated Cells and Risk of Head and Neck Cancer. J Natl Cancer Inst. 2004;96:449-55.
40. Gárcia-Milián G, Hernández H, Panadé L, Rodríguez C, González N, Valenzuela C et al. Detection and typing of human papillomavirus DNA in benign and malignant tumors of laryngeal epithelium. Acta Otolaryngol (Stockh). 1998;118:754-8.
41. Herrero R, Castellsagué X, Pawlita M, Lissowska J, Kee F, Balaram P. Human Papillomavirus and Oral Cancer: The International Agency for Research on Cancer Multicenter Study. J Natl Cancer Inst. 2003;95:1772-83.
42. Dahlstrom KR, Adler-Storthz K, Etzel CJ, Liu Z, Dillon L, El-Naggar AK, Spits MR, et al. Human Papillomavirus Type 16 Infection and Squamous Cell Carcinoma of the Head and Neck in Never-Smokers. Clin Cancer Res. 2003;9:2620-6.
43. Syrjänen S. HPV infections and tonsillar carcinoma. J Clin Pathol. 2004;57:449-55.
44. Ritchie JM, Smith EM, Summersgill KF, Hoffman HT, Wang D, Klussmann JP et al. Human papillomavirus infection as a prognostic factor in carcinomas of the oral cavity and oropharynx. Int J Cancer. 2003;104:336-44.
45. Russomano F, 2000. Presença de HPV nos fluidos em geral. Available from: URL: http://www.cervical.com.br.
46. Ha PK, Califano JA. The role of human papillomavirus in oral carcinogenesis. Crit Rev Oral Biol Med. 2004;15:188-96.
47. Hoffmann M, Khan T, Mahnke CG, Goeroegh T, Lippert BM, Werner JA. Prevalence of human papillomavirus in squamous cell carcinoma of the head and neck determined by polymerase chain reaction and southern blot hybridization: proposal for optimized diagnostic requirements. Acta Otolaryngol (Stockh). 1998;118:138-44.
48. Melo A, Roa I, Montenegro S, Capurro I, Roa JC. Estúdio comparativo de detección del vírus papiloma humano (VPH) en muestras citológicas y biopsias de cuello uterino. Rev Med Chile. 2005;133:639-44.
49. Ribeiro KMX. Estudo da ocorrência do papilomavírus humano em tonsilas palatinas na população pediátrica. Tese (Mestrado) São Paulo; 2002.
50. Kado S, Kawamata Y, Shino Y, Kasai T, Kubota K, Iwasaki H et al. Detection of human papillomavirus in cervical neoplasias using multiple sets of generic polymerase chain reaction primers. Gynecol Oncol. 2001;81:47-52.
1. Mestrado em Medicina (Otorrinolaringologia) pela Universidade Federal do Rio de Janeiro Doutorado em Otorrinolaringologia pela faculdade de Ciências Médicas da Santa Casa de São Paulo. Professor Assistente da Faculdade de Medicina da Universidade Federal do Rio de Janeiro.
2. Doutorado em Medicina (Otorrinolaringologia) pela Universidade de São Paulo. Professor Adjunto da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
3. Pós-Doutorado pelo National Institutes of Health (Estados Unidos). Chefe de Laboratório - Instituto de Biofísica CCF do Instituto de Biofísica Carlos Chagas Filho, UFRJ, Brasil.
4. Aluno do 8º período da graduação da Faculdade de Medicina da UFRJ. Aluno do Programa de Iniciação Científica (PINC) da FM-UFRJ.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 19/2/2009. cod. 6271.
Artigo aceito em 15/8/2009 16:08:37.