Ano: 2009 Vol. 75 Ed. 6 - Novembro - Dezembro - (16º)
Seção: Artigo Original
Páginas: 866 a 871
Efeito do óxido nítrico no transporte mucociliar
Effects of nitric oxide in mucociliary transport
Autor(es): Eleonora Elisia Abra Blanco1, Marli Cardoso Martins Pinge2, Otavio André Andrade Neto3, Nathália Gardin Pessoa4
Palavras-chave: depuração mucociliar, inibidores enzimáticos, mucosa respiratória.
Keywords: mucociliary clearance, enzyme inhibitors, respiratory mucosa.
Resumo:
As vias aéreas, constituídas por epitélio ciliado e secretor de muco, promovem ao trato respiratório mecanismo de defesa que livra esta superfície das partículas inaladas durante a respiração. É de fundamental importância o entendimento da fisiologia e dos mecanismos envolvidos com a atividade mucociliar. A literatura sugere que o NO, em especial o produzido pela expressão da iNOS, mantém a função mucociliar e a defesa imune da cavidade nasal. Objetivo: Avaliar o envolvimento do NO e das vias enzimáticas da produção do NO no transporte mucociliar, utilizando inibidores da NO sintase constitutiva e indutiva, L-NAME e aminoguanidina, respectivamente. Materiais e Métodos: Preparações de palatos de rã foram imersos em soluções de ringer (controle), L-NAME ou aminoguanidina. Os palatos foram imersos nestas soluções por quatro períodos de 15 minutos. Medidas da velocidade do transporte mucociliar foram feitas antes e após cada exposição. Resultados: Palatos controles mantiveram estável a velocidade do transporte. O L-NAME aumentou, enquanto a aminoguanidina reduziu a velocidade de transporte do muco. Conclusão: O bloqueio inespecífico da cNOS com L-NAME e bloqueio relativamente específico da iNOS com aminoguanidina permitiu propor que dependendo da via o NO pode aumentar ou diminuir o transporte mucociliar em palatos de rã.
Abstract:
The airways are made up of ciliated epithelium which secretes mucous, protecting the respiratory tract from particles inhaled during breathing. Its is paramount to understand the physiology and the mechanisms involved in mucociliary activity. Literature suggests that Nitric oxide (NO), especially the one produced by iNOS expression, maintains the mucociliary function and the immune defense of the nasal cavity. Aim: to assess NO participation and the enzymatic pathways in the production of NO and mucociliary transport, using constructive and inductive NO synthetase inhibitors, L-NAME and aminoguanidine, respectively. Materials and methods: frog palates were prepared and immerse in ringer (control), L-NAME or aminoguanidine solutions. The palates were immerse in these solutions for four periods of 15 minutes. Mucociliary transport measures were carried out before and after each exposure. Results: control palates maintained stable their transportation speed. L-NAME increased, while aminoguanidine reduced mucous transportation velocity. Conclusion: unspecific cNOS block with L-NAME and relatively specific iNOS block with aminoguanidine results leads us to propose that depending on the pathway, the NO can increase or reduce mucociliary transport in frog palates.
![]()
INTRODUÇÃO
O sistema respiratório é a região interna do corpo que em primeiro lugar entra em contato com o meio externo. As vias aéreas representam a primeira interface entre o meio interno e os microrganismos, alérgenos ou partículas inaladas. Durante a respiração, variedades de partículas e de substâncias químicas são depositadas no aparelho respiratório.
Para a manutenção da homeostase deste delicado sistema, o trato respiratório possui um sofisticado mecanismo de defesa, o aparelho mucociliar1. A mucosa das vias aéreas, desde a cavidade nasal até os bronquíolos, é constituída por um epitélio pseudo-estratificado e ciliado entremeado pelas glândulas submucosas e células caliciformes, que são responsáveis pela produção de muco.
O transporte mucociliar é um importante mecanismo de defesa da mucosa respiratória, livrando esta superfície das partículas inaladas. A força propulsora deste complexo sistema é a atividade ciliar do epitélio respiratório, comumente quantificada pela frequência do batimento ciliar2 ou pela medida da velocidade do transporte mucociliar3.
A eficiência do transporte mucociliar depende principalmente dos seguintes fatores: espessura da camada do muco e composição e propriedades reológicas do muco; cílios em células com estrutura perfeitamente preservada a fim de desempenhar com eficiência a sua movimentação; coordenação entre os cílios adjacentes para que se desenvolva uma onda de batimento capaz de impulsionar o muco4,5. A falência do sistema ciliado pode desencadear múltiplas implicações: facilitação de colonização por bactérias, aumentando o risco de infecções respiratórias; aumento do tempo de contato entre agentes nocivos e o epitélio respiratório; estase de muco que pode acarretar distúrbios na ventilação, com aumento da resistência do fluxo aéreo6. Assim, a disfunção no transporte mucociliar pode deteriorar a qualidade de vida dos indivíduos. Desta forma é crucial o entendimento da fisiologia do aparelho mucociliar e como estes componentes afetam o clearance das secreções respiratórias e o conhecimento dos mecanismos de controle e de ação de substâncias endógenas sobre a atividade mucociliar.
Na cavidade nasal, as glândulas seromucosas estão localizadas na submucosa. No seio paranasal prevalecem as células caliciformes7. O muco nasal é constituído pela mistura da secreção das células caliciformes, das glândulas da submucosa, das glândulas lacrimais e água. Em condições patológicas ocorre alteração da composição do muco, afetando diretamente ou indiretamente a função mucociliar8.
O mais importante mecanismo de controle da secreção nasal é autonômico e o estímulo parassimpático aumenta o volume da secreção, mas, sugere-se a existência de outros mecanismos que não são mediados pela acetilcolina8.
Os pulmões destacam-se como o principal local de produção do óxido nítrico (NO) em toda a circulação sanguínea9. O NO, produzido nas vias aéreas a partir da L-Arginina (L-Arg), participa nos eventos fisiológicos e fisiopatológicos tais como a vasodilatação, broncodilatação, neurotransmissão e bacteriostase10. O NO é gerado pela ação da NO sintase (NOS). Existem três isoformas distintas de NO sintase (NOS): NOS endotelial (eNOS), NOS neuronal (nNOS) as quais são expressas constitutivamente e denominadas de cNOS, e uma via indutiva (iNOS). As três isoformas de NOS estão presentes no trato respiratório e contribuem para a produção do NO11. Em células epiteliais das vias aéreas de indivíduos saudáveis foi demonstrado que a produção de NO ocorre devido a uma contínua expressão da iNOS. Esta enzima parece desenvolver papel crucial na defesa das vias aéreas contra infecções12.
A administração tópica de NG-nitro-L-arginina-metilester (L-NAME), um inibidor da cNOS, reduziu a concentração de NO nasal, sendo que a administração tópica de nitroprussiato de sódio, um doador de NO, promoveu aumento do NO nasal e reduziu o tempo de transporte de sacarina nasal, indicador da função mucociliar. Além disso, o L-NAME prolongou este tempo de transporte. Esta observação sugeriu que a alteração artificial da produção do NO nasal pode afetar a função mucociliar13.
Uma reduzida concentração de NO nasal foi observada na rinossinusite aguda e crônica, fibrose cística, disfunção ciliar primária, tosse crônica e na exposição ao tabaco e álcool, condições caracterizadas por alterações histológicas da mucosa ciliar das vias aéreas superiores14. A baixa produção de NO, pela iNOS, nos seios maxilares de indivíduos com rinossinusite e septicemia, foi associada com o prejuízo no mecanismo de defesa e com o aumento do risco de infecções secundárias15.
Por outro lado, como foi proposto que a produção de NO pela ação da iNOS está elevada no epitélio nasal de pacientes com rinite alérgica, um estudo realizado com acetilcolina e com o L-NAME permitiu concluir que a atividade ciliar basal nasal é dependente da produção endógena de NO, mas que a estimulação ciliar promovida pelo estímulo colinérgico16 ou pelo estímulo mecânico17 pode ser independente da produção endógena de NO. Para ambos os estímulos, foram observados que a ação conjunta do NO no batimento ciliar, melhora a defesa local contra alérgenos, em pacientes com rinite alérgica.
Os cílios se movem gastando energia armazenada sob a forma de ATP, que é estocado nas mitocôndrias, por isso, os cílios continuam se movimentando mesmo que tenha sido cortado o suprimento sanguíneo, desde que as condições do meio sejam favoráveis, até que todo o ATP seja consumido. Um sistema conveniente para estudar o transporte mucociliar é o palato de rã, que é ciliado e secretor de muco similar ao observado nas vias aéreas do homem1,3.
O objetivo desta pesquisa foi de avaliar o papel do NO na regulação da transportabilidade ciliar, em condições normais. Para este estudo foram observados os efeitos dos inibidores das enzimas das vias constitutiva e indutiva da produção do NO, na transportabilidade mucociliar em palatos de rã e, assim, avaliar tanto a participação do NO neste mecanismo, bem como caracterizar a via de produção do NO envolvida com a transportabilidade mucociliar.
MATERIAIS E MÉTODOS
Foram utilizadas para este experimento oitenta e cinco rãs, de ambos os sexos, adultas e da espécie Rana catesbiana, com peso corporal compreendido entre 90 e 150 g, adquiridas de ranário comercial. As rãs eram mantidas em caixas apropriadas e em ambiente aclimatizado em 23ºC±2.0. Para a obtenção dos palatos, os animais foram colocados em banho de água gelada até perderem a sensibilidade ao estímulo mecânico e, logo após, sacrificados por decapitação, sendo em seguida a mandíbula desarticulada e a porção superior (palato) separada. Os palatos eram mantidos a 4ºC em uma câmara fechada, por 72 horas, para que o muco fosse depletado. Vinte minutos antes dos experimentos os palatos eram retirados do refrigerador e colocados em uma câmara de acrílico acoplada com um nebulizador ultrassônico, que mantinha o interior da câmara com 100% de umidade, saturada com solução de Ringer modificada para rãs, preparada com uma parte de Ringer e uma parte de água destilada (RingerR); neste período de tempo a temperatura dos palatos tornava-se igual a do ambiente. A temperatura no interior da caixa de acrílico era de 24ºC. Amostras de muco foram coletadas da parte posterior do palato e imediatamente imersas em óleo mineral para evitar a desidratação. Nestas condições experimentais, a camada de muco é depletada, mas a atividade ciliar permanece mantida18,1.
Nove grupos experimentais utilizando palatos de rã foram usados para este estudo. Cinco grupos foram utilizados para avaliar a ação do NO, produzido pela ativação da iNOS, na velocidade de transporte mucociliar. Para essa finalidade foi feito o bloqueio da iNOS com a aminoguanidina em quatro grupos constituídos de palatos que foram imersos em soluções de aminoguanidina diluídas em RingerR nas concentrações de 40 ppm (N=8), 50 ppm (N=10), 60 ppm (N=10) e 80 ppm (N=8) e um grupo controle (N=9) constituído de palatos imersos em solução de RingerR. Os outros quatro grupos de palatos foram usados para avaliar a ação do NO produzido pela ativação da cNOS na velocidade de transporte mucociliar. Para isso, foi feito o bloqueio inespecífico desta via através do L-NAME em três grupos de palatos imersos em solução de L-NAME diluídas em RingerR nas concentrações de 120 ppm (N=10), 180 ppm (N=10) e 240 ppm (N=10) e um grupo controle (N=9) constituído de palatos imersos em solução de RingerR.
O mesmo procedimento foi utilizado para a exposição de todos os palatos: imersão em solução de RingerR ou em uma das soluções de aminoguanidina ou de LNAME por quatro consecutivos períodos de 15 minutos. O transporte mucociliar foi avaliado antes e após cada um dos períodos de imersão dos palatos, seguindo técnica proposta19. O transporte mucociliar foi determinado pela medida da velocidade de deslocamento de amostras de muco autólogo colocadas na superfície do palato de rã depletado de muco. A velocidade de transporte mucociliar foi realizada pela medida do tempo ocorrido para o deslocamento do muco da parte anterior para a posterior do palato, usando um estereoscópio equipado com uma escala de medida graticulada em uma das oculares3. As amostras de muco eram imersas em éter etílico para a remoção do óleo mineral entes de serem colocadas na superfície do palato18. A cada determinação da velocidade, eram realizadas cinco medidas para minimizar eventual erro20. Durante as medidas os palatos permaneciam dentro da câmara de acrílico com 100% de umidade e temperatura de 24ºC.
O resultado final foi expresso em velocidade de transporte relativa, obtida dividindo a velocidade de transporte dos palatos registrada aos 15, 30, 45 e 60 minutos pela velocidade determinada no tempo zero (antes das imersões) - a velocidade basal19. O projeto foi aprovado pelo Comitê de Ética em Experimentação Animal sob o Nº 41/05.
Os valores das médias da velocidade de transporte relativa, dos vários grupos experimentais, foram comparados pela one-way análise da variância (ANOVA), e pela aplicação do teste de múltipla comparação de Newman- Keuls, para caracterizar as diferenças entre os resultados relativos a cada uma das soluções que foram utilizadas e às concentrações das soluções e, também, as diferenças relativas ao tempo de imersão para a mesma solução. O nível de significância foi de 5%.
RESULTADOS
Os palatos imersos em solução de RingerR (controles) mantiveram a velocidade de transporte relativa à basal estatisticamente semelhante ao longo do período em que foi avaliada a velocidade de transporte, isto é, após cada imersão em solução de RingerR.
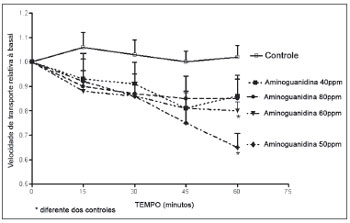
A aminoguanidina promoveu redução da velocidade de transporte mucociliar. Esta redução pareceu estar relacionada ao tempo, porém as diferenças não foram significativas. Das quatro soluções de aminoguanidina utilizadas no experimento, as soluções de 50 ppm e de 60 ppm exibiram redução da velocidade de transporte mucociliar com relação à observada nos palatos controles (Figura 1).
Figura 1. Velocidade relativa do transporte mucociliar em palatos de rã imersos em solução deRingerR (controles) ou em soluções 40 ppm, 50 ppm, 60 ppm ou 80 ppm de aminoguanidina.
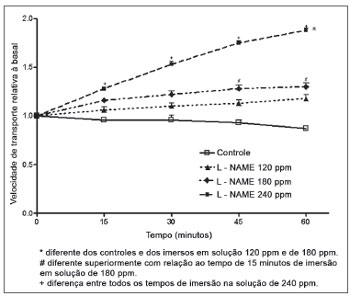
O L-NAME, ao contrário da aminoguanidina, promoveu aumento da velocidade de transporte mucociliar. As soluções de 120 e de 180 ppm de L-NAME não promoveram aumento significativo da velocidade de transporte, quando comparada com a dos palatos controles. Observou-se, entretanto, em palatos imersos em solução de 180 ppm de L-NAME, aumento da velocidade com relação ao tempo de imersão, havendo diferença estatística entre o período de 15 minutos e os de 45 e de 60 minutos de imersão. Aumento significativo da velocidade de transporte ocorreu em palatos imersos na solução de 240 ppm de L-NAME quando comparados com os palatos controles e os palatos imersos em solução de 120 ppm. Com relação ao tempo de imersão, as velocidades registradas após 15, 30, 45 ou 60 minutos foram estatisticamente diferentes nos palatos imersos em solução de 240 ppm (Figura 2).
Figura 2. Velocidade relativa de transporte mucociliar em palatos de rã imersos em solução deRingerR (controles) ou em soluções de L-NAME.
DISCUSSÃO
No presente trabalho optou-se por estudar o transporte mucociliar utilizando o palato de rã que é ciliado e secretor de muco, similar ao observado nas vias aéreas do homem1,3 e, através desta metodologia, avaliar o envolvimento do NO e das vias de produção do NO (cNOS e iNOS) na transportabilidade mucociliar. O nosso estudo demonstrou que a inibição da via constitutiva da produção de NO pelo L-NAME promoveu aumento na velocidade do transporte mucociliar, e que de forma contrária, a inibição da via indutiva pela aminoguanidina promoveu queda no tempo de transporte.
Vários estudos constataram o envolvimento do NO na atividade ciliar. No seio maxilar de coelho, observouse que a L-arg aumenta a frequência do batimento ciliar, efeito que foi reduzido através do bloqueio da NOS com a N(G)-nitro L-arginina (L-NNA)21. Na estimulação ciliar promovida por substâncias transmissoras ou mediadoras, cuja mediação estaria relacionada ao NO, constatou-se que este atue como mensageiro intermediário no epitélio ciliado, em resposta a estes estímulos. Mas que os mecanismos dependentes de NO não constituem uma única via para a estimulação da função ciliar22. Posteriormente, foi observado que o nitroprussiato de sódio (doador de NO) reduziu o tempo de transporte da sacarina, enquanto o L-NAME diminuiu o NO nasal e prolongou o tempo de transporte da sacarina em indivíduos saudáveis prétratados com agente anticolinérgico13.
Os resultados obtidos em estudo realizado com a L-arg e com L-NAME sugeriram que o NO pode estar envolvido com a função reguladora sobre a motilidade ciliar na mucosa do seio paranasal de indivíduos saudáveis, e que ambas, eNOS e iNOS produzem o NO na mucosa saudável, observando que a eNOS parece ter papel mais importante na produção do NO23.
No nosso trabalho, constatamos que o L-NAME promoveu aumento da velocidade de transporte mucociliar no palato de rã, quando esta velocidade era comparada com a observada antes da imersão dos palatos em solução de L-NAME. Este resultado mostra-se diferente da proposta de que o L-NAME reduz a atividade ciliar. É importante ressaltar que o L-NAME, pelo fato de ser um inibidor inespecífico da cNOS, pode bloquear também a ação da iNOS, de acordo com a dose utilizada24,9. Nesse sentido, o nosso trabalho utilizando o L-NAME e a aminoguanidina para bloquear a cNOS e a iNOS, respectivamente, e obtendo resultados diferentes e antagônicos, sugere que o bloqueio promovido tenha sido seletivo e que o papel do NO no transporte mucociliar depende da via enzimática que é ativada.
Outros estudos também apresentam diferentes resultados quanto à ação do NO. A instilação de Lipopolissacarídeo (componente da parede celular de E colli, que desenvolve processo infeccioso) na cavidade nasal de cobaia resultou em grande produção de NO, que foi considerado lesivo para o epitélio ciliado respiratório, pois provocou dano nas células do epitélio ciliado e diminuiu a frequência dos batimentos ciliares25. No processo da otite média, sugeriu-se que a ação contraditória do NO pode ser explicada pela diferente reação do NO em cada condição biológica específica. Em condições fisiológicas, quando a produção de NO é baixa, este pode ter função reguladora ou antiinflamatória. Por outro lado, em condições patológicas, como no processo inflamatório, a iNOS é ativada e a produção de NO aumenta26. No entanto, considerou-se que no seio maxilar de indivíduos saudáveis o NO produzido pela expressão da iNOS mantém a função ciliar e promove defesa imune, enquanto que no processo da rinossinusite e da septicemia, a produção do NO diminui pela redução da atividade da iNOS, resultando em prejuízo da defesa local e em maior risco para infecções secundárias15.
Posteriormente, foi proposto que em condições normais, o NO é produzido principalmente através da via da iNOS das células epiteliais dos seios nasais, e no processo inflamatório, pela via da iNOS das células inflamatórias. A atividade da iNOS do epitélio sinusal parece ser essencial para a constante produção do NO, necessário para a manutenção do batimento ciliar em frequência suficiente para otimizar a função de clearance mucociliar e manter os seios saudáveis. Durante a rinossinusite a expressão da iNOS das células epiteliais diminui, no entanto, a produção do NO pela iNOS das células de defesa do hospedeiro, da cavidade nasal, aumenta significantemente. Neste processo, grande quantidade de NO e dos seus metabólitos podem ter um papel fundamental na patogênese da rinossinusite27.
Os nossos experimentos demonstraram que os palatos imersos na solução de aminoguanidina tiveram redução da velocidade de transporte mucociliar em relação à velocidade medida antes da imersão. As doses que promoveram maior efeito inibitório foram de 50 ppm e de 60 ppm, sugerindo haver adequação de dose para a resposta inibitória da enzima nos palatos de rã. Os resultados confirmam que, no epitélio saudável de rã, o NO produzido pela iNOS promove o transporte mucociliar, uma vez que a inibição da iNOS pela aminoguanidina reduziu a velocidade do transporte.
CONCLUSÃO
Desta forma, o bloqueio inespecífico da cNOS com o L-NAME e o bloqueio relativamente específico da iNOS com a aminoguanidina permitiu propor que, dependendo da via de produção, o NO pode aumentar ou diminuir o transporte mucociliar em palatos de rã, sugerindo duplo papel para o NO no transporte mucociliar neste epitélio.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Macchione M, Guimarães ET, Saldiva PHN, Lorenzi-Filho G. Methods for studying respiratory mucus and mucus clearance. Braz J Med Biol Res. 1995;28:1347-55.
2. Boek WM, Graamans K, Natzijl H, van Rijk PP, Huizing EH. Nasal mucociliary transport: new evidence for a key role of ciliary beat frequency. Laryngoscope. 2002;112:570-3.
3. Trindade SHK, Mello Junior JF, Mion OG, Lorenzi-Filho G, Macchione M, Guimarães ET, Saldiva PHN. Methods for studying mucociliary transport. Rev Bras Otorrinolaringol. 2007;73:704-12.
4. Sleigh MA, Blake JR, Liron N. The propulsion of mucus by cilia. Am Rev Respir Dis. 1998;137:726-41.
5. Houtmeyers R, Gosseling R, Gayan-Ramirez G, Decramer M. Regulation of mucociliary clearance in health and disease. Eur Respir J. 1999;13:1177-88.
6. Braga PC. Pharmacology of bronchial hyper secretion: theoretical and practical approaches. Alegra L, Braga, P.C., eds. Bronchial mucociliary and related diseases. New York: Raven Press. 1990;13-26.
7. Jeffery PK, Gaillard D, Moret S. Human airway secretory cells during development and in mature airway epithelium. Eur Respir J. 1992;5:93-104.
8. Lund VJ Nasal physiology: Neurochemical receptor, nasal cycle, and ciliary action. Allergy Asthma Proc. 1996;7:179-84.
9. Lee RP, Wang D, Kao SJ, Chen HI The lung is the major site that produces nitric oxide to induce acute pulmonary oedema in endotoxin shock. Clin Exper Pharmacol Physiol. 2001;28:315-20.
10. Lundberg JO, Weitzberg E. Nasal nitric oxide in human. Thorax. 1999;54:947-52.
11. Watkins DN, Peroni DJ, Basclain, KA, Garlep MJ, Thompson PJ. Expression and activity of nitric oxide synthases in human airway epithelium. Am J Respir Cell Mol Biol. 1997;16:629-39.
12. Guo FH, Raeve HR, Rice TW, Stuer DJ, Thunnissen FBJM, Erzurum SC. Continuous nitric oxide synthesis by inducible nitric oxide synthase in normal airway epithelium in vivo. Proc Natl Acad Sci USA. 1995;92:7809-13.
13. Imada M, Nonaka S, KobayashiY, Iwamamoto J. Functional roles of nasal nitric oxide in nasal patency and mucociliary function. Acta Otolaryngol. 2002;122:513-9.
14. Djupesland PG, Chatkin JM, Qian W, Haight JS. Nitric oxide in the nasal airway: a new dimension in otorhinolaryngology. Am J Otolaryngol. 2001;22:19-32.
15. Deja M, Busch T, Bachmann S, Riskowisk K, Câmpean V, Weidmann B. et al. Reduced nitric oxide in sinus epithelium of patients with radiologic maxillary sinusitis and sepsis. Am J Respir Critical Care Med. 2003;168:281-6.
16. Albert J, August C, Stoll W, Rudack C. The effect of endogenous nitric oxide on cholinergic ciliary stimulation of human nasal mucosa. Laryngoscope. 2004;114:1642-7.
17. Albert J, Stoll W, Rudack C. The effect of endogenous nitric oxide on mechanical ciliostimulation of human nasal mucosa. Clin Exp Allergy. 2006,36:1254-9.
18. Rubin BK, Ramirez O, King M. Mucus depleted frog palate as a model for the study of mucociliary clearance 1990; J Appl Physiol. 1990;69(2):424-9.
19. Fló-Neyret C, Lorenzi-Filho G, Macchione M, Garcia MLB, Saldiva PHN. Effects of formaldehyde on the frog's mucociliary epithelium as a surrogate to evaluate air pollution effects on the respiratory epithelium. Braz J Med Biol Res. 2001;34:639-43.
20. King, M. Experimental models for studying mucociliary clearance. Eur Respir J. 1998;13:222-8.
21. Runer T, Cervin A, Lindberg S, Uddman R. Nitric oxide is a regulator of mucociliary activity in the upper respiratory tract. Otolaryngol Head Neck Surg. 1998;119:278-87.
22. Runer T, Lindberg S. Ciliostimulatory effects mediated by nitric oxide. Acta Otolaryngol. 1999;119:821-5.
23. Kim JW, Min YG, Rhee C.S, Lee CH, Koh YY, Rhyoo C. et al. Regulation of mucociliary motility by nitric oxide and expression of nitric oxide synthase in the human sinus epithelial cells. Laryngoscope. 2001;111:246-50.
24. Wang D, Wei J, Hsu K, Jau JC. Lieu MW, Chao TJ. Chen H. I. Effects of nitric oxide synthase inhibitors on systemic hypotension, cytokines and inducible nitric oxide synthase expression and lung injury following endotoxin administration in rats. J Biomed Sci. 1999;6:28-35.
25. Ueda T, Takumida M, Takeno S, Tashiro T, Kawamoto H, Yajin K. Functional role of nitric oxide in the nasal mucosa of the guinea pig after instillation with lipopolysaccharide. Acta Otolaryngol. 2001;121:510-6.
26. Jeon E, Park Y, Lee SK, Yeo S, Park SN, Chang K. Effect of nitric oxide and peroxynitrite on mucociliary transport function of experimental otitis media. Otolaryngology-Head Neck Surg. 2006;134:126-31.
27. Naraghi M, Deroee AF, Ebrahimkhani MR, Kiani S, Dehpour AR. Nitric oxide: a new concept in chronic sinusitis pathogenesis. Am J Otolaryngol Head Neck Med Surg. 2007;28:334-737.
1. Doutora. Docente Associado.
2. Pós-doutorado. Docente Associado.
3. Biomédico. Graduado do Curso de Biomedicina.
4. Graduanda do Curso de Farmácia e Bioquímica.
Universidade Estadual de Londrina.
PROPG - UEL.
Endereço para correspondência:
Departamento de Ciências Fisiológicas, Centro de Ciências Biológicas, Universidade Estadual de Londrina
Rodovia Celso Garcia Cid - Km 380 - Campus Universitário
86051-990 - Londrina - PR - Brasil
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 8 de outubro de 2008. cod. 6067.
Artigo aceito em 7 de agosto de 2009.