Ano: 2009 Vol. 75 Ed. 6 - Novembro - Dezembro - (3º)
Seção: Artigo Original
Páginas: 788 a 793
Biofilme em rinossinusite crônica com polipose nasossinusal: estudo piloto
Biofilm in chronic sinusitis with nasal polyps: pilot study
Autor(es): Thiago Freire Pinto Bezerra1, Francini Grecco de Melo Pádua2, Allex Itar Ogawa3, Eloisa Maria Mello Santiago Gebrim4, Paulo Hilário Nascimento Saldiva5, Richard Louis Voegels6
Palavras-chave: biofilmes, pólipos nasais, sinusite.
Keywords: biofilms, nasal polyps, sinusitis.
Resumo:
A patogenia da rinossinusite crônica não está completamente estabelecida e existem algumas explicações para essa doença, como a osteíte, os superantígenos, a hipersensibilidade mediada por fungos e, mais recentemente, o biofilme. Não existem publicações na língua portuguesa sobre biofilmes na rinossinusite crônica. Objetivo: Reproduzir um método para evidenciar a presença de biofilmes em pacientes com rinossinusite crônica com polipose nasossinusal. Material e Método: Amostras de bula etmoidal de nove pacientes com rinossinusite crônica com polipose nasossinusal sem resposta ao tratamento clínico submetidos à cirurgia foram analisadas com microscopia eletrônica de varredura para evidenciar o biofilme. Desenho do Estudo: Estudo de coorte contemporânea com corte transversal. Resultados: Observamos o biofilme em 55,56% (5/9) dos pacientes, através da visualização da estrutura tridimensional, de estruturas esféricas envolvidas por uma matriz amorfa e dos canais de água. Conclusão: Reproduzimos um método de visualização de biofilme bacteriano através da microscopia eletrônica de varredura e evidenciamos a sua presença nos pacientes com rinossinusite crônica com polipose nasossinusal.
Abstract:
Chronic rhinosinusitis' pathogenesis is not completely established and there are some explanations for this disease, such as osteitis, superantigens, fungal-mediated hypersensitivity and, more recently, biofilms. There are no reports in Portuguese about biofilms in chronic rhinosinusitis.
Aim: To reproduce a method for visualization of biofilms in patients with chronic rhinosinusitis and nasal polyps. Patients and Methods: Samples of ethmoid bulla of nine patients with chronic rhinosinusitis with nasal polyps without response to clinical treatment who underwent surgery were analyzed with scanning electron microscopy to evidence bacterial biofilms. Study design: A contemporary cross-sectional cohort study Results: In 55.56% (5/9) of the patients we observed biofilms by seeing three-dimensional structures, spherical structures surrounded by an amorphous matrix and water-channels. Conclusion: We reproduced a method for visualization of bacterial biofilms by scanning electron microscopy and evidenced its presence in chronic rhinosinusitis with nasal polyps.
![]()
INTRODUÇÃO
A rinossinusite crônica é uma das queixas mais comuns apresentadas em todas as visitas médicas americanas e uma das principais razões para prescrição de antibióticos e perda de produtividade laboral. Cerca de 135 em cada 1.000 americanos ou um total de 31 milhões de pessoas são afetadas nos Estados Unidos a cada ano, com um custo total de seis bilhões de dólares por ano1-3.
Dentre as classificações das rinossinusites, a classificação temporal separa as mesmas em agudas (até 12 semanas de evolução) e crônicas (mais de 12 semanas). Dentre as crônicas, encontramos um grupo sem polipose nasossinusal, e outro com polipose nasossinusal (RSCcP)4-6. A histopatologia é diferente entre a RSC com e sem pólipos, com um padrão de infiltração eosinofílico na primeira e neutrofílico na segunda, demonstrando haver uma fisiopatologia também diferente4. Segundo Voegels e Pádua, existe também uma diferença no tipo de resposta inflamatória presente, com uma diminuição significativa das dosagens de interleucinas envolvidas nas RSC com polipose que evoluíram com bom prognóstico pós-operatório7.
Várias teorias procuram explicar a fisiopatogenia da RSC. Entende-se hoje que a RSC é uma doença inflamatória imunológica causada simultaneamente ou individualmente por diversos fatores como: distúrbios imunológicos, fatores intrínsecos das vias aéreas superiores, superantígenos de Staphylococcus aureus, colonização fúngica que induz e mantém uma inflamação eosinofílica, perturbações metabólicas como a hipersensibilidade à aspirina, e agressão persistente a partir do biofilme e/ou da osteíte4.
O biofilme é uma reunião de células de microorganismos irreversivelmente ancorada a uma superfície inerte ou viva, envolvida em uma matriz de uma substância polimérica extracelular autoproduzida e composta de material primariamente polissacáride, que representa mais de 90% da massa do biofilme8-11. Essa forma de vida o torna altamente resistente a alterações de pH, temperatura e à atividade dos antibióticos, possivelmente justificando as infecções crônicas persistentes, refratárias a tratamento clinico, como a rinossinusite crônica com polipose nasal8-11.
O primeiro estudo que avaliou a presença de biofilmes na otorrinolaringologia foi realizado por Post em 2001, que identificou biofilmes em tubos de ventilação através da microscopia eletrônica de varredura (MEV) e associou estas estruturas às otites médias em um modelo animal12. Também já foi demonstrada a presença de biofilme no colesteatoma, nas tonsilites crônicas, nas adenoides de pacientes com sinusites crônicas e nas infecções associadas à biomateriais como próteses vocais13-15.
Perloff e Palmer foram os responsáveis por uma série de estudos que confirmaram a hipótese da presença do biofilme na mucosa dos pacientes com RSC16-18, cuja presença explicaria o porquê destes pacientes melhorarem durante o curso de antibióticos com recidiva após sua interrupção19. Estudo confirmaram a presença de bactérias no interior do biofilme através de microscopia eletrônica de transmissão e microscopia confocal a laser com hibridização fluorescente in situ19-21.
Não existem artigos na língua portuguesa sobre biofilme bacteriano em RSC. Esta publicação tem como objetivo reproduzir um método que evidencia biofilme bacteriano na RSC, que é um dos objetivos de um estudo mais amplo que esta sendo conduzido na Divisão de Rinologia da Disciplina de Otorrinolaringologia do mesmo hospital. A conclusão desta etapa foi fundamental para que pudéssemos utilizar esta ferramenta em novos estudos
OBJETIVO
Identificar o biofilme bacteriano na mucosa dos pacientes com rinossinusite crônica com polipose nasossinusal.
PACIENTES E MÉTODOS
Pacientes
Trata-se de um estudo coorte contemporâneo com corte transversal, realizado no período de fevereiro a maio de 2008. São relatados os nove primeiros pacientes com RSCcP sem resposta ao tratamento clínico e que fazem parte de um estudo coorte prospectivo que está sendo realizado em um hospital terciário. Todos os pacientes concordaram em assinar o consentimento escrito autorizado pela Comissão de Ética do Hospital (no. 0669/07).
A RSCcP foi definida por critérios clínicos e endoscópicos. Na avaliação clínica deveria haver a presença por um período superior a doze semanas de dois ou mais dos seguintes sintomas, e um desses deveria ser um dos dois primeiros: bloqueio ou congestão nasal; secreção nasal anterior ou gotejamento nasal posterior; dor ou pressão na face; e redução ou ausência de olfato5. Na avaliação endoscópica deveria haver polipose nasal bilateral5,6.
A ausência da resposta ao tratamento clínico foi definida por um período superior a três meses sem melhora clínica com uso de corticoide nasal tópico associados ou não ao uso de: antibióticos orais, antagonistas dos leucotrienos e/ou inibidores da sua síntese, solução salina nasal isotônica, e/ou corticoide sistêmico. Todos os pacientes eram maiores de 18 anos.
Foram excluídos pacientes cuja análise histológica por microscopia ótica do pólipo nasal demonstrou infiltração celular leucocitária predominantemente não eosinofílica, portadores de causas secundárias de RSC (bola doença fúngica invasiva, doenças granulomatosas, vasculites, mucoceles isoladas, tumores malignos e benignos nasossinusais, anormalidades congênitas - como discinesia ciliar primária, fibrose cística, anormalidades congênitas craniofaciais -, fístulas oroantrais e imunodeficiências primárias ou secundárias).
Coletamos amostra de tecido da bula etmoidal destes pacientes durante a cirurgia endoscópica sinusal funcional (FESS) no período de fevereiro a abril de 2008.
METODOLOGIA
Os fragmentos de aproximadamente 1,0 x 1,0cm por foram extraídos durante a cirurgia realizada por um dos médicos-residentes do serviço e fixados por 2 horas com glutaraldeído a 2% em tampão fosfato 0,15M (pH 7,2), à temperatura ambiente. Lavou-se por três vezes a peça em solução de lavagem contendo NaCl (1,2 g), Sacarose (14,6 g) e água destilada (200 ml), e realizou-se uma pós-fixação em 0sO4 a 1% por 1 hora. As amostras foram então desidratadas em concentrações crescentes de álcool etílico a partir de 70% até 100%, secadas ao ponto crítico em CO2 e montadas em suportes para MEV. Realizou-se metalização com platina e observação com o microscópio eletrônico de varredura Quanta 600 FEG, com uma voltagem de aceleração de 10kV. Fotomicrografias foram capturadas no formato TIFF com a magnificação de 1000 a 12000. Avaliou-se a presença de biofilme bacteriano por um patologista com experiência em ultraestrutura (P.H.N.S) através das fotomicrografias com visualização da estrutura tridimensional com estruturas esféricas envolvidas por uma matriz amorfa e os canais de água conectando estas estruturas esféricas. Não foram realizadas culturas microbiológicas.
RESULTADOS
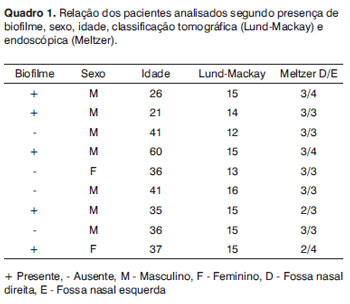
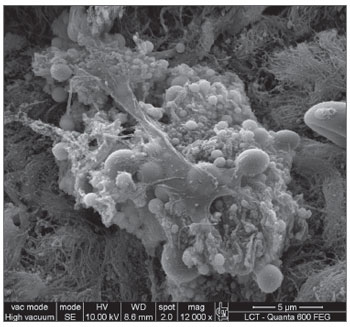
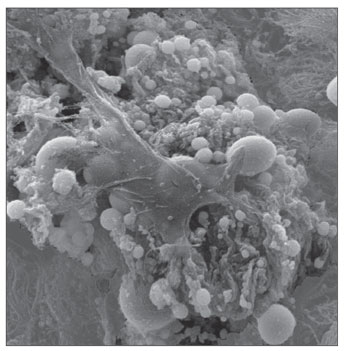
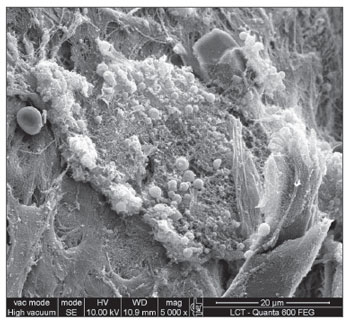
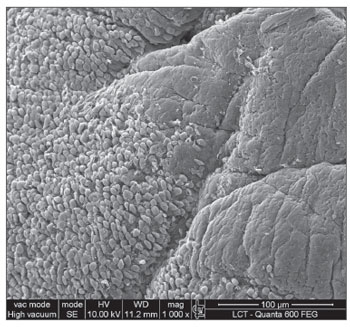
A MEV foi realizada nas amostras dos nove pacientes e encontramos o biofilme em 5 dos 9 pacientes (55,56%), segundo os critérios descritos na literatura9,10,12,13,16,17,19- 20,22. Foram sete homens e duas mulheres, com idade média de 37 anos ±11 (22-60). O estadiamento segundo Lund-Mackay foi em média de 14,4 ±1,2 (12-16), e segundo Meltzer de 2,8 ±0,4(2-3) e 3±0,5(3-4), à direita e à esquerda, respectivamente (Quadro 1). Foi possível visualizar a estrutura tridimensional, as estruturas esféricas envolvidas por uma matriz amorfa e os canais de água conectando estas estruturas esféricas (Figuras 1-5). Apenas em um dos casos conseguimos demonstrar a presença de cílios, estando os epitélios dos demais pacientes desnudos de cílios com aspecto de metaplasia escamosa e ausência de células globosas (Figura 6).
Figura 1a. Biofilme bacteriano (12.000x)
Figura 1b. Biofilme bacteriano -Ilustração
Figura 2. Biofilme bacteriano (aumento 5.000x)
Figura 3. Biofilme bacteriano (aumento 12.000x)
Figura 4. Biofilme bacteriano (12.000x)
Figura 5. Biofilme bacteriano (12.000x)
Figura 6. Epitélio cilíndrico não-ciliado ao lado de metaplasia escamosa
DISCUSSÃO
Os pacientes com RSC apresentam queixas persistentes, muitas vezes controladas durante a administração de antibióticos, e que recidivam após sua interrupção. Os biofilmes explicariam o porquê da incapacidade dos antibióticos em eliminar essa população bacteriana cronicamente estabelecida. As bactérias existindo no biofilme são envolvidas por uma matriz de glicopolissacarídeos e podem crescer coordenadamente uma vez que certa densidade celular seja alcançada pela indução de várias moléculas de sinalização, habilidade conhecida como quorum sensing19. É uma organização complexa de bactérias ancoradas em uma superfície, agrupadas numa espécie de sincício com forma de torres e cogumelos17.
O biofilme é menos susceptível aos antibióticos, tem baixa taxa de crescimento e geram bactérias planctônicas intermitentemente, que seriam mais susceptíveis às defesas do hospedeiro e aos antibióticos. Estas bactérias de vida livre seriam responsáveis pelos sintomas de infecção19.
A importância dada nas doenças humanas é recente, inclusive nas da nossa especialidade13. Embora no passado os microbiologistas tenham sempre focado a bactéria em sua forma planctônica, a recalcitrância clínica aos antibióticos tem aumentado o interesse no comportamento das bactérias quando elas colonizam superfícies produzindo biofilmes22. Publicações recentes do Centro de Controle e Prevenção de Doenças Americano (CDC) estimam que pelo menos 65% de todos os processos infecciosos bacterianos crônicos em humanos envolveriam biofilmes8,23. Os organismos importantes nas doenças otorrinolaringológicas são comprovadamente formadores de biofilme, como Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae e Staphylococcus aureus 13.
Além da RSC, já se demonstrou o biofilme bacteriano em outras doenças como otite média crônica purulenta, prostatite, osteomielites, endocardite bacteriana, fibrose cística, pneumonia e tonsilites crônicas13.
A dificuldade apresentada nas culturas dos pacientes com RSC em demonstrar os biofilmes é justificada pela presença de um gene, conhecido na P. aeruginosa como pvrR, que é ativado em resposta a condições ambientais favoráveis, e a bactéria se apresenta em meios de cultura comuns como não formadora de biofilme e susceptível aos antibióticos24. Além disso, estudos anteriores demonstraram uma ausência de relação dos resultados da cultura com a presença do biofilme e com o tipo de bactéria identificada no mesmo21.
A presença do biofilme através da MEV, no presente estudo, foi confirmada com imagens semelhantes às visualizadas em estudos anteriores17,18. Em cinco dos nove pacientes deste estudo piloto (55,56%), demonstramos a presença do biofime bacteriano, ressaltando a importância de avaliar as formas atuais de tratamento da rinossinusite crônica, pois os antibióticos já demonstraram ser ineficazes contra eles. É importante ressaltar que colhemos apenas mucosa da bula etmoidal e talvez a coleta de amostras de outros seios da face poderia ter apresentado um resultado diferente. A ventilação cirúrgica, o rompimento mecânico do biofilme e os detergentes podem tornar-se alternativas. A cirurgia pode ainda ser efetiva no tratamento porque permite a ventilação da cavidade infectada e aumenta a tensão de oxigênio no ambiente em torno do biofilme17. Sabe-se que o biofilme não é sempre detectado, mesmo em estudo realizado em cobaias que apresentam rinossinusite crônica. Neste estudo, o número de cobaias com biofilme detectado pela microscopia confocal foi bem menor do que com a MEV (48% vs 86%). Acredita-se que a MC seja um método mais preciso que a microscopia eletrônica de varredura por detectar especificamente bactéria, entretanto nos trabalhos realizados não foram utilizados marcadores para outros agentes que podem estar presentes nos biofilmes, como os fungos25.
Uma possível limitação da MEV é que a preparação acarretasse desidratação e ligações cruzadas protéicas que promoveriam o surgimento de artefatos que se assemelhariam ao biofilme. A desidratação reduz o tamanho do biofilme e minimamente distorce a arquitetura, mas ele ainda é facilmente reconhecido, como se demonstrou pela comparação com a criofixação. Entretanto, acredita-se que os biofilmes podem ser extraídos na preparação ou ainda os menores podem não ser visualizados20.
Estudos recentes têm relacionado à presença do biofilme com um pior prognóstico em pacientes com rinossinusite crônica20,26,27. Outros artigos têm buscado formas alternativas de erradicá-lo, como o uso de xampu infantil28. Se não for erradicado, falhas cirúrgicas podem ser atribuídas ao biofilme. Sua persistência dentro de sulcos de uma mucosa edemaciada e cronicamente inflamada, que tem ausência de cílios, o qual pode predispor o paciente para uma rápida reinfecção29.
Ressalta-se a importância que outros fatores têm na RSCcP, uma vez que em quase metade dos pacientes no presente estudo essas estruturas não foram visualizadas. O superantígeno bacteriano, a osteíte e a hipersensibilidade mediada por fungos têm uma contribuição importante na patogenia da RSC, não foram objetivo neste estudo-piloto e são modificadores da evolução da RSCcP4,30. Não se tem conhecimento do quanto cada um desses fatores poderia contribuir para gênese ou manutenção da RSC. Da mesma forma, a presença do biofilme em amostras de tecidos de pacientes com RSCcP é uma realidade, que não se sabe se é a causa ou a conseqüência da infecção persistente.
Reproduzimos um método para a detecção do biofilme que pode dar mais instrumentos às pesquisas nacionais na busca pela resolução da RSC. Este é o primeiro trabalho publicado em língua portuguesa sobre biofilmes. A evolução dos pacientes com RSCcP é consistente com o conhecimento atual dos biofilmes, com recidiva ao uso de antibióticos e melhora com a remoção da massa de biofilme, entretanto mais estudos precisam ser realizados para a definição de causa ou conseqüência da presença do biofilme e da RSCcP.
CONCLUSÃO
O presente estudo evidencia a presença de biofilme em pacientes com RSCcP com sua estrutura tridimensional, suas estruturas esféricas envolvidas por uma matriz amorfa e seus canais de água.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Benninger MS, Ferguson BJ, Hadley JA, Hamilos DL, Jacobs M, Kennedy DW, et al. Adult chronic rhinosinusitis: definitions, diagnosis, epidemiology, and pathophysiology. Otolaryngol Head Neck Surg.2003;129(3 Suppl):S1-32.
2. Osguthorpe JD. Adult rhinosinusitis: diagnosis and management. Am Fam Physician. 2001;63(1):69-76.
3. European Academy of Allergology and Clinical Immunology. European position paper on rhinosinusitis and nasal polyps. Rhinol Suppl. 2005;(18):1-87.
4. Meltzer EO, Hamilos DL, Hadley JA, Lanza DC, Marple BF, Nicklas RA et al. Rhinosinusitis: Establishing definitions for clinical research and patient care. Otolaryngol Head Neck Surg. 2004;131(6 Suppl):S1-62.
5. Fokkens W, Lund V, Mullol J;European Position Paper on Rhinosinusitis and Nasal Polyps Group. EP3OS 2007: European position paper on rhinosinusitis and nasal polyps 2007. A summary for otorhinolaryngologists. Rhinology. 2007;45(2):97-101.
6. Stammberger H. Surgical treatment of nasal polyps: past, present, and future. Allergy. 1999;54 Suppl 53:7-11.
7. Voegels RL, de Melo Padua FG. Expression of interleukins in patients with nasal polyposis. Otolaryngol Head Neck Surg. 2005;132(4):613-9.
8. Donlan RM. Biofilms: microbial life on surfaces. Emerg Infect Dis. 2002;8(9):881-90.
9. Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science. 1999;284(5418):1318-22.
10. Costerton W, Veeh R, Shirtliff lM, Pasmore M, Post C, Ehrlich G. The application of biofilm science to the study and control of chronic bacterial infections. J Clin Invest. 2003;112(10):1466-77.
11. Mah TF, OToole GA. Mechanisms of biofilm resistance to antimicrobial agents. Trends Microbiol. 2001;9(1):34-9.
12. Post JC. Direct evidence of bacterial biofilms in otitis media. Laryngoscope. 2001;111(12):2083-94.
13. Post JC, Stoodley P, Hall-Stoodley L, Ehrlich GD. The role of biofilms in otolaryngologic infections. Curr Opin Otolaryngol Head Neck Surg. 2004;12(3):185-90.
14. Van Den Hoogen FJ, Oudes MJ, Hombergen G, Nijdam HF, Manni JJ. The Groningen, Nijdam and Provox voice prostheses: a prospective clinical comparison based on 845 replacements. Acta Otolaryngol. 1996;116(1):119-24.
15. Zuliani G, Carron M, Gurrola J, Coleman C, Haupert M, Berk R et al. Identification of adenoid biofilms in chronic rhinosinusitis. Int J Pediatr Otorhinolaryngol. 2006;70(9):1613-7.
16. Perloff JR, Palmer JN. Evidence of bacterial biofilms on frontal recess stents in patients with chronic rhinosinusitis. Am J Rhinol. 2004;18(6):377-80.
17. Perloff JR, Palmer JN. Evidence of bacterial biofilms in a rabbit model of sinusitis. Am J Rhinol. 2005;19(1):1-6.
18. Cryer J, Schipor I, Perloff JR, Palmer JN. Evidence of bacterial biofilms in human chronic sinusitis. ORL J Otorhinolaryngol Relat Spec. 2004;66(3):155-8.
19. Ferguson BJ, Stolz DB. Demonstration of biofilm in human bacterial chronic rhinosinusitis. Am J Rhinol. 2005;19(5):452-7
20. Sanclement JA, Webster P, Thomas J, Ramadan HH. Bacterial biofilms in surgical specimens of patients with chronic rhinosinusitis. Laryngoscope. 2005;115(4):578-82.
21. Sanderson AR, Leid JG, Hunsaker D. Bacterial biofilms on the sinus mucosa of human subjects with chronic rhinosinusitis. Laryngoscope. 2006;116(7):1121-6.
22. Fergie N, Bayston R, Pearson JP, Birchall JP. Is otitis media with effusion a biofilm infection? Clin Otolaryngol Allied Sci. 2004;29(1):38-46.
23. Potera C. Forging a link between biofilms and disease. Science. 1999;283(5409):1837-9.
24. Drenkard E, and Ausubel FM. Pseudomonas biofilm formation and antibiotic resistance are linked to phenotypic variation. Nature. 2002;416(6882):740-3.
25. Ha KR, Psaltis AJ, Tan L, Wormald PJ. A sheep model for the study of biofilms in rhinosinusitis. Am J Rhinol. 2007;21(3):339-45.
26. Psaltis AJ, Weitzel EK, Ha KR, Wormald PJ. The effect of bacterial biofilms on post-sinus surgical outcomes. Am J Rhinol. 2008;22(1):1-6.
27. Bendouah Z, Barbeau J, Hamad WA, Desrosiers M. Biofilm formation by Staphylococcus aureus and Pseudomonas aeruginosa is associated with an unfavorable evolution after surgery for chronic sinusitis and nasal polyposis. Otolaryngol Head Neck Surg. 2006;134(6):991-6.
28. Chiu AG, Palmer JN, Woodworth BA, Doghramji L, Cohen MB, Prince A et al. Baby shampoo nasal irrigations for the symptomatic post-functional endoscopic sinus surgery patient. Am J Rhinol. 2008;22(1):34-7.
29. Al-Rawi MM, Edelstein DR, and Erlandson RA. Changes in nasal epithelium in patients with severe chronic sinusitis: A clinicopathologic and electron microscopic study. Laryngoscope. 1998;108(12):1816-23.
30. Patou J, Gevaert P, Van Zele T, Holtappels G, van Cauwenberge P, Bachert C. Staphylococcus aureus enterotoxin B, protein A, and lipoteichoic acid stimulations in nasal polyps. J Allergy Clin Immunol. 2008;121(1):110-5.
1. Médico Otorrinolaringologista.
2. Doutora. Médica Assistente da Divisão de Otorrinolaringologia do Hospital das Clínicas da Faculdade de Medicina da USP.
3. Médico. Residente da Divisão de Otorrinolaringologia do Hospital das Clínicas da FMUSP.
4. Doutora. Médica Assistente da Divisão de Radiologia do Hospital das Clínicas da FMUSP.
5. Livre-Docente. Professor Titular do Departamento de Patologia da FMUSP.
6. Livre-Docente. Professor Associado da Disciplina de Clínica Otorrinolaringológica da FMUSP Diretor do Setor de Rinologia do Hospital das Clínicas de FMUSP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 19 de outubro de 2008. cod. 6081.
Artigo aceito em 21 de junho de 2009.