Ano: 2009 Vol. 75 Ed. 5 - Setembro - Outubro - (21º)
Seção: Artigo Original
Páginas: 745 a 752
Papel da apoptose na ototoxicidade por cisplatina em ratos
The role of apoptosis in cisplatin-induced ototoxicity in rats
Autor(es): Marcos Rabelo De Freitas1, Aline Almeida Figueiredo2, Gerly Anne de Castro Brito3, Renata Ferreira de Carvalho Leitao4, Jose Valdir de Carvalho Junior5, Raimundo Martins Gomes Junior6, Ronaldo de Albuquerque Ribeiro7
Palavras-chave: apoptose, audição, cisplatino, perda auditiva.
Keywords: apoptosis, hearing, cisplatin, hearing loss.
Resumo:
Cisplatina é um agente quimioterápico frequentemente usado para o tratamento de várias linhagens de neoplasias. A ototoxicidade é um dos efeitos colaterais causadores de significativa morbidade e que limita sua utilização. Este estudo teve por objetivo avaliar o papel da apoptose na ototoxicidade por cisplatina. Desenho do Estudo: Estudo experimental. Material e Método: Ratos Wistar machos foram tratados com cisplatina, via intraperitoneal, nas doses de 24 e 16 mg/kg. Os animais foram avaliados através de emissões otoacústicas evocadas produtos de distorção (EOAPD) ou potenciais auditivos evocados de tronco encefálico (PAETE) no terceiro (D3) e quarto (D4) dias após o início da infusão das drogas. Em seguida suas cócleas foram removidas para estudo de imunoistoquímica para apoptose, método TUNEL. Resultados: O grupo tratado com 24 mg/kg mostrou diminuição significativa da amplitude das EOAPD, fato não observado com a dose de 16 mg/kg. Ambas as doses promoveram aumento do limiar eletrofisiológico pelo PAETE no D3 e D4. A apoptose foi o mecanismo de lesão responsável pela ototoxicidade da cisplatina, dose de 16 mg/kg, quando os animais foram avaliados no D3. Conclusão: Apoptose pode estar envolvida no mecanismo de ototoxicidade pela cisplatina, na dependência da dose e tempo de avaliação da lesão.
Abstract:
Cisplatin is a chemotherapy agent frequently used to treat different types of neoplasia. Ototoxicity is one of the side-effects which cause significant morbidity and limits its use. This study aimed at assessing the role of apoptosis in cisplatin-induced ototoxicity. Design: experimental study. Materials and Methods: male Wistar rats were treated with intraperitoneal cisplatin, in the doses of 24 and 16 mg/kg. The animals were assessed by means of distortion product evoked otoacoustic emissions (DPEOAE) or brainstem evoked auditory potentials (BEAP) in the third (D3) and fourth (D4) days after drug infusion onset. Following that, their cochleas were removed for immunohistochemical studies of apoptosis - TUNEL method. Results: the group treated with 24 mg/kg showed a significant reduction in DPEOAE amplitude, and such fact was not seen with the 16 mg/kg. Both doses caused an increase in BEAP electrophysiological threshold in D3 and D4. Apoptosis was the injury mechanism responsible for the cisplatin-induced ototoxicity - 16 mg/kg dose, when the animals were assessed on D3. Conclusion: apoptosis may be involved in the cisplatin-induced ototoxicity, depending on the dose and time of injury assessment.
![]()
INTRODUÇÃO
A cóclea é a estrutura neurossensorial fundamental no processo auditivo periférico da mensagem acústica. É formada por uma série de estruturas epiteliais complexas, com células sensoriais e de sustentação, situadas sobre a membrana basilar. Seu dano, quase sempre irreversível, poderá ter consequências funestas para o indivíduo acometido, que pode ver comprometida sua capacidade de comunicação, com sérios transtornos ao convívio social. Por outro lado, apesar do potencial ototóxico de algumas drogas antineoplásicas e, entre elas, a cisplatina, não se deve desprezá-las como uma alternativa terapêutica para o paciente portador de uma neoplasia maligna. Daí a importância de se determinar com exatidão os mecanismos através dos quais ocorrem os efeitos ototóxicos de tais drogas, para se buscar estratégias de redução dessa toxicidade, sem comprometer seu efeito terapêutico1.
Cisplatina (cisdiaminodicloroplatinum) é um agente quimioterápico frequentemente usado para o tratamento de várias linhagens de neoplasias, mormente as de cabeça e pescoço2. O mecanismo de ação antineoplásico está relacionado à inibição seletiva e persistente da síntese de ácido desoxirribonucleico (DNA)3. Seus efeitos colaterais incluem ototoxicidade, nefrotoxicidade, supressão medular e distúrbios gastrointestinais4. Estes tipos de toxicidade podem interferir com o tratamento ao reduzir a dosagem, frequência e duração da quimioterapia em muitos pacientes5.
A ototoxicidade por cisplatina foi primeiramente descrita por Rossof et al., em 1972, e tem sido amplamente estudada desde então6. Sua incidência parece variar entre 4 e 50%7-9, embora alterações na audiometria de alta frequência possam ser evidenciadas na quase totalidade dos casos10.
Este tipo de lesão parece resultar de dano de vários tecidos mediado por radicais livres11-14. Tem sido demonstrado que espécies reativas de oxigênio são geradas na cóclea após exposição à cisplatina15 e o estresse oxidativo pode provocar a morte de células cocleares por apoptose secundário à ativação de caspase-316.
Apoptose é uma forma ativa de morte celular que ocorre durante o desenvolvimento normal, bem como quando células são expostas a determinados tipos de agentes agressores tais como isquemia/hipóxia, radiação ou toxinas17 e este mecanismo de lesão parece ser a base fisiopatológica da ototoxicidade da cisplatina.
A apoptose de células da orelha interna pode ser desencadeada por formação de complexos entre a cisplatina e o DNA da célula lesada, impedindo a progressão do ciclo celular18-20. Outra via proposta para ototoxicidade da CDDP em modelos animais estabelece que o estresse oxidativo induzido pela droga desencadearia uma cascata de reações intracelulares que tem como resultado final a apoptose13.
Liu et al.21 e Cheng et al.22, através de experimentos em culturas de células do órgão de Corti de ratos Wistar de 3 dias de vida, demonstraram o papel da apoptose como mecanismo de lesão celular pela cisplatina. Watanabe et al.23 identificaram DNA fragmentado no gânglio espiral e estria vascular de cobaias submetidas a tratamento com 10 mg/kg de cisplatina. Entretanto, esse achado não foi visto nas células ciliadas do órgão de Corti. No estudo de Alam et al.24 em roedores da Mongólia, a identificação de células apoptóticas, após administração de CCDP 20 mg/kg, deu-se em todas as estruturas da cóclea, incluindo células ciliadas externas e internas, células suporte, gânglio espiral, estria vascular, ligamento espiral. Devarajan et al.18 evidenciaram também, em culturas de células de órgão de Corti de ratos, que a CDDP promove apoptose em concentrações menores e que doses maiores podem levar diretamente à necrose celular, podendo esses 2 mecanismos ser um continuum. Wang et al.25 mostraram que a dose de 10 mg/kg de cisplatina foi capaz de induzir apoptose na cóclea de cobaias, principalmente em células ciliadas externas, células ciliadas internas e estria vascular. Verificaram, ainda, através de microscopia eletrônica de transmissão, que outros mecanismos de lesão celular, como autólise e necrose, podem estar envolvidos na ototoxicidade da cisplatina.
A apoptose de células ciliadas da cóclea é dependente da expressão de proteínas pró-apoptóticas como p5312, caspases21,22,25, calpaínas26, Bax e Bid18, c-jun NH2-terminal quinases (JNK)22 e antiapopóticas como o BCL-218,24. Portanto, reduzir a apoptose de células da orelha interna sem inibir o efeito antitumoral da CDCP pode ser uma estratégia válida para diminuir os efeitos ototóxicos deste quimioterápico27. Este estudo teve por objetivo avaliar o papel da apoptose na lesão coclear induzida por cisplatina em ratos.
MATERIAL E MÉTODOS
Foram utilizados para o estudo ratos Wistar machos, com peso variando entre 200 e 348g, mantidos em gaiolas com livre acesso a alimentos e água, em ciclos naturais de sono e vigília, e manuseados segundo as normas preconizadas pelo Colégio Brasileiro de Experimentação Animal (COBEA), encontradas no sítio www.cobea.org.br. O projeto foi submetido à aprovação pelo Comitê de Ética em Pesquisa em Animais (CEPA), tendo sido aprovado sob número de protocolo 28/05.
Os animais foram divididos em 8 grupos de acordo com a dose, forma de administração de cisplatina, tipo e momento da avaliação funcional (n= número de ratos).
Grupo 1 (n=11): Ratos tratados com cisplatina na dose de 8 mg/kg/dia em 3 dias consecutivos (total de 24 mg/kg) e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 2 (n=6): Ratos tratados com solução salina na dose de 8 ml/kg/dia em 3 dias consecutivos (total de 24 ml/kg) e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 3 (n=8): Ratos tratados com cisplatina na dose de 8 mg/kg/dia em 3 dias consecutivos (total de 24 mg/kg) e avaliados antes do tratamento (D0) e quatro dias (D4) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 4 (n=6): Ratos tratados com solução salina na dose de 8 ml/kg/dia em 3 dias consecutivos (total de 24 ml/kg) e avaliados antes do tratamento (D0) e no 4o dia após o seu início (D4) por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 5 (n=12): Ratos tratados com cisplatina em dose única de 16 mg/kg/dia e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 6 (n=5): Ratos tratados com solução salina em dose única de 16 ml/kg/dia e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 7 (n=7): Ratos tratados com cisplatina em dose única de 16 mg/kg/dia e avaliados antes do tratamento (D0) e quatro dias (D4) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 8 (n=6): Ratos tratados com solução salina em dose única de 16 ml/kg/dia e avaliados antes do tratamento (D0) e quatro dias (D4) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Em um estudo paralelo, animais semelhantes foram divididos em quatro grupos no intuito de avaliar seu limiar e audição pré e pós-tratamento através de potenciais auditivos evocados de tronco encefálico (PAETE), sendo estes:
Grupo 9 (n=11): Ratos tratados com cisplatina na dose de 8 mg/kg/dia em 3 dias consecutivos (total de 24 mg/kg) e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Grupo 10 (n=7): Ratos tratados com solução salina na dose de 8 ml/kg/dia em 3 dias consecutivos (total de 24 ml/kg) e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Grupo 11 (n=12): Ratos tratados com cisplatina em dose única de 16 mg/kg/dia e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Grupo 12 (n=8): Ratos tratados com solução salina em dose única de 16 ml/kg/dia e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Os ratos Wistar foram submetidos a anestesia profunda com ketamina 50 mg/kg associada a xilazina 10 mg/kg. Uma otoscopia prévia foi realizada eliminando-se os animais com sinais de afecções de orelha externa ou média. Aqueles com otoscopia normal se submeteram a exame de emissões otoacústicas evocadas produtos de distorção (EOAPD), imediatamente antes da administração das drogas. Nos grupos cisplatina 8 mg/kg em 3 dias consecutivos ou solução salina 8 ml/kg em 3 dias consecutivos, as drogas eram injetadas por via intraperitoneal logo após a conclusão da primeira avaliação auditiva. Nos dois dias subsequentes, depois de nova pesagem dos ratos, cisplatina 8 mg/kg ou solução salina 8 ml/kg eram novamente administradas, para resultar em uma dose final respectivamente de 24 mg/kg e 24 ml/kg. Vinte e quatro (D3) ou 48h (D4) depois da última administração, os ratos eram novamente anestesiados, era realizada uma outra otoscopia para descartar aqueles que adquiriram doenças de orelha média ou externa durante o período de administração das drogas, e eram submetidos a nova avaliação auditiva por EOAPD. Nos grupos em que a cisplatina foi injetada por via intraperitoneal na dose única de 16 mg/kg e a salina 16 ml/kg, utilizou-se uma bomba de infusão de marca Kd Scientific série 100 para que o tempo de infusão fosse fixado em 30min. Quando necessário, nova dose dos anestésicos era injetada. A avaliação auditiva também foi realizada no terceiro (D3) ou quarto (D4) dias após a administração das drogas.
Imediatamente após a realização da última avaliação auditiva por EOAPD, efetivava-se a remoção de seu osso temporal direito, após eutanásia por decapitação com guilhotina de fabricação própria. A cóclea era dissecada para realização da técnica de imunoistoquímica como descrito em itens subsequentes.
Nos quatro últimos grupos (9 a 12), os animais foram submetidos aos mesmos procedimentos de anestesia, otoscopia e injeção de drogas relatados anteriormente, sem, entretanto, efetivar-se a remoção de seus ossos temporais para imunoistoquímica. A avaliação auditiva foi realizada por meio de PAETE (potencial auditivo evocado de tronco encefálico), tendo o mesmo grupo de animais se submetido ao exame imediatamente antes e no terceiro e quarto dias após a administração das drogas.
Os exames de emissões otoacústicas evocadas produtos de distorção (EOAPD) foram realizados com aparelho de emissões otoacústicas de marca MADSEN Capella - GN Otometrics, em ambiente silencioso. Aos ratos anestesiados, em seu conduto auditivo externo direito, foi acoplada a sonda do aparelho através de sondas para exame de recém-nascido. O estímulo consistiu de 2 tons puros (F1 e F2) cuja relação de frequência F1/F2 foi igual a 1,22. A intensidade dos estímulos foi fixada em 70 dB NPS. Foi analisado um total de 1000 aquisições. As emissões otoacústicas resultantes foram avaliadas nas frequências de 3, 4, 6 e 8 kHz. Considerou-se a presença de EOAPD para uma relação sinal/ruído (S/R) de, no mínimo, 6 dB NPS, de acordo com as especificações técnicas do aparelho utilizado.
Utilizou-se, para realização do exame de potencial auditivo evocado de tronco encefálico (PAETE), aparelho Interacoustic EP 25, localizado em ambiente silencioso. Com os animais anestesiados, eletrodos subdérmicos de platina foram posicionados no vértex (positivo), região retroauricular direita (negativo) e ponta do nariz (terra). Fones de inserção ER-3A acoplados a uma sonda utilizada para avaliação auditiva de recém-nascidos foram introduzidos no conduto auditivo externo direito dos ratos. Os estímulos empregados foram cliques de rarefação, liberados a uma taxa de 15 por segundo, com um total máximo de 700 promediações e um tempo de análise de 15 mseg. A banda passante utilizada foi de 0 a 3000 Hz. Os estímulos foram iniciados em 80 dB NA e diminuídos progressivamente até o desaparecimento completo das ondas. Para o limiar auditivo eletrofisiológico, foi considerada a menor intensidade de estímulo em que se evidenciava onda II.
No imunoistoquímica para apoptose pelo método TUNEL (TdT-mediated dUTP nick end-labeling), quatro cortes de 4mm da cóclea, passados ao longo do modíolo, foram preparados em lâminas cobertas com L-polilisina. Utilizou-se na técnica de imunoistoquímica para apoptose o quite ApopTagR S 7100 (Chemicon International). Os cortes histológicos foram desparafinizados com xilol e reidratados com concentrações decrescentes de álcool (absoluto, 95% e 70%). Em seguida, lavados com solução tampão fosfato (PBS) e incubados à temperatura ambiente com proteinase K por 15min para promover a recuperação antigênica. Depois de lavado com água destilada, o material foi tratado com peróxido de hidrogênio 3% volume por volume em PBS durante 5min, para bloquear a peroxidase endógena. Seguiu-se nova lavagem com PBS, após o que os cortes histológicos foram incubados com o Equilibration Buffer por 10s e imediatamente depois com a enzima TdT (desoxinucleotidil transferase) associada aos nucleotídeos marcados com digoxigenina (reaction buffer) que iriam se ligar às hidroxilas livres do DNA fragmentado das células apoptóticas. O controle negativo não recebeu a enzima. O material permaneceu em estufa a 37oC por 1h e a reação foi terminada com a solução stop. Lavagem com PBS, em seguida adição do conjugado antidigoxigenina e incubação à temperatura ambiente por 30min. Outra lavagem com PBS e adicionado o DAB (diaminobenzidina), o substrato da peroxidase, incubando o material por 3 a 6min, para desenvolver a coloração da reação. Lavagens com água destilada e as lâminas foram contracoradas com methyl green. Nova lavagem com água destilada, imersão em N-butanol 100% e xilol e, em seguida, procedeu-se à montagem das lamínulas com EntelanR.
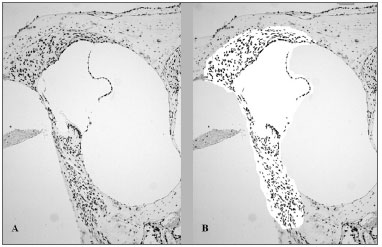
Para se quantificar a intensidade de coloração das estruturas, foram feitas fotomicrografias da espira basal com aumento de 100x através de sistema de captura digital Leica DFC 320. Utilizando-se o programa Sistema de Análises Histomorfométricas (SAHM 1.0), uma área compreendendo a rampa média com o órgão espiral de Corti, gânglio espiral, estria vascular e ligamento espiral foi selecionada e avaliada a relação área corada sobre área não corada (pixels/pixels). O programa SAHM 1.0 seleciona uma coloração pré-definida que se quer avaliar e quantifica a área ocupada por essa coloração (Figura 1).
Figura 1. Análise histomorfométrica, após técnica de imunoistoquímica TUNEL, de um animal tratado com cisplatina 16 mg/kg com sua cóclea removida no D3. A coloração castanha indica morte celular. A. Coloração vista antes da seleção e quantificação da área corada. B. Após seleção da área a ser analisada pelo programa SAMH 1.0, isolando-se os pontos castanhos.
Foi utilizado, para confecção dos gráficos e análise estatística, o programa GraphPad Prism 4.00.255. Foi avaliada a distribuição normal da amostra através do teste de Komogorov-Smirnov. Os resultados forma expressos como média ± o erro padrão da média (MED ± EPM), para os dados contínuos, e como mediana (Md) e valores mínimo (Min) e máximo (Max) para os dados ordinais. A significância mínima aceita foi ao nível de 5%. Os procedimentos experimentais foram comparados utilizando-se os seguintes testes:
Teste t de Student, para comparar as médias das amplitudes das emissões otoacústicas produtos de distorção em cada frequência antes e após tratamento e para comparar a fração de área corada em relação à não corada na imunoistoquímica pelo método TUNEL entre cada grupo tratado com cisplatina e seu controle.
Análise de Variância (ANOVA) com a significância entre os grupos estabelecida pelo Teste de Tukey para comparar as médias dos limiares eletrofisiológicos dos animais obtidos através de potencial auditivo evocado de tronco encefálico entre o primeiro (D0), quarto (D3) e quinto (D4) dias da avaliação.
RESULTADOS
Avaliação funcional da audição por emissões otoacústicas evocadas produtos de distorção (EOAPD)
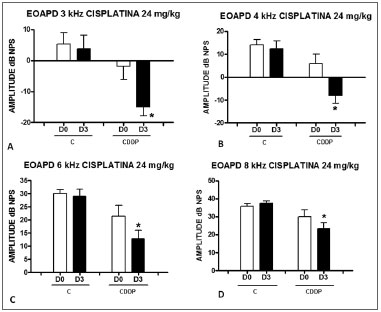
Foi encontrada uma diminuição significativa da amplitude das EOAPD nas frequências testadas (3, 4, 6 e 8 kHz) entre os dias D0 e D3, no grupo em que se administrou CDDP na dose de 24 mg/kg (Grupo 1). Essa diminuição não foi evidenciada no grupo controle. (Figura 2 A, B, C e D).
Figura 2. Gráficos dos valores da amplitude das EOAPD expressos como média ñ erro padrão da média nos dias D0 e D3, dos grupos 1 e 2. Os asteriscos representam significância estatística. CDDP = cisplatina; C = controle. Gráfico A: frequência de 3 kHz (Teste T: * p = 0,0095 - D3 x D0 CDDP). Gráfico B: frequência de 4 kHz (Teste T: * p = 0,0073 - D3 x D0 CDDP). Gráfico C: frequência de 6 kHz (Teste T: * p = 0,0284 - D3 x D0 CDDP). Gráfico D: frequência de 8 kHz (Teste T: * p = 0,0338 - D3 x D0 CDDP).
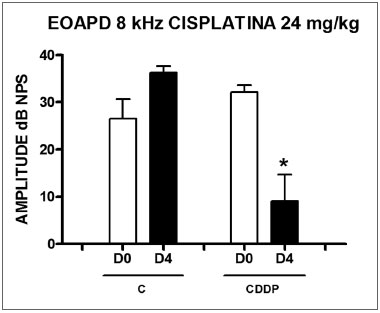
No grupo 3 houve uma mortalidade elevada dos animais avaliados no D4 do procedimento. Dos oito animais que receberam CDDP na dose cumulativa de 24 mg/kg, apenas 3 permaneceram vivos para realização do exame de EOAPD no D4. Destes, 2 de 3 ratos tiveram desaparecimento das EOAPD, comprovada por uma diferença sinal/ruído menor que 6 dB NPS, nas frequências de 3 e 4 kHz. Um animal mostrou também desaparecimento das EOAPD na frequência de 6 kHz. Na frequência de 8 kHz notou-se uma diminuição significativa da amplitude das EOAPD entre D0 e D4 (Figura 3).
Figura 3. Gráfico dos valores da amplitude das EOAPD expressos como média ñ erro padrão da média nos dias D0 e D4, dos grupos 3 e 4 na frequência de 8 kHz. O asterisco representa significância estatística. CDDP = cisplatina; C = controle. Teste T: * p = 0,0459 (D4 x D0 CDDP).
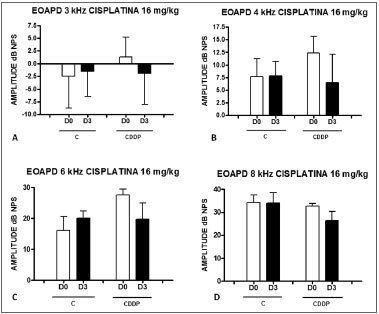
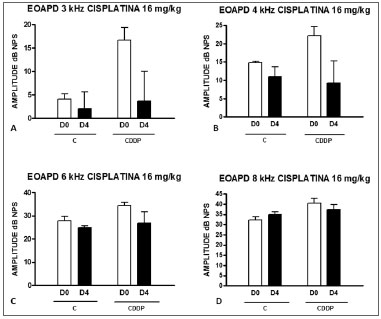
Com a dose de 16 mg/kg de CDDP, não foi possível identificar diminuição estatisticamente significativa das amplitudes médias das EOAPD entre D0 e D3 e entre D0 e D4, em todas as frequências estudadas (p > 0,05) ( Figuras 4 A, B, C e D e 5 A,B,C e D).
Figura 4. Gráficos dos valores da amplitude das EOAPD expressos como média ñ erro padrão da média nos dias D0 e D3, dos grupos 5 e 6. CDDP = cisplatina; C = controle. Não houve significância estatística em nenhum dos grupos (Teste T: p > 0,05).
Figura 5. Gráficos dos valores da amplitude das EOAPD expressos como média ñ erro padrão da média nos dias D0 e D4, dos grupos 7 e 8. CDDP = cisplatina; C = controle. Não houve significância estatística em nenhum dos grupos (Teste T: p > 0,05).
Avaliação funcional da audição por potencial auditivo evocado de tronco encefálico (PAETE)
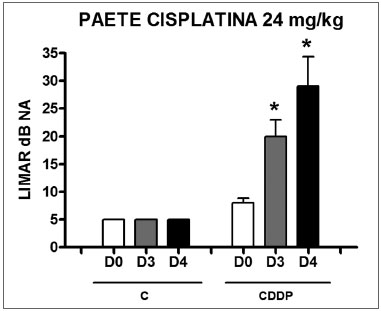
Houve um aumento significativo do limiar médio eletrofisiológico dos animais injetados com cisplatina 24 mg/kg no D3 e D4 quando comparados ao D0. Não foi notada diferença estatística significativa desses limiares entre D3 e D4. No grupo controle não houve elevação dos limiares eletrofisiológicos (Figura 6).
Figura 6. Gráfico dos limiares eletrofisiológicos médios nos grupos 9 e 10 em D0, D3 e D4, expressos como média ñ erro padrão da média (MED ñ EPM). O asterisco representa diferença estatística significativa. CDDP = cisplatina; C = controle. ANOVA - Tukey: * p < 0,01 (D3 x D0 CDDP); * p < 0,001 (D4 x D0 CDDP).
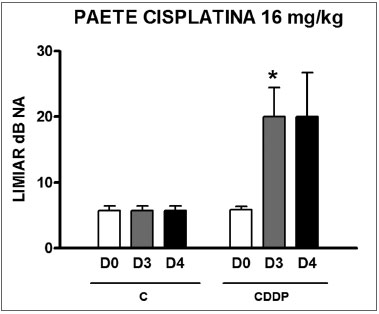
Foi evidenciado um aumento significativo do limiar médio eletrofisiológico dos animais injetados com cisplatina 16 mg/kg no D3 quando comparados ao D0. Não foi notada diferença estatística significativa desses limiares entre D3 e D4. No grupo controle também não houve elevação dos limiares eletrofisiológicos (Figura 7)
Figura 7. Gráfico dos limiares eletrofisiológicos médios nos grupos 11 e 12 em D0, D3 e D4, expressos como média ñ erro padrão da média (MED ñ EPM). O asterisco representa diferença estatística significativa. CDDP = cisplatina; C = controle. ANOVA - Tukey: * p < 0,05 (D3 x D0 CDDP).
Apoptose na Ototoxicidade por Cisplatina
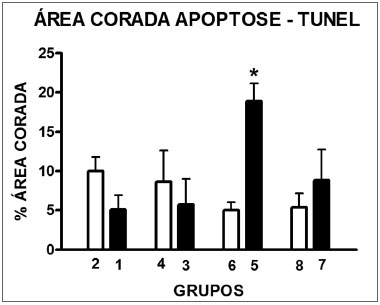
Foi evidenciada marcação de células pelo método TUNEL em todas as áreas do labirinto membranoso (células ciliadas internas e externas, estria vascular, ligamento espiral, limbo espiral, gânglio espiral) para ambas as doses e nos grupos controle. Comparando-se a intensidade de coloração entre cada grupo tratado e seu controle com o programa SAHM 1.0, evidenciou-se uma significativa maior marcação pelo método TUNEL na cóclea dos animais tratados com a dose de 16 mg/kg de CDDP e que tiveram seus ossos temporais removidos no D3. Não houve diferença significativa entre os demais grupos e seus controles (Figura 8).
Figura 8. Gráfico representando a fração média ñ erro padrão da média (MED ñ EPM) de área corada (TUNEL positivas) na espira basal da cóclea dos animais nos diversos grupos. O asterisco representa significância estatística. Teste T: * p = 0,0013 (Grupo 5 - CDDP 16 D3 EOPAD x Grupo 6 - controle).
DISCUSSÃO
A cisplatina é um dos mais largamente usados e mais efetivos quimioterápicos contra tumores malignos epiteliais, incluindo tumores de testículo, ovário, vesícula, pulmão, cabeça e pescoço19. Alguns de seus efeitos adversos, tais como náuseas, vômitos e disfunção renal, podem ser combatidos com o uso de antagonistas de receptores da serotonina e hidratação28. Contudo, a ototoxicidade permanece sendo um dos efeitos colaterais causadores de significativa morbidade e que frequentemente limita sua utilização29. Diante disso, há a necessidade de se desenvolver modelos experimentais que levem a uma melhor compreensão dos mecanismos envolvidos na ototoxicidade da CDDP e maneiras viáveis de amenizá-la.
A avaliação funcional da audição dos ratos no experimento foi primeiramente realizada através do exame de emissões otoacústicas produtos de distorção (EOAPD), por ser o único método disponível no momento em que se iniciou o estudo. Durante o desenrolar dos experimentos, foi adquirido um aparelho de potenciais evocados auditivos, que tornou exequível a avaliação funcional da audição dos ratos por potencial auditivo evocado de tronco encefálico. Desse modo, não foi possível submeter o mesmo grupo de animais aos dois métodos de avaliação funcional.
Neste estudo, somente a dose de 24 mg/kg foi capaz de desencadear ototoxicidade por cisplatina mensurável por EOAPD em todas as frequências estudadas.
Quando a avaliação funcional foi realizada através de potencial auditivo evocado de tronco cerebral (PAETE), foi evidenciado aumento no limiar eletrofisiológico nas duas doses empregadas.
Alguns estudos sugerem que a cisplatina pode promover lesão celular por interagir com sítios nucleofílicos das cadeias de DNA, levando a mecanismos que têm como resultado final a apoptose19. Este efeito, benéfico quando se está tratando uma neoplasia, é a base para a compreensão da ototoxicidade causada por essa droga20.
Outro mecanismo proposto para esse efeito adverso da CDDP é através do estresse oxidativo que levaria a danos celulares irreversíveis e apoptose11,13,17,18,25,26,30.
No presente estudo, conseguiu-se, através do método TUNEL (ApopTagR) de imunoistoquímica para detecção de cadeias fragmentadas de DNA, estabelecer que as cócleas de ratos tratados com a dose de 16 mg/kg de cisplatina e que tiveram seus ossos temporais removidas 3 dias depois, foram significativamente marcadas de forma mais intensa que o seu controle. A marcação se deu em todas as estruturas do labirinto membranoso, incluindo células ciliadas externas e internas, células suporte, estria vascular, gânglio espiral, ligamento espiral, limbo espiral, resultados esses semelhantes ao estudo de Alam et al.24 em roedores da Mongólia. Apesar de, com a dose de 24 mg/kg e os animais avaliados no D3 e D4, bem como com a dose de 16 mg/kg avaliada no D4, também se evidenciarem células marcadas pelo método TUNEL, a intensidade de coloração não foi diferente de seus respectivos controles. Esses achados levam a crer que a dose menor por um tempo menor de avaliação foi capaz de desencadear uma via de morte celular por apoptose, enquanto doses maiores ou um maior tempo de avaliação concorreram para outros mecanismos de morte celular como autólise ou necrose. O estudo de Liu et al.21 e Cheng et al.31 em cultura de células de ratos Wistar P-3 também encontraram um padrão de marcação TUNEL com o uso de cisplatina. Devarajan et al.18, aplicando o método TUNEL (ApopTagR) ainda em cultura de células do órgão de Corti, propuseram que doses menores de cisplatina promoveriam morte celular por apoptose, enquanto doses maiores conduziriam diretamente à necrose, sendo esses dois mecanismos de morte celular um continuum. Um estudo em cobaias em preparações de superfície da orelha interna evidenciou padrão TUNEL de fragmentação do DNA em células ciliadas externas e estria vascular e menos intensamente em células ciliadas internas, com o uso de 3 mg/kg de CDDP em cinco dias consecutivos32. Também esses autores identificaram, por meio de microscopia eletrônica de transmissão, outros mecanismos de lesão celular além da apoptose. Algumas células apresentavam-se com citoplasma vacuolizado e membrana citoplasmática íntegra sugerindo autólise. Outras, sinais de necrose como debris celulares e desintegração da membrana citoplasmática.
A coloração de células da cóclea dos grupos controle está provavelmente relacionada à lesão celular desencadeada pelo próprio método de remoção desse órgão via decapitação do animal.
Com isso, a apoptose faz parte dos mecanismos de lesão celular na ototoxicidade por cisplatina, dependendo da dose e do tempo de avaliação utilizados. Ainda, células em apoptose, se acompanhada sua evolução natural, poderiam ter a necrose como desfecho final.
CONCLUSÕES
A dose de cisplatina de 16 mg/kg com avaliação no terceiro dia após sua administração teve a apoptose como mecanismo de lesão coclear.
Para doses maiores de cisplatina (24 mg/kg) ou avaliação no quarto dia após sua administração, outros mecanismos de lesão diferentes da apoptose podem estar envolvidos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Griggs JJ. Reducing the toxicity of anticancer therapy: new strategies. Leuk Res. 1998;22:S27-33.
2. Jordan JA, Schwade ND, Truelson JM. Fosfomycin does not inhibit the tumoricial efficacy of cisplatinum. Laryngoscope. 1999;109:1259-62.
3. Williams CJ, Whitehouse JM. A. Cis-paltinum: a new anticancer agent. Br Med J. 1979;23:1689-91.
4. Guneri EA, Serbetçiogllu B, Ikiz AO, Guneri A, Ceryan K. Teoae Monitoring of cisplatin induced ototoxicity in guinea pigs: the protective effect of vitamin B treatment. Auris Nasus Larynx. 2001;28:9-14.
5. Feghali JG, Liu W, Weter, TRV. D. L-N-acetyl-cysteine protection against cisplatin-induced auditory neuronal and hair cell toxicity. Laryngoscope. 2001;111:1147-55.
6. Borges GC, Borges RHM, Baraúna GN, Lopes Filho O. Ototoxicidade causada pela cisplatina em crianças. Estudo retrospectivo. Rev Bras Otorrinolaringol. 2001;67(3):292-5.
7. Strauss M, Towfighi J, Lipton A, Brown B, Lord S, Harvey H. Cisplatinum ototoxicity: clinical experience and temporal bone histopathology. Laryngoscope. 1983;93:1554-9.
8. Schaefer SD, Post JD, Close LG, Wright CG. Ototoxicity of low- and moderate-dose cisplatin. Cancer. 1985;56:1934-9.
9. Laurell G, Jungelius U. High dose cisplatin treatment: hearing loss and plasma concentrations. Laryngoscope. 1990;100:724-34.
10. Kopelman J, Budnick AS, Kramer MB, Sessions RB, Wong GYB. Ototoxicity in high-dose cisplatin by bolus administration in patients with advanced cancers and normal hearing. Laryngoscope. 1998;98:858-64.
11. Kopke RD, Liu W, Gabaizadeh R, Jacono A, Feghali J, Spray D, et al. Use of organotypic cultures of Corti's organ to study the protective effects of antioxidant molecules on cisplatin-induced damage of auditory hair cells. Am J Otolaryngol. 1997;18:559-71.
12. Zhang JG, Zhong LF, Zhang M, Xia YX. Protection effects of procaine on oxidative stress and toxicities of renal cortical slices from rats caused by cisplatin in vitro. Arch Toxicol. 1992;66(5):354-8.
13. Rybak LP, Ravi R, Somani SM. Mechanism of protection by diethyldithiocarbamate against cisplatin ototoxicity: antioxidant system. Fundam Appl Toxicol. 1995;26(2):293-300.
14. Dehne N, Lautermann J, Petrat F, Rauen U, De Groot H. Cisplatin Ototoxicity: involvement of iron and enhanced formation of superoxide anion radicals. Toxicol Appl Pharmacol. 2001;174:27-34.
15. Clerici WJ, Hensley K, Dimartino DL, Butterfield DA. Direct detection of ototoxicant-induced reactive oxygen species generation in cochlear explants. Hear Res. 1996;98(1-2):116-24.
16. Labbé D, Teranishi M, Hess A, Bloch W, Michel O. Activation of caspase-3 is associated with oxidative stress in the hydropic guinea pig cochlea. Hear Res. 2005;202:21-7.
17. Huang T, Cheng AG, Stupak H, Liu W, Kim A, Staecker H, et al. Oxidative stress-induced apoptosis of cochlear sensory cells: otoprotective strategies. Int J Dev Neurosci. 2000;18:259-70.
18. Devarajan P, Savoca M, Castaneda MP, Park MS, Esteban-Cruciani N, Kalinec G, et al. Cisplatin-induced apoptosis in auditory cells: role of death receptor and mitochondrial pathways. Hear Res. 2002;174(1-2):45-54.
19. Boulikas T, Vougiouka M. Cisplatin and platinum drugs at the molecular level (review). Oncol Rep. 2003;10:1663-82.
20. Van Rujven MWM, De Groot JCMJ, Hendriksent F, Smoorenburg GF. Immunohistochemical detection of platinated DNA in the cochlea of cisplatin-treated guinea pigs. Hear Res. 2005a;203:112-21.
21. Liu W, Staecker H, Stupak H, Malgrange B, Lefebvre P, Van De Water TR. Caspase inhibitors prevent cisplatin-induced apoptosis of auditory sensory cells. Neuroreport. 1998; 9(11):2609-14.
22. Cheng PW, Liu SH, Hsu CJ, Lin-Shiau SY. Correlation of increase activities of Na+, K+-ATP-ase and Ca2+-ATPase with the reversal of cisplatin ototoxicity induced by D-methionine in guinea pigs. Hear Res. 2005;205:102-9.
23. Watanabe K, Hess A, Michel O, Yagi T. Nitric oxide synthase inhibitor reduces the apoptotic change in the cisplatin-treated cochlea of guinea pigs. Anti-Cancer Drugs. 2000;11:731-5.
24. Alam SA, Ikeda K, Oshima T, Suzuki M, Kawase T, Kikuchi T, et al. Cisplatin-induced apoptotic cell death in Mongolian gerbil cochlea. Hear Res. 2000;141:28-38.
25. Wang J, Ladrech S, Pujol R, Brabet P, Van De Water TR, Puell JL. Caspase inhibitors, but not c-Jun NH2-terminal kinase inhibitor treatment, prevent cisplatin-induced hearing loss. Cancer Res. 2004;64(24):9217-24.
26. Church MW, Kaltenbach JA, Blakley BW, Burgio DL. The comparative effects of thiossulfate of sodium, diethylditiocarbamate, fosfomycin and WR-2721 on ameliorating cisplatin-induced ototoxicity. Hear Res. 1995;86(1-2):195-203.
27. Wu YJ, Muldoon LL, Neuwelt EA. The chemoprotective agent N-acetylcysteine blocks cisplatin-induced apoptosis through caspase signaling pathway. J Pharmacol Exp Ther. 2005;312(2):424-31.
28. Minami SB, Sha SH, Schacht J. Antioxidant protection in a new animal model of cisplatin-induced ototoxicity. Hear Res. 2004;198(1-2):137-43.
29. Kalkanis JK, Whitworth MA, Rybak LP. Vitamin E reduces cisplatin ototoxicity. Laryngoscope. 2004;114(3):538-42.
30. Dickey DT, Muldoon LL, Kraemer DF, Neuwelt EA. Protection against cisplatin-induced ototoxicity by N-acetylcysteine in a rat model. Hear Res. 2004;193:25-30.
31. Cheng AG, Huang T, Stracher A, Kim A, Liu W, Malgrange B, et al. Calpain inhibitors protect auditory sensory cells from hypoxia and neurothophin-wiythdraw induced apoptosis. Brain Res. 1999;850(1-2)234-43.
32. Wang RV, Faulconbridge L, Fetoni A, Guitton MJ, Pujol R, Puel JL. Local application of sodium thiosulfate prevents cisplatin-induced hearing loss in the guinea pig. Neuropharmacology. 2003;45:380-93.
1 Doutor, Professor Adjunto da Disciplina de Otorrinolaringologia da Faculdade de Medicina da Universidade Federal do Ceará.
2 Mestranda, Professora Substituta de Otorrinolaringologia da Faculdade de Medicina da Universidade Federal do Ceará.
3 Doutora, Professora Associada da Disciplina de Histologia do Departamento de Morfologia da Faculdade de Medicina da Universidade Federal do Ceará.
4 Doutora, Pesquisadora do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará.
5 Estudante de Medicina da Universidade Federal do Ceará.
6 Estudante de Medicina da Universidade Federal do Ceará.
7 Doutor, Professor Associado do Departamento de Fisiologia e Farmacologia da Universidade Federal do Ceará. Chefe do Laboratório de Fisiologia da Inflamação e do Câncer, LAFICA.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 22 de julho de 2008. cod. 5954
Artigo aceito em 18 de fevereiro de 2009.