Ano: 2009 Vol. 75 Ed. 5 - Setembro - Outubro - (6º)
Seção: Artigo Original
Páginas: 654 a 659
Análise da concentração do ácido hialurônico nas pregas vocais de ratas durante o ciclo estral e ciclo gravídico-puerperal
Analysis of hyaluronic acid concentration in rat vocal folds during estral and gravidic puerperal cycles
Autor(es): José Eduardo de Sá Pedroso1, Osíris Camponês do Brasil2, João Roberto Maciel Martins3, Helena Bociane Nader4, Manuel de Jesus Simões5
Palavras-chave: cordas vocais, hormônios, laringe, ácido hialurônico.
Keywords: vocal cords, hormones, larynx, hyaluronic acid.
Resumo:
Os hormônios exercem importante influência sobre a laringe. A prega vocal contém, entre outras substâncias, o ácido hialurônico, cuja concentração nos tecidos pode variar com a ação dos hormônios. Objetivo: O objetivo deste trabalho é analisar comparativamente a concentração do ácido hialurônico nas pregas vocais de ratas durante o ciclo estral e ciclo gravídico-puerperal. Forma de Estudo: Experimental. Material e Método: Foram utilizadas 40 ratas adultas, divididas em dois grupos, no primeiro grupo utilizamos 20 ratas para determinação da concentração do ácido hialurônico no ciclo estral, no segundo grupo, também de 20 animais, foi realizado o mesmo experimento no ciclo gravídico-puerperal. Resultados: No grupo do ciclo estral não observou-se variação da concentração do ácido hialurônico. No grupo do ciclo gravídico-puerperal houve aumento da concentração do ácido hialurônico no subgrupo do puerpério. Na comparação entre os dois grupos do ciclo estral e gravídico-puerperal não houve diferença. Quando comparamos todos os subgrupos há diferença no grupo do puerpério. Conclusões: Comparando-se todos os subgrupos do ciclo estral e ciclo gravídico-puerperal, só no puerpério houve aumento da concentração do ácido hialurônico.
Abstract:
Hormone plays an important role in the larynx. Among other substances, vocal folds contain hyaluronic acid, which tissue concentration may vary according to hormone action. Aim: the objective of this study is to analyze hyaluronic acid concentration in the vocal folds during estral and gravidic-puerperal cycles. Materials and Methods: Experimental study. 40 adult rats were divided into two groups. In the first group we used 20 rats to establish the concentration of hyaluronic acid during the estral cycle and in the second group, 20 animals were submitted to the same procedure but during the gravidic-puerperal cycle. Results: Variations in hyaluronic acid concentration was not observed during the estral cycle. In the gravidic puerperal cycle group, an increase in hyaluronic acid concentration was observed in the puerperal subgroup. Comparing the two groups of estral and gravidic-puerperal cycles, no difference was observed. Conclusions: In comparing all subgroups of estral and gravidic-puerperal cycles, an increase in hyaluronic acid concentration was noticed only in the puerperal phase.
![]()
INTRODUÇÃO
Os hormônios exercem importante influência sobre a laringe. As modificações laríngeas não se limitam apenas aos períodos da puberdade, andropausa e menopausa elas ocorrem durante toda a vida do indivíduo. As mudanças vocais na mulher, associadas aos hormônios sexuais, são muito comuns na prática clínica e têm sido investigadas em alguns períodos, como: pré-menstrual, gravidez, e menopausa. Segundo Greene & Dalton1, no período pré-menstrual, quando os níveis de estrógeno e progesterona estão mais baixos, ocorre um leve espessamento das pregas vocais (PPVV). O impacto hormonal se dá não somente sobre o trato genital, mas também sobre as mucosas, os músculos, os tecidos ósseos, a laringe e o córtex cerebral (Abitbol et al., 1999)2. A atividade da progesterona e do estrógeno no período pré-menstrual causa vasodilatação, aumentando o volume de sangue e resultando em edema da prega vocal3 (PV). As variações que observamos nas pregas vocais macroscopicamente devido a estes hormônios refletem alterações que acontecem ao nível microscópico e ultraestrutural. Com o desenvolvimento de métodos mais sensíveis, podemos detectar e analisar as substâncias que participam deste fenômeno.
A vibração das pregas vocais depende, entre outras coisas, do tamanho e da composição da lâmina própria (LP). Entre as substâncias que compõem a matriz extracelular (MEC) desta região, estão os glicosaminoglicanos (GAGs) e proteínas fibrosas (Hirano, 1981)4. Pequenas alterações quantitativas nas macromoléculas que formam a MEC são capazes de determinar impactos negativos, nas propriedades biomecânicas das PPVV. O AH é um GAG e um dos principais componentes da LP. Sua influência nas propriedades biomecânicas das PPVV foi demonstrada por Gray et al. (1999)5 e Chan et al. (2001)6. O ácido hialurônico (AH) foi citado pela primeira vez na literatura médica por Meyer & Palmer7 em 1934. Eles isolaram um polissacarídeo ácido com alto peso molecular do humor vítreo de boi, que não era sulfatado. Propuseram que seu nome fosse acido hialurônico, de "hialoide" (vítreo), mais ácido urônico.
Tateya et al. (2005)8 afirmaram em seu experimento, utilizando como modelo animal o rato, que sua LP é mais parecida com a do homem, sendo este animal mais indicado para se fazer estudos das PPVV.
Segundo Santos & Ferrazoli9 (2005) os períodos reprodutivos podem ser classificados como ciclos estrais contínuos ou estacionais. O ciclo estral é o período decorrente entre sucessivas fases de receptividade sexual, geralmente chamada de cio ou estro. Os ciclos podem ser monoestrais (uma vez por ano) ou poliestrais (duas ou mais vezes por ano). A duração dos ciclos estrais contínuos é específica da espécie: na rata, por exemplo, é de quatro a cinco dias; na cobaia e na ovelha, é de 16 dias no máximo; e na vaca e na porca, é de no máximo 21 dias. As fases da função ovariana foram divididas em estágios, que são correlacionados com a citologia da vagina. Na rata estas fases são: proestro, estro, metaestro e diestro. O conhecimento da relação entre a citologia vaginal e a função ovariana propiciou a fisiologistas e bioquímicos um poderoso instrumento experimental.
O objetivo deste trabalho é analisar comparativamente a concentração do ácido hialurônico nas pregas vocais de ratas, durante o ciclo estral e o ciclo gravídico-puerperal.
MATERIAL E MÉTODO
Depois de realizado projeto do trabalho, este foi enviado para o comitê de ética, que aprovou o trabalho sob o número 1234/06.
Foram utilizadas 32 ratas (sp-wistar) adultas, com cerca de 250 gramas Os animais ficaram confinados em gaiolas plásticas com grade de metal e mantidos com alimentação e água ad libitum, com temperatura e luminosidade do ambiente controladas.
No primeiro grupo, utilizamos 16 ratas para determinação da concentração do AH no ciclo estral. Estas ratas foram selecionadas de um total de cerca de 60 ratas que foram submetidas a exame colpocitológico para determinação da fase do ciclo em que se encontravam.
O animal era contido por um técnico de laboratório, introduzindo-se na vagina uma haste com algodão embebido em solução fisiológica 0,9%. A seguir, era feito um esfregaço em uma lâmina, a qual era analisada imediatamente "a fresco", no microscópio óptico com aumento de 40 vezes. As fases do ciclo estral foram determinadas de acordo com a quantificação das células: epiteliais, cornificadas e leucócitos no exame colpocitológico. Quando havia dúvidas quanto a classificação da fase do ciclo estral o animal não era incluído no subgrupo.
Quando completamos quatro animais no subgrupo, fechamos o subgrupo (proestro, metaestro, estro e diestro), tendo o total de 16 animais no grupo (P-proestro, M-Metaestro, E-Estro e D-diestro) - Os animais foram imediatamente sacrificados.
No segundo grupo, também de 16 animais, foi realizado o mesmo experimento no ciclo gravídico-puerperal. Os animais foram divididos em subgrupos de quatro animais e sacrificados no 7°, 14° e 21° dia de prenhez e no 14° dia de puerpério. Os animais foram acasalados à noite e, na manhã seguinte foi realizado o diagnóstico de prenhez, com o encontro de espermatozoides na vagina das ratas (Hamilton & Wolfe10, 1938), e quando foram sacrificadas foi realizada a laparotomia para a verificação da presença de fetos no útero.
Aos animais foram atribuídas letras seguidas de números em algarismos romanos, de acordo com os subgrupos em que se encontravam.
Em todos os subgrupos os animais foram utilizados para o estudo da concentração do AH. Como as PPVV eram pequenas tivemos que utilizar as duas pregas vocais para os procedimentos bioquímicos nos subgrupos.
Os animais foram sacrificados usando cloridrato de tiazina (rompun®) e ketamina, com injeção intraperitoneal, em dose letal.
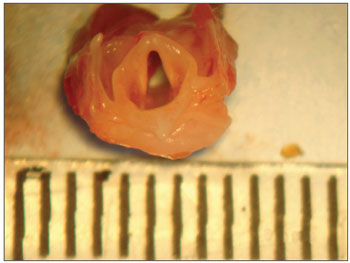
Após o sacrifício dos animais foi realizada a retirada de suas pregas vocais, com microscópio cirúrgico (DF Vasconcelos) na sala de dissecção. O animal foi colocado em decúbito dorsal, e não foi necessário tricotomia. A incisão foi realizada com bisturi lâmina 15 no plano sagital mediano, na altura do osso hioide até o início da região abdominal. Em seguida, foi dissecada a musculatura pré-tiroidea, individualizada a traqueia e separada do esôfago, depois dissecamos a região da cartilagem tireoidea. Retiramos a peça, com limite inferior na altura do segundo ou terceiro anel traqueal e superior na altura do osso hioideo. A seguir, a peça foi "limpa" de modo que só ficamos com a laringe (Figura 1), a qual foi colocada na posição anatômica e feita incisão mediana posterior em toda a superfície. Ficamos então com duas hemilaringes. Localizamos as pregas vocais e realizamos incisão superior e inferior na PV, com bisturi delicado, para fazer a retirada das PPVV, com o cuidado de não incluirmos as cartilagens aritenoideas nesta peça.
Figura 1. Detalhe da laringe da rata.
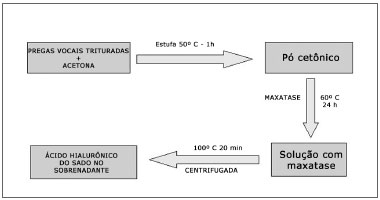
As pregas vocais de cada animal foram trituradas e colocadas em acetona, para remoção dos resíduos lipídicos. A acetona foi evaporada após período de 1 hora em estufa a 50°C e foi obtido o "pó cetônico", que foi pesado. Ao pó cetônico foi adicionado maxatase (protease alcalina; Biocon do Brasil Industrial Ltda-RJ, Brasil) na dosagem de 4 mg/ml em tampão Tris-HCL 0,05M em pH-8,0, acrescido de NaCl 1 M (100 µl de enzima para cada 100 mg de pó seco). A mistura foi incubada a 60°C por 24 horas e, após este período, a maxatase foi inativada por aquecimento a 100°C, durante 20 minutos. Após resfriamento, as amostras foram centrifugadas e o AH foi dosado no sobrenadante (Figura 2).
Figura 2. Esquema de preparo da amostra para estudo bioquímico.
Utilizamos um método fluorimétrico para a determinação do AH em fluidos biológicos, utilizando "sondas" de ligação do AH. A sonda é isolada de cartilagem nasal bovina e é constituída da região globular do agregam (um proteoglicano formado por um esqueleto proteico ao qual se ligam cadeias de queratam sulfato e condroitim sulfato) e da proteína de ligação do AH. A sonda é usada tanto imobilizada em placas de ELISA, à semelhança de um anticorpo de captura, como sonda biotinilada, funcionando nesse último caso como anticorpo secundário marcado.
À placa de ELISA com sonda adsorvida foram adicionados 100 µl/poço de soluções de AH padrão em várias concentrações (0 a 500 ?g/l), diluídas no tampão de ensaio Tris-HCL 0,05 M, pH 7,75 e BSA 1% (albumina bovina sérica), além das soluções das amostras obtidas dos tecidos diluídas no mesmo tampão de ensaio (1:100), em triplicatas. Foi realizada a incubação a 4°C por 12 horas, sendo a placa então lavada com tampão de lavagem (Tris-HCL 0,05 M, Ph 7,75) por três vezes. Em seguida foram adicionadas 100 µl da sonda (1mg/ml) 1:10000 em tampão de ensaio. A placa foi agitada por 2 horas e em seguida lavada nove vezes com tampão de lavagem. Após esta operação, foram adicionados à placa 100 µl/poço de estreptavidina marcada com európio diluído 1:10000 em tampão de ensaio. A estreptavidina tem afinidade pela biotina conjugada à sonda. A placa foi agitada por meia hora e a seguir lavou-se com tampão de lavagem nove vezes. Por fim, com o objetivo de soltar o európio ligado à estreptavadina, adicionou-se uma solução de "enhancement", 280?l/poço, agitou-se cinco minutos e o európio livre na placa foi lido em um fluorímetro. O resultado foi obtido em ng/ml.
Os resultados dos subgrupos foram submetidos ao teste de análise de variância (ANOVA). O teste de ANOVA é indicado quando se quer comparar três ou mais grupos de informações com nível de mensuração numérica. As amostras são independentes e/ou pareadas e deseja-se saber se em médias os grupos são diferentes. Pode-se testar mais de um efeito com um único modelo.
RESULTADOS
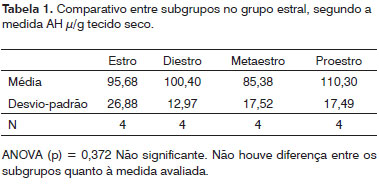
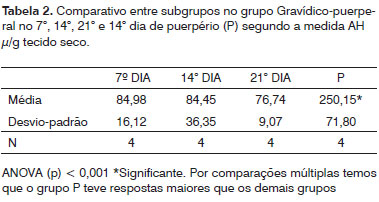
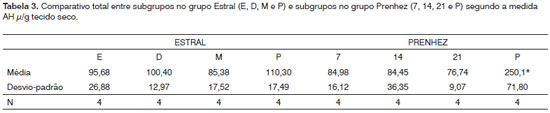
Na Tabela 1 podemos observar a comparação dos resultados entre os subgrupos do grupo do ciclo estral, na 2, comparação entre subgrupos no grupo ciclo gravídico-puerperal e no Tabela 3, comparação total entre subgrupos no grupo estral e subgrupos no grupo gravídico-puerperal.
DISCUSSÃO
Há uma grande dificuldade em se pesquisar, do ponto de vista bioquímico, a PV de cadáveres femininos quanto à fase hormonal, uma vez que geralmente seus prontuários não constam dados do ciclo menstrual e medicações usadas.
Coelhos e cães já foram utilizados em experimentos com PPVV (Rousseau11 et al., 2003; Rousseau12 et al., 2004), mas, segundo Tateya et al. (2005)8, o rato é um modelo melhor, pois a LP das suas PPVV tem características semelhantes às humanas: pode ser dividida em camadas, sendo que a profunda contém mais fibras colágenas que a superficial. Além disso, no rato, dispomos de extensa informação genética e, como ele tem um ciclo de vida curto, possibilita que diversos ciclos sejam investigados. Devido ao seu tamanho e fertilidade, é um modelo economicamente mais viável. A porção cartilagínea da laringe é cerca de cinco vezes maior no rato que no humano, fato que pode ser apontado como uma desvantagem neste modelo.
Quando determinamos o intervalo de tempo para o sacrifício dos animais no ciclo gravídico-puerperal, escolhemos a cada sete dias, pois, como a gestação da rata dura cerca de 21 dias, estamos dividindo este período em três fases iguais. Escolhemos o 14° dia de puerpério para o sacrifício, uma vez que é neste dia que começaria o desmame, e a rata voltaria a ter os mesmos estímulos que no ciclo estral.
Os métodos utilizados para a pesquisa do AH em outros trabalhos são indiretos, como demonstram Pontes13 et al. (1989), Hammond14 et al. (1997) e Butler15 et al. (2003), nos quais são utilizados reagentes para os GAGs e proteínas, sendo que, depois, é usada hialuronidase testicular, para se diferenciar onde havia presença do AH por comparação ou subtração. Ocorre que esta hialuronidase não é específica para o AH, podendo degradar também o condroitin sulfato. Portanto, nesses trabalhos, pode-se estar incluindo outras substâncias além do AH.
O método empregado para a detecção da concentração do ácido hialurônico é um dos mais sensíveis descritos na Literatura. É utilizada uma hialuronidase específica para o AH e, no método fluorimétrico, é usada uma proteína de ligação ao AH, isolada de cartilagem bovina que reconhece especificamente o AH.
Likar & Likar16 (1964), em seu estudo em células de mama e parede uterina de bovinos, encontrou um aumento dos mucopolissacarídeos e, junto com estes, a fração de hialuronato, de acordo com a fase do ciclo estral. Durante a fase chamada de folicular (diestro, proestro e estro), houve aumento do estrógeno e aumento gradativo da quantidade de hialuronato, que após a ovulação (fase lútea) volta a diminuir. Pontes13 et al. (1989) e Cubas17 (2001) realizaram trabalhos nos quais eram feitas as quantificações do AH na mucosa nasal e colo uterino de ratas, respectivamente, sendo que ambos observaram não haver variação da quantidade de AH nestes tecidos durante o ciclo estral. Na pesquisa de Likar & Likar16 (1964), o modelo animal era diferente e a técnica para a quantificação do AH também. Provavelmente estes fatores culminaram com resultados divergentes em relação aos nossos.
Em nosso trabalho não observamos variação significativa da concentração do AH nas pregas vocais de ratas durante o ciclo estral. Este resultado confirma os achados de Pontes13 et al. (1989) e Cubas17 (2001) que, em suas pesquisas, utilizaram o mesmo modelo animal, mas em tecidos diferentes, a técnica por nós utilizada para a determinação do AH foi a mesma do segundo autor.
Kofoed18 et al. (1972) demonstraram que a variação do conteúdo do AH no útero de ratas sofre a influência dos hormônios. O estrógeno faria diminuir a concentração do AH, portanto, era de se esperar que a concentração do mesmo variasse durante o ciclo estral, uma vez que o estrógeno tem seu pico durante a fase folicular e torna a diminuir logo após a ovulação. Acontece, entretanto, que o autor não realizou seu experimento com a variação fisiológica dos hormônios, tendo castrado e administrado doses diferentes de benzoato de estradiol, e, talvez por esta razão, tenha encontrado uma variação mais evidente nos seus resultados.
Pontes13 et al. (1989) observaram na sua amostra a existência de um mucopolissacarídeo ácido não-sulfatado, possivelmente o AH, que diminuía com a evolução da gravidez. Nos trabalhos de Cabrol19 et al. (1985), os tecidos estudados, provenientes de órgãos urogenitais de animais no período gestacional, são alvos mais sensíveis à ação dos hormônios, pois com a evolução da gestação temos uma diminuição do estrógeno e, como demonstrou Kofoed18 et al. (1972), isto causaria o aumento da quantidade de AH. Rajabi20 et al. (1992) e Kobayashi21 et al. (1999) estudaram o AH no soro de porcas da Guinea e em mulheres, respectivamente, encontrando um aumento do AH com a evolução da prenhez. É provável que isto ocorra por aumento na mobilização do AH nos tecidos.
Na nossa amostra não notamos variação na concentração de AH durante a prenhez. Era de se esperar que houvesse, pois Newman22 et al. (2000) demonstraram que a PV apresenta receptores para os hormônios gonadotróficos. Para explicar estes dados, podemos supor que os hormônios teriam uma ação diferente nos tecidos de órgãos urogenitais, que participam de maneira mais ativa do processo gestacional, aumentando a concentração do AH e mobilizando o AH através do sangue, enquanto nos outros tecidos sua ação seria menos evidente.
Pontes13 et al. (1989) observaram que no puerpério o mucopolissacarídeo ácido não sulfatado reaparecia. Em nosso trabalho, encontramos um aumento significativo da concentração do AH neste período. Era de se esperar que, após o parto, com a volta dos hormônios aos níveis normais, o AH também voltasse a níveis observados anteriormente. Segundo Rajabi20 (1992), os níveis do AH no soro de porcas da Guinea voltam ao normal dois dias após o parto. Verificamos que mesmo comparando com o período do ciclo estral, isto é, fora da gestação, a concentração do AH estava significativamente aumentada no puerpério, o que nos leva a crer que, provavelmente com a amamentação, outras substâncias passam a agir e podem causar mudanças na dinâmica do AH.
Talvez nossa amostra fosse pequena e, para podermos detectar variações mais substanciais, tivéssemos que usar uma amostra maior. Por outro lado, no nosso experimento, o método realizado é um dos mais sensíveis para a análise da concentração do AH.
Nosso estudo demonstrou que a concentração do AH pode variar nas pregas vocais e que, provavelmente, este fenômeno sofre a ação de muitos fatores. A importância desta substância na função fonatória nos inspira a aprofundar as pesquisas nesta área, para uma possível correlação clínica no futuro.
CONCLUSÕES
Da análise da concentração de ácido hialurônico nas pregas vocais de ratas no ciclo estral e gravídico-puerperal, podemos concluir que:
1. Não há variação da concentração do ácido hialurônico durante ciclo estral
2. No puerpério há um aumento da concentração do ácido hialurônico
3. Comparando-se todos os subgrupos do ciclo estral e ciclo gravídico-puerperal, só no puerpério há aumento da concentração do ácido hialurônico.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Grene RJ, Dalton K.The Premenstrual Syndrome. Brit Med J. 1953;1:4118-25.
2. Abitbol J, Abitbol P, Abitbol B. Sex hormones and Female voice. J Voice. 1999;13(3):424-46.
3. Satalof RT, Emerich KA, Hoover CA. Endocrine dysfunction. Em: Satalof RT, editor. Professional voice: the science and art of clinical care. 2nd ed. San Diego: Singular Publishing Group; 1997. p. 291-7.
4. Hirano M. Structure of the vocal fold in normal and disease states-anatomical and physical studies. In: Ludlow CL, Hard MO, editors. American Speech Language-Hearing Association. Proceedings of the conference on the assessment of vocal pathology; 1981; Rockville, Maryland 1981. p.11-30.
5. Gray SD, Titze IR, Cha R, Hammond TH. Vocal Fold Proteoglycans And Their Influence on Biomechanics. Laryngoscope. 1999;109(6):845-54.
6. Chan RW, Gray SD, Titze IR. The Importance of hyaluronic acid in vocal fold biomechanics. Otolaryngol Head Neck Surg. 2001;124(6):607-14.
7. Meyer K, Palmer JW. The Polysaccharide of Vitreous Humor. J Biol Chem. 1934;107:629-34.
8. Tateya T, Sohn JH, Tateya I, Bless DM. Histologic Characterization of Rat Fold Scarring. Ann Otol Rhinol Laryngol. 2005;114:183-92.
9. Santos AV, Ferrazzoli MO. Ciclo estral nos animais. [Site na internet]: Artigos científicos. Disponível em: http//www.redevet.com.br/artigos/estral1.htm. Acessado em abril de 2005
10. Hamilton JB, Wolf JM. The effect of male hormone substances upon birth and prenatal development in the rat. Anat Rec. 1938;70:433-9.
11. Rousseau B, Hirano S, Scheidt TD, Welham NV,Thibeault S, Chan RW, Bless DM. Characterization of Vocal Fold Scarring in a Canine Model. Laryngoscope. 2003;113(4):620-7.
12. Rousseau B, Hirano S, Chan RW, Welham NV,Thibeault S, Ford CN, Bless DM. Characterization of Chronic Vocal Fold Scarring in a Rabbit Model. J Voice. 2004;18(1):116-24.
13. Pontes PAL, Simões MJ, Merzel J. Histoquimic detection of glicoproteins and glycosaminoglycans on respiratory mucose of albine mouses during estral cycle and pregnant. Rev Bras Biol. 1989;49:1125-9.
14. Hammond TH, Zhou R, Hammond EH, Pawlak A, Gray SD.The intermediate layer: a morphologic Study of the elastin and hyaluronic acid constituents of normal human vocal fold. J Voice. 1997;11(1):59-66.
15. Butler JE, Hammond TH, Gray SD. Gender-related differences of hyaluronic acid distribution in the human vocal fold. Laryngoscope. 2001;111(5):907-11.
16. Likar IN, Likar JL. Acid mucopolyssacarides and mast cells in the bovine uterus at different stages of the sexual cycle. Acta Endocr. 1964;46:493-506.
17. Cubas JMC. Análise histomorfológica e caracterização dos glicosaminoglicanos no colo uterino de ratas durante o ciclo estral. [Dissertação] São Paulo (SP):Universidade Federal de São Paulo; 2002.
18. Kofoed AJ, Houssay AB, Tocci AA, Curbelo HM. Efects of oestrogens upon glycosaminoglicans in the uterus of rats. Acta Endocr. 1972;69:87-94.
19. Cabrol D, Dallot E, Cedard L, Sureau C. Pregnancy-related changes in the distribution of glycosaminoglycans in the cervix and corpus of the human uterus. Eur J Obstet Gynecol Reprod Biol. 1985;20:289-95.
20. Rajabi RM, Quillen EW, Nuwayhid BS, Brandt R, Poole AR. Circulating hyaluronic acid in nonpregnant, pregnant, and postpartum guinea pigs: Elevated levels observed at parturition. Am J Obstet Gynecol. 1992;166:242-6.
21. Kobayashi H, Sun GW, Tanaka Y, Kondo T, Terao T. Serum hyaluronic acid levels during pregnancy and labor. Obstet Gynecol. 1999;93(4):480-4.
22. Newman RS, Butler J, Hammond EH, Gray S. Preliminary Report on Hormone Receptors in Human Vocal Fold. J Voice. 2000;14(1):72-81.
1 Mestre e Doutor, Coordenador do Ambulatório de Laringe e Voz da UNIFESP-EPM.
2 Mestre e Doutor, Professor Orientador da Pós-Graduação do Departamento de Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da UNIFESP/EPM.
3 Mestre e Doutor, Professor afiliado da Disciplina de Biologia Molecular do Departamento de bioquímica da UNIFESP-EPM.
4 Mestre, Doutora e Livre Docente, Professora Titular da disciplina de Biologia Molecular do Departamento de Bioquímica da UNIFESP/EPM.
5 Livre-Docente, Professor Associado da Disciplina de Histologia do Departamento de Morfologia da UNIFESP/EPM.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 29 de maio de 2008. cod. 5869
Artigo aceito em 7 de outubro de 2008.