Ano: 2009 Vol. 75 Ed. 4 - Julho - Agosto - (2º)
Seção: Artigo Original
Páginas: 476 a 484
Avaliação da sensibilidade das emissões otoacústicas produtos de distorção e dos potenciais auditivos evocados de tronco encefálico na ototoxicidade por cisplatina em ratos
Distortion-product otoacoustic emissions and auditory brainstem responses sensitivity assessment in cisplatin-induced ototoxicity in rats
Autor(es): Marcos Rabelo de Freitas1, Viviane Carvalho da Silva2, Gerly Anne de Castro Brito3, José Valdir de Carvalho Junior4, Raimundo Martins Gomes Junior5, Ronaldo de Albuquerque Ribeiro6
Palavras-chave: audição, cisplatino, perda auditiva.
Keywords: hearing, cisplatin, hearing loss.
Resumo:
Cisplatina (cisdiaminodicloroplatinum) é um agente quimioterápico usado para o tratamento de várias linhagens de neoplasias, mormente as de cabeça e pescoço. Sua ototoxicidade permanece sendo um dos efeitos colaterais causadores de significativa morbidade e limita sua utilização. Objetivo: Avaliar a sensibilidade das emissões otoacústicas evocadas produtos de distorção (EOAPD) e potenciais auditivos evocados de tronco encefálico (PAETE) na detecção da ototoxicidade secundária a diferentes doses e formas de administração de cisplatina em ratos. Forma de Estudo: Experimental. Material e Método: Ratos Wistar machos, administrou-se cisplatina por via intraperitoneal (IP) nas doses de 24 mg/kg, fracionada em três doses diárias ou 16 mg/kg em infusão única. Avaliaram-se os animais através de EOAPD ou PAETE no terceiro (D3) e quarto (D4) dias após o início da infusão das drogas. Resultados: O grupo tratado com 24 mg/kg mostrou diminuição significativa da amplitude das EOAPD e aumento do limiar eletrofisiológico pelo PAETE. A dose de 16 mg/kg não foi capaz de promover redução significativa da amplitude das EOAPD, mas elevou o limiar auditivo dos animais, detectado através de PAETE. Conclusão: Em ratos, os PAETE foram mais sensíveis que as OEAPD na detecção da ototoxicidade por cisplatina para diferentes doses e formas de administração.
Abstract:
Cisplatin (cis-diamminedicloroplatinum) is an antineoplastic drug used in the treatment of a variety of cancers, especially head-and-neck cancer. Its ototoxicity, however, has been noted as a common side-effect which limits its use and causes significant morbidity. Aim: to assess distortion-product otoacoustic emissions (DPOAE) and brainstem evoked response audiometry (BERA) sensitivity to detect secondary ototoxicity caused by different doses and means of administration of cisplatin in rats. Study Design: Experimental. Material and Methods: Male Wistar rats were intraperitoneally (i.p.) injected with 24 mg/kg cisplatin, divided into three equal doses (8mg/kg) or a single i.p. injection of 16 mg/kg. The animals were evaluated by distortion product otoacoustic emission (DPOAE) or brainstem evoked response audiometry (BERA) on the 3rd and 4th days after the cisplatin injection. Results: Treatment with cisplatin 24 mg/kg resulted in significant DPOAE decrease and it raised the BERA electrophysiological threshold. The 16mg/kg dose could not significantly reduce the DPOAE amplitude, but it raised the animals' hearing thresholds - detected by the BERA. Conclusion: In rats, BERA was more sensitivity than DPOAE at detecting cisplatin-induced ototoxicity in rats considering different doses and means of administration.
![]()
INTRODUÇÃO
Cisplatina (cisdiaminodicloroplatinum - CDDP) é um agente quimioterápico frequentemente usado para o tratamento de várias linhagens de neoplasias, mormente as de cabeça e pescoço(1). Seus efeitos colaterais incluem ototoxicidade, nefrotoxicidade, supressão medular e distúrbios gastrointestinais(2). Estes tipos de toxicidade podem interferir com o tratamento ao reduzir a dosagem, frequência e duração da quimioterapia em muitos pacientes(3).
A incidência da toxicidade por cisplatina parece variar entre 4 e 50%(4-6). O grau de perda de audição depende da dose e da frequência de administração desse agente. A administração em bolo em adultos causa danos ototóxicos mais intensos(7). Outros fatores que influenciam o grau de perda auditiva incluem idade (crianças e idosos são mais susceptíveis), maior número de ciclos quimioterápicos, ingesta prévia de outras drogas como furosemida e ácido etacrínico, presença associada de disfunção renal e susceptibilidade individual(8,9). Em adição, devido ao estoque de cisplatina no corpo durante anos, uma deficiência auditiva progressiva pode permanecer mesmo após a suspensão do tratamento(10).
Estudos em animais têm demonstrado que a administração de cisplatina resulta em degeneração do órgão espiral de Corti, com perda completa ou parcial de células ciliadas externas e, esporadicamente, de células ciliadas internas(11,12). Em adição aos efeitos ototóxicos da cisplatina sobre o órgão de Corti, há evidências de comprometimento da estria vascular(12-22), gânglio espiral(12,17-19,23,24) e membrana vestibular de Reissner(12,25,26).
Diferentes doses e formas de administração são utilizadas para atingir os efeitos ototóxicos em roedores.
A via de administração mais comumente empregada é a intraperitoneal (IP). É bem conhecido que os efeitos crônicos da cisplatina são menos pronunciados que os efeitos agudos(15).
São diversas as maneiras de se avaliar o comprometimento funcional da audição em animais de laboratório, variando desde métodos simples como o reflexo de Preyer(27), até métodos mais sofisticados e dispendiosos como os potenciais auditivos evocados de tronco encefálico(28- 30), eletrococleografia(12,17) e emissões otoacústicas evocadas(2,30-32). As emissões otoacústicas (EOA) e os potenciais auditivos evocados de tronco encefálico (PAETE), com larga aplicação na prática clínica, são os métodos ultimamente mais empregados para estudo da ototoxicidade por cisplatina em roedores.
O objetivo deste estudo foi avaliar a sensibilidade das emissões otoacústicas evocadas produtos de distorção (EOAPD) e potenciais auditivos evocados de tronco encefálico (PAETE) na detecção da ototoxicidade secundária a diferentes doses e formas de administração de cisplatina em ratos.
MATERIAL E MÉTODOS
Foram utilizados para o estudo ratos Wistar machos com peso variando entre 200 e 348g, mantidos em gaiolas com livre acesso a alimentos e água, em ciclos naturais de sono e vigília, e manuseados segundo as normas preconizadas pelo Colégio Brasileiro de Experimentação Animal (COBEA), encontradas no sítio www.cobea.org.br.
O projeto foi submetido à aprovação pelo Comitê de Ética em Pesquisa em Animais (CEPA) tendo sido aprovado sob número de protocolo 28/05.
Foram excluídos do experimento: animais com sinais ao exame otoscópico de doença de orelha externa, tais como, edema e hiperemia de conduto auditivo externo, tumorações ou rolha de cerume impactada; animais com sinais de doença da orelha média, tais como opacificação, abaulamento e hiperemia de membrana timpânica, ou perfuração dessa membrana; animais com emissões otoacústicas produtos de distorção ausentes em alguma das frequências estudadas (3, 4, 6 e 8 kHz), antes da administração das drogas; animais com limiar eletrofisiológico estabelecido por potencial auditivo evocado de tronco encefálico maior que 10 dB NA, antes do início da administração das drogas.
As drogas utilizadas no estudo foram: Cisplatina (Cisplatex® -Eurofarma 50 mg. Brasil): pó liofilizado para solução injetável. Preparo: 50 mg do pó liofilizado diluídos em 50 ml de solução salina, constituindo uma concentração final de 1 mg/ml; Solução salina fisiológica 0,9%; Ketamina (Vetarnacol®- Laboratório König 50mg/ ml. Brasil); Xilazina (Kensol®- Laboratório König 20 mg/ml. Brasil).
Os animais foram divididos em 12 grupos, listados a seguir, onde n significa o número de ratos de cada grupo: Grupo1 (CDDP 24 D3 EOAPD) (n=11): ratos tratados com cisplatina na dose de 8 mg/kg/dia em 3 dias consecutivos (total de 24 mg/kg) e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 2 (C 24 D3 EOAPD) (n=6): ratos tratados com solução salina na dose de 8 ml/kg/dia em 3 dias consecutivos (total de 24 ml/kg) e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 3 (CDDP 24 D4 EOAPD) (n=8): ratos tratados com cisplatina na dose de 8 mg/kg/dia em 3 dias consecutivos (total de 24 mg/kg) e avaliados antes do tratamento (D0) e quatro dias (D4) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 4 (C 24 D4 EOAPD) (n=6): ratos tratados com solução salina na dose de 8 ml/kg/dia em 3 dias consecutivos (total de 24 ml/kg) e avaliados antes do tratamento (D0) e no 4o dia após o seu início (D4) por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 5 (CDDP 16 D3 EOAPD) (n=12): ratos tratados com cisplatina em dose única de 16 mg/kg/dia e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 6 (C 16 D3 EOAPD) (n=5): ratos tratados com solução salina em dose única de 16 ml/kg/dia e avaliados antes do tratamento (D0) e três dias (D3) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 7 (CDDP 16 D4 EOAPD) (n=7): ratos tratados com cisplatina em dose única de 16 mg/kg/dia e avaliados antes do tratamento (D0) e quatro dias (D4) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 8 (C 16 D4 EOAPD) (n=6): ratos tratados com solução salina em dose única de 16 ml/kg/dia e avaliados antes do tratamento (D0) e quatro dias (D4) após o seu início por emissões otoacústicas evocadas produtos de distorção (EOAPD).
Grupo 9 (CDDP 24 PAETE) (n=11): ratos tratados com cisplatina na dose de 8 mg/kg/dia em 3 dias consecutivos (total de 24 mg/kg) e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Grupo 10 (C 24 PAETE) (n=7): ratos tratados com solução salina na dose de 8 ml/kg/dia em 3 dias consecutivos (total de 24 ml/kg) e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Grupo 11 (CDDP 16 PAETE) (n=12): ratos tratados com cisplatina em dose única de 16 mg/kg/dia e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
Grupo 12 (C 16 PAETE) (n=8): ratos tratados com solução salina em dose única de 16 ml/kg/dia e avaliados antes do tratamento (D0), três (D3) e quatro dias (D4) após o seu início por potenciais auditivos evocados de tronco encefálico (PAETE).
O procedimento completo constituiu-se de 2 experimentos: No experimento 1, ratos Wistar foram submetidos a anestesia profunda com ketamina 50 mg/kg associada a xilazina 10 mg/kg. Uma otoscopia prévia foi realizada eliminando-se os animais com sinais de afecções de orelha externa ou média, como detalhado nos critérios de exclusão. Aqueles com otoscopia normal se submeteram a exame de emissões otoacústicas evocadas produtos de distorção (EOAPD), imediatamente antes da administração das drogas. Nos grupos cisplatina 8 mg/kg em 3 dias consecutivos ou solução salina 8 ml/kg em 3 dias consecutivos, as drogas eram injetadas por via intraperitoneal logo após a conclusão da avaliação auditiva. Nos dois dias subsequentes, depois de nova pesagem dos ratos, cisplatina 8 mg/kg ou solução salina 8 ml/kg eram novamente administradas, para resultar em uma dose final respectivamente de 24 mg/kg e 24 ml/kg. Vinte e quatro (D3) ou 48h (D4) depois da última administração, os ratos eram novamente anestesiados, era realizada uma outra otoscopia para descartar aqueles que adquiriram doenças de orelha média ou externa durante o período de administração das drogas, e eram submetidos a nova avaliação auditiva por EOAPD. Nos grupos em que a cisplatina foi injetada por via intraperitoneal na dose única de 16 mg/kg e a salina 16 ml/kg, utilizou-se uma bomba de infusão de marca Kd Scientific série 100 para que o tempo de infusão fosse fixado em 30min. Quando necessário, nova dose dos anestésicos era injetada. A avaliação auditiva também foi realizada no terceiro (D3) ou quarto (D4) dias após a administração das drogas.
No experimento 2, os animais foram submetidos aos mesmos procedimentos de anestesia, otoscopia e injeção de drogas relatados no primeiro experimento. A avaliação auditiva foi realizada por meio de PAETE (potencial auditivo evocado de tronco encefálico), tendo o mesmo grupo de animais se submetido ao exame imediatamente antes e no terceiro e quarto dias após a administração das drogas.
As EOAPD foram realizadas com aparelho de emissões otoacústicas de marca MADSEN Capella - GN Otometrics, em ambiente silencioso. Aos ratos anestesiados, em seu conduto auditivo externo direito, foi acoplada a sonda do aparelho através de sondas para exame de recém-nascido. O estímulo consistiu de 2 tons puros (F1 e F2) cuja relação de frequência F1/F2 foi igual a 1,22. A intensidade dos estímulos foi fixada em 70 dB NPS. Foi analisado um total de 1000 aquisições. As emissões otoacústicas resultantes foram avaliadas nas frequências de 3, 4, 6 e 8 kHz. Considerou-se a presença de EOAPD para uma relação sinal/ruído (S/R) de, no mínimo, 6 dB NPS, de acordo com as especificações técnicas do aparelho utilizado.
Utilizou-se, para realização do PAETE, aparelho Interacoustic EP 25, localizado em ambiente silencioso. Com os animais anestesiados, eletrodos subdérmicos de platina foram posicionados no vértex (positivo), região retroauricular direita (negativo) e ponta do nariz (terra). Fones de inserção ER-3A acoplados a uma sonda utilizada para avaliação auditiva de recém-nascidos foram introduzidos no conduto auditivo externo direito dos ratos. Os estímulos empregados foram cliques de rarefação, liberados a uma taxa de 15 por segundo, com um total máximo de 700 promediações e um tempo de análise de 15 mseg. A banda passante utilizada foi de 0 a 3000 Hz. Os estímulos foram iniciados em 80 dB NA e diminuídos progressivamente até o desaparecimento completo das ondas. Para o limiar auditivo eletrofisiológico, foi considerada a menor intensidade de estímulo em que se evidenciava onda II.
Foi utilizado, para confecção dos gráficos e análise estatística, o programa GraphPad Prism 4.00.255. Foi avaliada a distribuição normal da amostra através do teste de Komogorov-Smirnov. Os resultados forma expressos como média ± o erro padrão da média (MED ± EPM), para os dados contínuos, e como mediana (Md) e valores mínimo (Min) e máximo (Max) para os dados ordinais.
A significância mínima aceita foi ao nível de 5%. Os vários procedimentos experimentais foram comparados utilizando-se os seguintes testes: Teste t de Student (quando possível usado com emparelhamento): comparar as médias das amplitudes das emissões otoacústicas produtos de distorção em cada frequência antes e após tratamento; comparar as médias dos limiares eletrofisiológicos dos animais obtidos através de potencial auditivo evocado de tronco encefálico entre o primeiro (D0) e o quarto dias (D3), nos grupos controle (salina), cisplatina 24 mg/kg.
Análise de Variância (ANOVA) Com a Significância Entre os Grupos Estabelecida Pelo Teste de Tukey: comparar as médias dos limiares eletrofisiológicos dos animais obtidos através de potencial auditivo evocado de tronco encefálico entre o primeiro (D0), quarto (D3) e quinto (D4) dias da avaliação; comparar as médias dos valores do intervalo I-V obtidos através de potencial auditivo evocado de tronco encefálico entre o primeiro (D0), quarto (D3) e quinto (D4) dias da avaliação.
RESULTADOS
A ototoxicidade por cisplatina foi confirmada por microscopia óptica em colorações hematoxilina-eosina (HE) (trabalho enviado para publicação).
Grupo 1 (CDDP 24 D3 EOAPD) X Grupo 2 (C 24 D3 EOAPD).
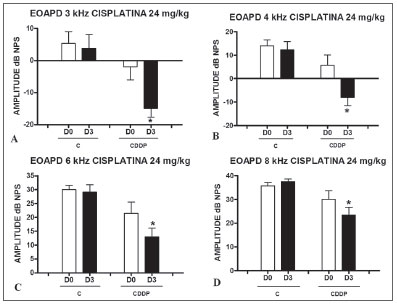
Foi encontrada uma diminuição significativa da amplitude das EOAPD nas frequências testadas (3, 4, 6 e 8 kHz) entre os dias D0 e D3, no grupo em que se administrou CDDP na dose de 24 mg/kg (Grupo 1). Essa diminuição não foi evidenciada no grupo controle. (Figura 1 A, B, C e D).
Figura 1. Gráficos dos valores da amplitude das EOAPD expressos como média ± erro padrão da média nos dias D0 e D3, dos grupos 1 e 2. Os asteriscos representam significância estatística. CDDP = cisplatina; C = controle. Gráfico A: freqüência de 3 kHz (Teste T: * p = 0,0095 - D3 x D0 CDDP). Gráfico B: freqüência de 4 kHz (Teste T: * p = 0,0073 - D3 x D0 CDDP). Gráfico C: freqüência de 6 kHz (Teste T: * p = 0,0284 - D3 x D0 CDDP). Gráfico D: freqüência de 8 kHz (Teste T: * p = 0,0338 - D3 x D0 CDDP).
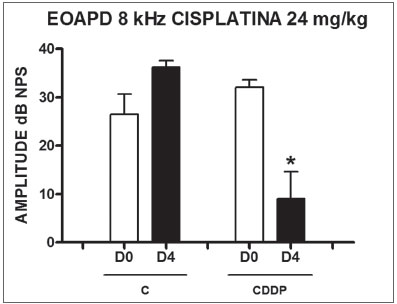
Grupo 3 (CDDP 24 D4 EOAPD) X Grupo 4 (C 24 D4 EOAPD) No grupo 3 houve uma mortalidade elevada dos animais avaliados no D4 do procedimento. Dos oito animais que receberam CDDP na dose cumulativa de 24 mg/kg, apenas 3 permaneceram vivos para realização do exame de EOAPD no D4. Destes, 2 de 3 ratos tiveram desaparecimento desaparecimento das EOAPD, comprovada por uma diferença sinal/ruído menor que 6 dB NPS, nas frequências de 3 e 4 kHz. Um animal mostrou também desaparecimento das EOAPD na frequência de 6 kHz. Na frequência de 8 kHz notou-se uma diminuição significativa da amplitude das EOAPD entre D0 e D4 (Figura 2).
Figura 2. Gráfico dos valores da amplitude das EOAPD expressos como média ± erro padrão da média nos dias D0 e D4, dos grupos 3 e 4 na freqüência de 8 kHz. O asterisco representa significância estatística. CDDP = cisplatina; C = controle. Teste T: * p = 0,0459 (D4 x D0 CDDP).
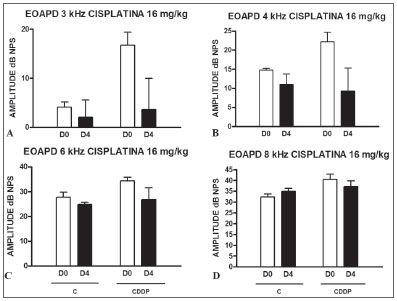
Grupo 5 (CDDP 16 D3 EOAPD) X Grupo 6 (C 16 D3 EOAPD) Com a dose de 16 mg/kg de CDDP, não foi possível identificar diminuição estatisticamente significativa das amplitudes médias das EOAPD entre D0 e D3, em todas as frequências estudadas (p > 0,05) (Figura 3 A, B, C e D).
Figura 3. Gráficos dos valores da amplitude das EOAPD expressos como média ± erro padrão da média nos dias D0 e D3, dos grupos 5 e 6. CDDP = cisplatina; C = controle. Não houve significância estatística em nenhum dos grupos (Teste T: p > 0,05).
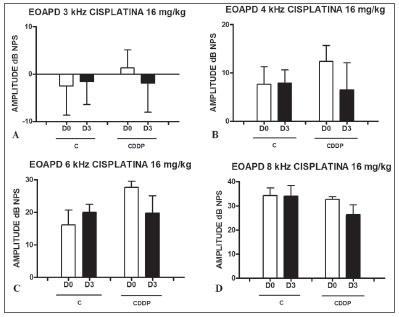
Grupo 7 (CDDP 16 D4 EOAPD) X Grupo 8 (C 16 D4 EOAPD) Assim como na avaliação de 3 dias, com a dose de 16 mg/kg de CDDP, não foi possível identificar diminuição estatisticamente significativa das amplitudes médias das EOAPD entre D0 e D4, em todas as frequências estudadas (p > 0,05) (Figura 4 A, B, C e D).
Figura 4. Gráficos dos valores da amplitude das EOAPD expressos como média ± erro padrão da média nos dias D0 e D4, dos grupos 7 e 8. CDDP = cisplatina; C = controle. Não houve significância estatística em nenhum dos grupos (Teste T: p > 0,05).
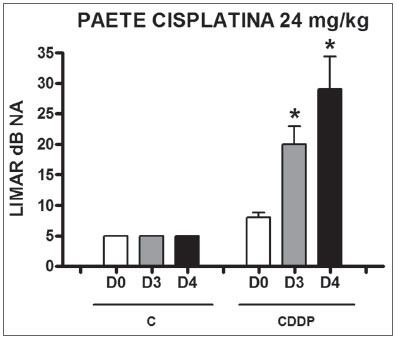
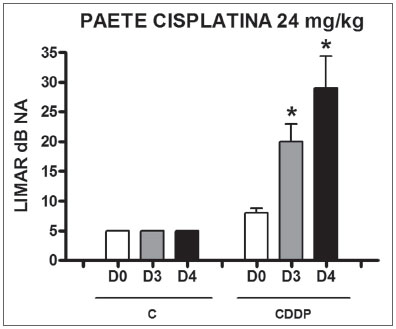
Grupo 9 (CDDP 24 PAETE) X Grupo 10 (C 24 PAETE) Houve um aumento significativo do limiar médio eletrofisiológico dos animais injetados com cisplatina 24 mg/kg no D3 e D4 quando comparados ao D0. Não foi notada diferença estatística significativa desses limiares entre D3 e D4. No grupo controle não houve elevação dos limiares eletrofisiológicos (Figura 5). Não se encontrou diferença estatística significativa do intervalo I-V entre os dias em ambos os grupos (Figura 6).
Figura 5. Gráfico dos limiares eletrofisiológicos médios nos grupos 9 e 10 em D0, D3 e D4, expressos como média ± erro padrão da média (MED ± EPM). O asterisco representa diferença estatística significativa. CDDP = cisplatina; C = controle. ANOVA - Tukey: * p < 0,01 (D3 x D0 CDDP); * p < 0,001 (D4 x D0 CDDP)
Figura 6. Gráfico do intervalo I-V médio dos animais nos grupos 9 e 10 nos dias D0, D3 e D4 expressos como média ± erro padrão da média (MED ± EPM). Não foi encontrada diferença estatística entre os dias nos 2 grupos. ANOVA p > 0,05.
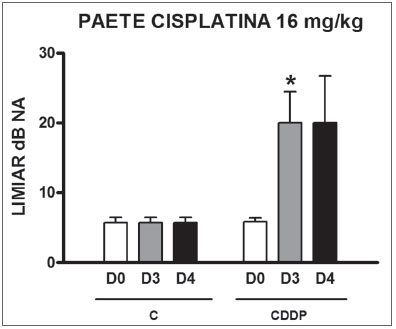
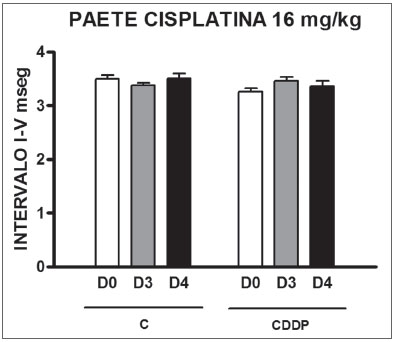
Grupo 11 (CDDP 16 PAETE) X Grupo 12 (C 16 PAETE) Foi evidenciado um aumento significativo do limiar médio eletrofisiológico dos animais injetados com cisplatina 16 mg/kg no D3 quando comparados ao D0. Não foi notada diferença estatística significativa desses limiares entre D3 e D4. No grupo controle também não houve elevação dos limiares eletrofisiológicos (Figura 7). Não se encontrou ainda diferença estatística significativa do intervalo I-V entre os dias em ambos os grupos (Figura 8).
Figura 7. Gráfico dos limiares eletrofisiológicos médios nos grupos 11 e 12 em D0, D3 e D4, expressos como média ± erro padrão da média (MED ± EPM). O asterisco representa diferença estatística significativa. CDDP = cisplatina; C = controle. ANOVA - Tukey: * p < 0,05 (D3 x D0 CDDP).
Figura 8. Gráfico do intervalo I-V médio dos animais nos grupos 11 e 12 nos dias D0, D3 e D4 expressos como média ± erro padrão da média (MED ± EPM). Não foi encontrada diferença estatística entre os dias nos 2 grupos. ANOVA p > 0,05.
DISCUSSÃO
Estabeleceu-se, neste experimento, que apenas o osso temporal direito seria utilizado para os diversos procedimentos, a fim de tornar mais homogêneo o tempo entre a remoção da cóclea e sua fixação, evitando-se ao máximo as lesões do órgão relacionadas ao método de retirada, que era realizada somente pelo autor. Os dados da avaliação morfológica por microscopia óptica serão objeto de outra publicação. Os animais submetidos a PAETE não tiveram sua cóclea removida, e portanto puderam ser avaliados no terceiro e quartos dias após o início do procedimento.
Daí serem necessários 4 grupos para avaliação por PAETE e 8 para avaliação por EOAPD.
A via de administração intraperitoneal utilizada neste estudo se mostrou efetiva para desencadear a ototoxicidade nas doses utilizadas. Essa é também a via sistêmica de administração vista na maioria dos experimentos de ototoxicidade com CDDP em ratos. Entretanto outras vias podem ser empregadas como a arterial(33), venosa(34), subcutânea(35) e intramuscular(15).
As EOAPD são um método de avaliação auditiva que representam a função das células ciliadas externas, um dos principais alvos de lesão da cisplatina(36). O protocolo de realização de EOAPD nos experimentos animais tem pouca variabilidade, com a maior controvérsia girando em torno de se manter uma intensidade de estímulo F1 e F2 constante(30,32) ou variável(36,37) para a forma de aquisição tipo DPgram. As frequências possíveis de serem estudadas através de EOAPD variam entre as espécies de animais.
Hyppolito et al.(32) identificaram sua presença a partir de 1,5 kHz em cobaias; Hatzopoulos et al.(37), estudando-as em ratos Sprague-Dawley, além de 4 kHz; Lopez-Gonzalez et al.(36), em ratos Wistar, identificaram-nas entre 1 e 6 kHz; Sockalingan et al.(30), em ratos albinos, entre 2 e 8 kHz para uma relação sinal/ruído > 3 dB NPS. McAlpine e Johnstone(38) constataram ototoxicidade por CDDP através de EOAPD com aquisição no formato I/O function, fixando a frequência em 8 kHz. No presente estudo, realizou-se o protocolo com intensidade fixa de 70 dB NPS obtendo-se respostas mensuráveis a partir de 3 kHz para uma relação sinal/ruído > 6 dB NPS, como determinado pelas especificações técnicas do aparelho utilizado (Madsen-Capella).
Neste estudo, somente a dose de 24 mg/kg foi capaz de desencadear ototoxicidade por cisplatina mensurável por EOAPD em todas as frequências estudadas. Com a avaliação no D3, diferente do grupo controle, houve uma redução significativa na amplitude das EOAPD no grupo tratado. No D4 se viu um desaparecimento das respostas ou diminuição de sua amplitude. Nos animais tratados com 16 mg/kg, apesar de se evidenciar uma redução das EOAPD nas frequências de 3, 4, 6 e 8 kHz após tratamento com CDDP tanto no D3 como no D4, não foi possível demonstrar significância estatística. Isto pode ser explicado pela grande variabilidade individual de respostas à ototoxicidade por CDDP em ratos para doses > 15 mg/ kg em infusão em bolo, tendo como consequência maior desvio padrão da amplitude das emissões otoacústicas nas amostras, diminuindo o poder dos testes estatísticos.
Esta variabilidade é acompanhada de graus diversos na concentração plasmática da droga quando administrada por via venosa ou intraperitoneal(37). Sockalingam et al.(30) também não evidenciaram redução significativa das EOAPD em ratos após 72h para dose de 12 mg/kg de CDDP.
Hatzopoulos et al.(37) encontraram uma redução significativa na relação sinal/ruído (S/R) das EOAPD para as frequências de 6,34, 7,13 e 7,56 kH, não evidenciando para 4, 5 ou 8 kHz. Ressalte-se que, neste último experimento, o parâmetro avaliado foi a relação S/R e não a amplitude isolada das emissões otoacústicas. Lopez-Gonzalez et al.(36), utilizando dose menor de CDDP (10 mg/kg), notaram uma redução significativa das EOAPD de ratos Wistar entre 1 e 6 kHz a partir do sétimo dia de avaliação, com recuperação aos valores iniciais após 30 dias. Hyppolito et al.(31), em seu estudo com a dose de 24 mg/kg em cobaias albinas, encontraram desaparecimento das EOAPD em 100% dos animais tratados e avaliados terceiro dia após o seu início. Não se encontraram estudos em ratos com a dose de 24 mg/kg de CDDP. Os trabalhos que mostraram redução das EOPAD após tratamento com CDDP em ratos, ou utilizaram um tempo maior de avaliação com doses menores(36) ou tiveram como parâmetro de avaliação não a amplitude das EOAPD, mas a relação S/R37. Este tipo de análise aumenta o viés do experimento, já que o ruído detectado no conduto auditivo externo dos animais pode ser influenciado por fatores externos como o nível de ruído do ambiente ou ruídos provenientes do próprio indivíduo, como os ruídos respiratórios(39). Por isso, no presente estudo, optou-se pela avaliação da amplitude das EOAPD e não da relação S/R, por um período de no máximo 96h pós-tratamento, devido à grande mortalidade dos animais além desse tempo com as doses de 16 ou 24 mg/kg.
Dessa forma, no presente estudo, as EOAPD foram capazes de identificar ototoxicidade pela cisplatina em ratos apenas com a dose de 24 mg/kg.
Os potenciais auditivos evocados de tronco encefálico têm sido largamente empregados para estudo da ototoxicidade por cisplatina em roedores(22,28-30,33-35,37,40-50).
Entretanto, não há uma padronização da técnica de exame entre os diversos autores.
Neste estudo, conseguiu-se elucidar um traçado de PAETE em ratos Wistar com identificação de 5 a 7 ondas, tendo a onda II a maior amplitude. Para tanto, utilizaramse eletrodos de platina, em forma de agulha, posicionados na subderme do vértex (eletrodo positivo ou ativo), região retroauricular direita (eletrodo referência ou negativo) e ponta do nariz (eletrodo terra). O eletrodo terra pode se localizar em qualquer posição do corpo sem alterar o traçado. Já posições diferentes dos eletrodos referência e ativo tornam determinadas ondas mais ou menos evidentes51.
Amsallem e Andrieu-Guitrancourt(34) posicionaram os eletrodos entre o vértex (ativo) e a cauda (referência); Sockalingam et al.(30) entre vértex (positivo) e bochecha (negativo); Li et al.(52) entre vértex (positivo) e musculatura cervical (negativo). Vários autores de um mesmo grupo de pesquisa publicaram estudos posicionando os eletrodos no vértex (positivo) e ponta do nariz (negativo)(28,29,43-45,48,49,53).
Outros estudos, principalmente os mais recentes, localizaram os eletrodos em pontos de referência semelhantes aos utilizados neste experimento(22,33,37,42,46,50). Acredita-se que nos registros clínicos esse posicionamento seja aquele que oferece um traçado ideal do PAETE(54).
Há controvérsia em relação a como se determinar o limiar eletrofisiológico através de PAETE em ratos. Em concordância com Amsallem e Andrieu-Guitrancourt(41), este estudo evidenciou ser a onda II em ratos aquela de maior amplitude e a última a desaparecer com a diminuição da intensidade do estímulo sonoro. Portanto, essa onda foi o parâmetro para se determinar o limiar auditivo dos animais.
Kamimura et al.(28) também consideraram a onda II para se estabelecer o limiar eletrofisiológico. Segundo Hatzopoulos et al.(42), a onda III é a que apresenta maior visibilidade e reprodutibilidade, dessa forma a que determina o limiar eletrofisiológico. Tanaka, Whitworth e Rybak48 tiveram como parâmetro dois picos replicáveis de qualquer onda enquanto Minami, Sha e Schacht(50), as ondas III ou IV. Outros ainda estabelecem o limiar por traçados visualmente detectáveis e reprodutíveis, sem especificar qualquer tipo ou quantidade de ondas(52,55).
A quantidade de promediações necessárias para desencadear traçados de PAETE reprodutíveis varia nos experimentos em ratos entre 128(30) e 1024(30,33,50). Já a taxa de apresentação dos estímulos entre 5 por segundo(28,29,43-45,48,53) e 20 por segundo(30,46). No presente estudo conseguiu-se observar respostas replicáveis utilizando-se uma taxa de estímulo de 15 por segundo para 300 a 700 promediações.
Outro parâmetro bastante variável é o tipo de estímulo utilizado. A grande maioria dos autores dá preferência a tone burst associado ou não a cliques(22,28,29,33,37,42,44-50- ,52,53). O tone burst tem a vantagem de avaliar a audição de forma frequência específica. Sua utilização é importante quando se deseja diferenciar se a lesão acomete as porções da cóclea responsáveis por frequências mais graves ou agudas. Entretanto, quanto maior o número de tone bursts utilizados, mais demorado se torna o exame, aumentado o risco de mortalidade em experimentos animais pela necessidade de um maior tempo de anestesia. O estímulo com cliques determina uma resposta eletrofisiológica que representa uma faixa de frequência da audição compreendida entre 1000 e 4000 Hz(51). Com isso, desencadeia um maior sincronismo de despolarização das fibras nervosas, tornando o traçado mais constante e reprodutível que outros tipos de estímulo(56). Assim, à semelhança de outros estudos(30,34,41), realizou-se este experimento utilizando-se como estímulo apenas o clique de rarefação.
Apesar de as respostas desencadeadas pelo clique estarem representadas no giro médio da cóclea de ratos e não no giro basal(57), local onde predomina a lesão da cisplatina(28,48,50,55,58), as doses de 16 e 24 mg/kg de cisplatina foram capazes de desenvolver ototoxicidade mensurável por PAETE. O aumento médio do limiar eletrofisiológico para a dose de 24 mg/kg foi de 12 dB NA no D3 e 21 dB NA no D4. Entretanto, não se viu diferença estatística significativa entre D3 e D4. A dose de 16 mg/kg promoveu um aumento médio de limiar de 14,17 dB NA tanto no D3 como no D4, com este último dia de avaliação, apresentando uma maior variabilidade dos limiares secundária à mortalidade aumentada dos animais. Não houve qualquer variação de limiares do PAETE nos grupos controle. O aumento médio de limiar eletrofisiológico para cliques após a infusão de 16 mg/kg de cisplatina e avaliação 72h após variou na literatura entre 15,2 dB42 e 36 dB44. Sockalingam et al.(30) não evidenciaram aumento significativo do limiar para cliques após 3 dias com a dose de 12 mg/kg.
Por outro lado, Tanaka, Whitworth e Rybak48 mostraram um aumento médio de 18,3 dB para a dose de 13 mg/kg.
Não se encontraram estudos utilizando PAETE na avaliação auditiva de ratos para doses de 24 mg/kg.
Através do PAETE também se verificou que a lesão auditiva desencadeada pela cisplatina provém de estruturas cocleares, pois não houve aumento significativo do intervalo I-V nos animais tratados. Resultado semelhante foi visto por Rebert, Pryor e Frick(41). Em hamsters, Church et al.(59) acusaram prolongamento do intervalo I-IV com a dose de 15 mg/kg de CDDP, sugerindo lesão retrococlear por essa droga.
Por conseguinte, os potenciais auditivos evocados de tronco encefálico (PAETE), utilizando como estímulo auditivo cliques de rarefação, mostraram-se um método eficaz para detecção da ototoxicidade por CDDP em ratos nas duas doses empregadas. É possível que esse achado esteja relacionado a uma grande variabilidade (desvio padrão) das amplitudes das EOAPD entre os animais estudados.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Jordan J, Schwade ND, Truelson JM. Fosfomycin does not inhibit the tumoricial efficacy of cisplatinum. Laryngoscope. 1999;109(8):1259-62.
2. Guneri EA, Serbetçiogllu B, Ikiz AO, Guneri A, Ceryan K. TEOAE monitoring of cisplatin induced ototoxicity in guinea pigs: the protective effect of vitamin B treatment. Auris Nasus Larynx. 2001;28:9-14.
3. Feghali JG, Liu W, Water TRVD. L-N-acetyl-cysteine protection against cisplatin-induced auditory neuronal and hair cell toxicity. Laryngoscope. 2001;111:1147-55.
4. Strauss M, Towfighi J, Lipton A, Brown B, Lord S, Harvey H. Cisplatinum ototoxicity: clinical experience and temporal bone histopathology. Laryngoscope. 1983; 93:1554-9.
5. Schaefer SD, Post JD, Close LG, Wright CG. Ototoxicity of low- and moderate-dose cisplatin. Cancer. 1985;56:1934-9.
6. Laurell G, Jungelius U. High dose cisplatin treatment: hearing loss and plasma concentrations. Laryngoscope. 1990;100:724-34.
7. Reddel RR, Kefford RF, Grant JM, Coats AS, Fox RM, Tarttersall MHN. Ototoxicity in patients receiving cisplatin: importance of dose and method of drug administration. Cancer Treat Rep. 1982;66:19-23.
8. Allen GC, Tiu C, Koike K, Ritchey AK, Kurs-Lasky M, Wax MK. Transient-evoked otoacoustic emissions in children after cisplatin chemotherapy. Otolaryngol Head Neck Surg. 1998;118(5):584-8.
9. Wright CG, Schaefer SD. Inner ear histopathology in patients treated with cisplatinum. Laryngoscope. 1982;92(12):1408-13.
10. Laurell G, Frankendal B, Borg E. Cisplatin administration to gynecologic cancer patients: long term effects on hearing. Cancer. 1996;78(8):1798-884.
11. Kopke RD, Liu W, Gabizadeh R., Jacono A, Feghali J, Spray D, et al. Use of organotypic cultures of Corti's organ to study the protective effects of antioxidant molecules on cisplatin-induced damage of auditory hair cells. Am J Otolaryngol. 1997;18:559-71.
12. Cardinaal RM, De Groot JCMJ, Huizing EH, Veldman JE, Smoorenburg GF. Dose-dependent effect of 8-day cisplatin administration upon the morphology of the albino guinea pig cochlea. Hear Res. 2000;144:135-46.
13. Bagger-Sjöbäck D, Filipek CS, Schacht J. Characteristics and drug responses of cochlear and vestibular adenylate cyclase. Arch Otorhinolaryngol. 1980;228:217-22.
14. Komune S, Asakuma S, Snow JB. Pathophysiology of the ototoxicity effect of cis-diamminedichloroplatinum. Otolaryngol Head Neck Surg. 1981;89:275-82.
15. Saito T, Aran JM. Comparative ototoxicity of cisplatin during acute and chronic treatment. ORL J Otorhinolaryngol Relat Spec. 1994;56(6):315- 20.
16. Campbell KCM, Meech RP, Rybak LP, Hughes LFD-Methionine protects against cisplatin damage to the stria vascularis. Hear Res. 1999;138:13-28.
17. Smoorenburg GF, De Groot JCMJ, Hamers FPT, Klis SFL. Protection and spontaneous recovery from cisplatin-induced hearing loss. Ann. N Y Acad Sci. 1999;28:192-210.
18. Smoorenburg GF, De Groot JCMJ, Hamers FPT, Klis SFL. Cisplatininduced ototoxicity: morphological evidence of spontaneous outer hair cell recovery in albino guinea pig? Hear Res. 2000;144:147-56.
19. Smoorenburg GF, De Groot JCMJ, Hamers FPT, Klis SFL. Histological Effects of co-administration of an ACTH4-9 analogue, ORG 2766, on cisplatin ototoxicity in the albino guinea pig. Hear Res. 2000;144:157- 67.
20. O'Leary SJ, Klis SFL, De Groot JCMJ, Hamers FPT, Smoorenburg GF. Perilymphatic application of cisplatin over several days in albino guinea pigs: dose dependency of electrophysiological and morphological effects. Hear Res. 2001;154:135-45.
21. Sluyter S, Klis SFL, De Groot JCMJ, Smoorenburg GF. Alterations in the stria vascularis in relation to cisplatin ototoxicity and recovery. Hear Res. 2003;185:49-56.
22. Lynch ED, Gu R, Pierce C, Kil J. Reduction of acute cisplatin ototoxicity and nephrotoxicity in rats by oral administration of allopurinol and ebselen. Hear Res. 2005;201:81-9.
23. Van Ruijven MWM, De Groot JCMJ, Smoorenburg GF. Time sequence of degeneration pattern in the guinea pig cochlea during cisplatin administration. A quantitative histological study. Hear Res. 2004;197:44-54.
24. Van Ruijven MWM, De Groot JCMJ, Klis SFL, Smoorenburg GF. The cochlear targets of cisplatin: an electrophysiological and morphological time-sequence study. Hear Res. 2005;205: 241-8.
25. Laurell G, Bagger-Sjöbäck D. Dose-dependent inner ear changes after I.V. administration of cisplatin. J Otolaryngol. 1991;20:158-67.
26. De Groot JCMJ, Hamers FPT, Gispen WH, Smoorenburg GF. Coadministration of the neurotrophic ACTH(4-9) analogue, ORG 2766, may reduce the cochleotoxic effects of cisplatin. Hear Res. 1997;106 (1-2): 9-19.
27. Oliveira JAA, Canedo DM, Rossato M. Otoproteção das células ciliadas auditivas contra a ototoxicidade da amicacina. Rev Bras Otorrinolaringol. 2002;68 (1):7-13.
28. Kamimura T, Whitworth CA, Rybak LP. Effect of 4-methylthiobenzoic acid on cisplatin-induced ototoxicity in the rat. Hear Res. 1999;131:117-27.
29. Rybak LP, Husain K, Morris C, Whitworth C, Somani. S. Effect of protective agents against cisplatin ototoxicity. Am J Otolaryngol. 2000;21:513-20.
30. Sockalingam R, Freeman S, Cherny L, Sohmer H. Effect of high-dose cisplatin on auditory brainstem responses and otoacoustic emissions in laboratory animals. Am J Otol. 2000;21:521-7.
31. Hyppolito MA, Oliveira JAA, Lessa RM, Rossato M. Otoproteção da amifostina aos efeitos ototóxicos da cisplatina em cobaias albinas por emissões otoacústicas produtos de distorção e microscopia eletrônica de varredura. Rev Bras Otorrinolaringol. 2005;71 (3): 268-73.
32. Hyppolito MA, Oliveira JAA, Rossato M, Holanda F. Ototoxicidade da cisplatina e otoproteção pelo extrato de ginkgo biloba às células ciliadas externas: estudo anatômico e eletrofisiológico. Rev Bras Otorrinolaringol. 2003;69 (4): 504-11.
33. Dickey DT, Muldoon LL, Kraemer DF, Neuwelt EA. Protection against cisplatin-induced ototoxicity by N-acetylcysteine in a rat model. Hear Res. 2004;193:25-30.
34. Amsallem P, Andrieu-Guitrancourt J. Étude exppérimentale de l´ototoxicité du cisplatinum. Ann Otolaryngol Chir Cervicofac. 1985;102 (5):365-72.
35. Schweitzer VG, Hawkings JE, Lilly DJ, Litterst CJ, Abrams G, Davis JA. Ototoxic and nephrotoxic effects of combined treatment with cis-diamminedichloroplatinum and kanamycin in the guinea pig. Otolaryngol Head Neck Surg. 1984;92 (1): 38-49.
36. Lopez-Gonzalez MA, Guerrero JM, Rojas F, Delgado F. Ototoxicity caused by cisplatin ameliorated by melatonin and other antioxidants. J Pineal Res. 2000;28:73-80.
37. Hatzopoulos S, Di Stefano M, Albertin A, Martini A. Evaluation of cisplatin ototoxicity in a rat animal model. Ann N Y Acad Sci. 1999;28:211-25.
38. Mcalpine D, Johnstone BM. The ototoxic mechanism of cisplatin. Hear Res. 1990;47:191-204.
39. Azevedo MF. Emissões otoacústicas. In: Figueredo MS. Emissões otoacústicas e BERA. São José dos Campos: Editora Pulso; 2003.35-83.
40. Tange RA, Vuzevski VD. Change in the stria vascular of the guinea pig due to cis-platinum. Arch Otorhinolaryngol. 1984;239:41-7.
41. Rebert CS, Pryor GT, Frick MS. Effects of vincristine, maytansine, and cis-platinum on behavioral and electrophysiological indices of neurotoxicity in the rat. J Appl Toxicol. 1984;4 (6): 330-8.
42. Hatzopoulos S, Petriccelli J, Laurell G, Avan P, Finesso M, Martini A. Ototoxic effects of cisplatin in a Sprague-Dawley rat animal model as reveled by ABR and transiently evoked otoacoustic emission measurements. Hear Res. 2002;170:70-82.
43. Rybak LP, Somani S. Ototoxicity. Amelioration by protective agents. Ann N Y Acad Sci. 1999;28:143-51.
44. Rybak LP, Husain K, Whitworth C, Somani SM. Dose dependent protection by lipoic acid against cisplatin-induced ototoxicity in rats: antioxidant defense system. Toxicol Sci. 1999;47:195-202.
45. Rybak LP, Whitworth CMA, Somani S. Application of antioxidants and other agents to prevent cisplatin ototoxicity. Laryngoscope .1999;109 (11):1740-4.
46. Laurell G, Viberg A, Teixeira M, Sterkers O, Ferrary E. Blood-perilymph barrier and ototoxicity: an in vivo study in rat. Acta Otolaryngol. 2000;120:796-803.
47. Oh SH, Yu WS, Song B-H, Lim D, Koo J-W, Chang SO, et al. Expression of heat shock protein 72 in rat cochlea with cisplatin-induced acute ototoxicity. Acta Otolaryngol. 2000;120:146-50.
48. Tanaka F, Whitworth CA, Rybak LP. Round window pH manipulation alters the ototoxicity of systemic cisplatin. Hear Res. 2004;187:44-50.
49. Kalkanis JK, Whitworth MA, Rybak LP. Vitamin E reduces cisplatin ototoxicity. Laryngoscope. 2004;114 (3): 538-42.
50. Minami SB, Sha S-H, Schacht J. Antioxidant protection in a new animal model of cisplatin-induced ototoxicity. Hear Res. 2004;198 (1-2): 137-43.
51. Hood LJ. Stimulus, recording, and patient factors influencing the ABR. In: Hood LJ. Clinical applications of the auditory brainstem responses. San Diego: Singular Publishing Group;1998.
52. Li G, Frenz DA, Brahmblatt S, Feghali JG, Ruben RJ, Berggren D, et al. Round window membrane delivery of l-methionine provides protection from cisplatin ototoxicity without compromising chemotherapeutic efficacy. Neurotoxicology. 2001;22:163-76.
53. Rybak LP, Ravi R, Somani SM. Mechanism of protection by diethyldithiocarbamate against cisplatin ototoxicity: antioxidant system. Fundam Appl Toxicol. 1995;26 (2): 293-300.
54. Martin M, Moore E. Scalp distribution of early (0 to 10 msec) auditory evoked responses. Arch Otolaryngol. 1977;103: 326-8.
55. Campbell KCM, Rybak LP, Meech RP. D-Methionine provides excellent protection from cisplatin ototoxicity in the rat. Hear Res. 1996;102:90-8.
56. Cheng AG, Cunningham LL, Rubell EW. Mechanisms of hair cell death and protection. Curr Opin Otolaryngol Head Neck Surg. 2005;13: 343-8.
57. Möller M. Frequency representation in the rat cochlea. Hear Res. 1991;51: 247-54.
58. Estrem SA, Babin RW, Ryu JH, Moore KC. Cisdiamminedichloroplatinum (II) ototoxicity in guinea pig. Otolaryngol Head Neck Surg. 1981;89: 638-45.
59. Church MW, Kaltenbach JA, Blakley BW, Burgio DL. The comparative effects of thiossulfate of sodium, diethylditiocarbamate, fosfomycin and WR-2721 on ameliorating cisplatin-induced ototoxicity. Hear Res. 1995;86 (1-2):195-203.
1 Doutor, Professor Adjunto de Otorrinolaringologia do Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará.
2 Mestre, Médica assistente do Serviço de Otorrinolaringologia Hospital Universitário Walter Cantídio da Faculdade de Medicina da Universidade Federal do Ceará.
3 Doutor, Professora Associada do Departamento Morfologia da Faculdade de Medicina da Universidade Federal do Ceará.
4 Acadêmico de Medicina, Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará.
5 Acadêmico de Medicina, Departamento de Cirurgia da Faculdade de Medicina da Universidade Federal do Ceará.
6 Doutor, Professor Associado do Departamento de Fisiologia e Farmacologia da Faculdade de Medicina da Universidade Federal do Ceará.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da BJORL em 18 de fevereiro de 2008. cod 5719
Artigo aceito em 27 de julho de 2008.