Ano: 2009 Vol. 75 Ed. 1 - Janeiro - Fevereiro - (7º)
Seção: Artigo Original
Páginas: 43 a 49
Conhecimento da anatomia da orelha de cobaias e ratos e sua aplicação na pesquisa otológica básica
Understanding the anatomy of ears from guinea pigs and rats and its use in basic otologic research
Autor(es): Agnes Afrodite Sumarelli Albuquerque1, Maria Rossato2, José Antonio Apparecido de Oliveira3, Miguel Angelo Hyppolito4
Palavras-chave: cobaias, fotomicrografia, microscopia eletrônica de varredura, orelha, ratos.
Keywords: guinea pigs, photomicrography, scanning electron microscopy, ear, rats.
Resumo:
O uso de mostras animais é importante na pesquisa otológica e o conhecimento da anatomia de sua orelha permite sua utilização adequada. Objetivo: Estudar a anatomia da orelha da cobaia e do rato por microscopia óptica de luz (MOL) e microscopia eletrônica de varredura (MEV) e suas vantagens anatômicas na pesquisa otológica básica. Material e Método: Os ossos temporais, as bulas timpânicas e cócleas de três cobaias e ratos albinos foram fotografados e analisados ao MOL e MEV. Resultados: O rato não é tão simples de manipular como a cobaia, e freqüentemente apresenta otite média. O rato apresenta uma junção frágil da bula timpânica, duas e meia espiras na cóclea e a membrana timpânica não veda todo o conduto auditivo externo. A cobaia possui uma bula inteiriça, martelo e bigorna fundidos e três e meia espiras na cóclea. Pela MEV a cobaia e o rato possuem Membrana Tectória, Membrana de Raissner e o Órgão de Corti. As Células de Hensen estão presentes somente na cobaia. Conclusão: A cobaia foi considerada de fácil manipulação para a microdissecção, pelo tamanho e rigidez do osso temporal, e para experimentos cirúrgicos envolvendo o estribo, janela oval e a membrana timpânica. Pela MEV nota-se semelhança entre cobaia e rato, podendo ambos serem utilizados em estudos da orelha interna.
Abstract:
The use of animal samples is important in otologic research and understanding the anatomy of their ears help make proper use of them in research projects. Aim: to study guinea pig's and rat's ears under light microscopy(LM) and scanning electron microscopy(SEM) and understand their anatomical advantages in basic otologic research. Materials and methods: The temporal bones, tympanic bullas and cochleas from three albino guinea pigs and rats were photographed and analyzed under LM and SEM. Results: Rats aren't as simple to handle as guinea pigs, and often present with otitis media. Rats have a fragile junction of the tympanic bulla, two and half turns in the cochlea, and their tympanic membranes do not seal off the entire external auditory canal. Guinea pigs have full bullas, their incus and malleus are fused and they have three and half cochlear turns. Under SEM, guinea pigs and rats have Tectori Membrane, Raissner's Membrane and the Organ of Corti. Only guinea pigs have Hensen's Cells. Conclusion: Guinea pigs were considered easy to handle for microdissection purposes because of the size and robustness of their temporal bones, and for surgical experiments involving the stapes, the oval window and the tympanic membrane. Under SEM there are similarities guinea pigs and rats, and both can be used in inner ear studies.
![]()
INTRODUÇÃO
A pesquisa otológica freqüentemente exige o uso de modelos experimentais, principalmente cobaias e ratos devido à facilidade de manejo e similaridade com a orelha humana. Apesar de existirem numerosos estudos otológicos com cobaias e ratos, observa-se nas pesquisas bibliográficas realizadas que não há informação suficiente sobre a anatomia da orelha interna e externa destes animais.
O conhecimento sobre a anatomia da orelha de cobaias e ratos é indispensável na área de otologia. Uma utilização mais adequada destes animais faz com que os resultados obtidos sejam mais confiáveis, evitando o uso de técnicas que não são adequadas para uma determinada espécie e provocando, desnecessariamente, a morbidade e mortalidade de grande número de animais.
Segundo Schanaider et al.1, a maior parte da pesquisa na área de educação médica é empreendida nos animais de pequeno porte (camundongo, rato, hâmster, cobaia ou gerbil) e compreendem quase 90% do total das espécies utilizadas nos laboratórios.
De acordo com Oliveira2, em seu trabalho relacionado ao sistema labiríntico, a cobaia foi escolhida porque os sistemas auditivo e vestibular, neste animal, se assemelham sensivelmente aos do homem e é um animal que se presta muito bem para experimentos relacionados à labirintologia.
Diferentemente, Santos et al.3, utilizaram o rato como animal de experimentação por este apresentar vantagens práticas e semelhanças anatômicas e patológicas com a orelha média humana.
Para facilitar as pesquisas dos investigadores no campo da labirintologia que utilizam como animal de experimentação a cobaia, Oliveira2 descreveu a anatomia do osso temporal deste animal, com dissecção sob visão estereoscópica das peças anatômicas e microfotografias de preparação de superfície dos epitélios coclear e vestibular. Estes conhecimentos são essenciais, principalmente no estudo das alterações estruturais provocadas por drogas labirintotóxicas e trauma acústico.
Judkins e Li4 descreveram a anatomia topográfica da orelha média do rato albino através de microfotografias, ilustrando em detalhes estruturais diferentes exposições cirúrgicas. Muitas das estruturas anatômicas da orelha média do rato albino existem no humano, contudo, o nervo facial emerge do osso temporal em uma posição mais superficial e anterorostral. Os ossículos são mais finos do que os humanos, quase totalmente ocultos no epitímpano e a artéria carótida passa entre as cruras do estribo. Concluem que embora a exploração e dissecção possam ser feitas em animais eutanasiados, o procedimento das pesquisas é mais freqüentemente traçado em animais vivos que serão avaliados algum tempo depois da cirurgia para analisar uma premissa científica.
Pinilla et al.5 descreveram um acesso simples à orelha média do rato causando mínima morbidade e mortalidade dos animais. Quando comparada com a cobaia, as estruturas anatômicas da orelha média do rato são mais similares do que quando comparadas ao humano. A única exceção é a localização mais superficial e anterorostral do nervo facial do rato quando comparado ao da cobaia e ao humano. Contudo, a cóclea da cobaia é maior e a cadeia ossicular é fundida no nível incudomaleolar, enquanto a cóclea do rato está projetada no interior da orelha e os ossículos estão claramente definidos e podem ser removidos separadamente como no humano. O rato não serve como um modelo para estapedotomia ou ossiculoplastia envolvendo substituição dos ossículos, devido à presença da artéria carótida que passa ao longo da base da cóclea e através das cruras do estribo, neste caso uma exposição da janela oval poderá causar danos por hemorragia, lesões cocleares e morte do animal. Por outro lado, o acesso fácil à janela redonda e a parede lateral pode ser uma alternativa para a cocleostomia sem causar danos à membrana timpânica ou aos ossículos.
Concluíram que são necessários cuidados específicos quando se trata de novos acessos a orelha média de pequenos animais, como o rato, quando uma sobrevida prolongada e um acompanhamento subseqüente são desejados.
O presente estudo utilizou o Microscópio Óptico de Luz (MOL) e o Microscópio Eletrônico de Varredura (MEV), para se comparar as estruturas das orelhas média e interna do rato e da cobaia e determinar qual animal tem as melhores condições estruturais para cada tipo de experimento.
OBJETIVOS
Estudar a anatomia comparada macroscópica e microscópica da orelha da cobaia e do rato por microscopia óptica de luz (MOL) e microscopia eletrônica de varredura (MOV), buscando vantagens anatômicas para sua aplicação em modelos experimentais na pesquisa otológica básica.
MATERIAL E MÉTODO
A pesquisa foi submetida à apreciação do Comitê de Ética em Experimentação Animal da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo e liberada sob o protocolo 078/2007.
Para este estudo foram utilizadas três cobaias albinas (Cavia porcellus - linhagem Inglesa) e três ratos albinos (Rattus norvegicus - linhagem Wistar) pesando entre 250 e 300 gramas.
As cobaias e os ratos foram anestesiados com cloridrato de cetamina (Ketamin 50mg/ml, Laboratório Cristália,) 40 mg/kg e xilazina (Dopaser 20 mg/ml, Laboratório Calier do Brasil,) 10 mg/kg e depois sacrificadas por método de decapitação.
Seus ossos temporais contendo as bulas timpânicas foram rapidamente removidos e abertos para a exposição da cóclea.
Os ossos temporais foram abertos com uma tesoura de dissecção, que foi colocada na coluna cervical posteriormente, fazendo-se um corte no crânio longitudinal mediano que se estende posteriormente às orelhas. Depois, usando as mãos, tendo o conduto auditivo externo como orientação, a bula foi localizada com os polegares e num movimento de dentro para fora foi separada das outras estruturas e com ela presa entre os dedos foi sendo torcida num movimento suave para que os tecidos se soltassem e a liberassem.
A bula foi aberta segurando-a com uma das mãos e com uma pinça hemostática delicada foi realizada uma abertura no sinus aéreo posterior (mastóide) seguindo pela sua saliência até a ponta do rochedo. Em seguida, posicionando a pinça no conduto auditivo externo e sinus aéreo anterior, num só movimento foi quebrada e levantada toda parte óssea da bula expondo a cóclea.
O material foi fixado injetando-se lentamente glutaraldeído 3%, através de uma abertura feita no ápice da cóclea e da janela redonda e permaneceram em imersão por 4 horas a 4°C. O material foi lavado várias vezes em solução tampão fosfato 0,1M e submetido à microdissecção para exposição das espiras cocleares e sistema vestibular.
As bulas da cobaia e do rato foram fotografadas com o auxílio de uma máquina fotográfica digital (Nikon - Coolpix 990, 3,34 mega pixels) acoplada em um microscópio (DF Vasconcelos).
As peças fotografadas foram: as bulas fechadas, a bula aberta e a cóclea com sua cobertura óssea, a bula aberta e a cóclea sem sua cobertura óssea, a membrana timpânica, os ossículos isolados e a cóclea isolada.
As cócleas de uma cobaia e de um rato, para serem analisados através da microscopia eletrônica de varredura, foram fixadas com glutaraldeído 3% e lavadas com solução tampão 0,1M, depois refixadas em solução de tetróxido de ósmio a 1% em tampão fosfato 0,1M por 2 horas a 4°C, e depois, lavadas seguidamente em tampão fosfato 0,1M e pH de 7,3.
Logo após foi feita a desidratação das estruturas através de banhos de etanol em concentrações crescentes de 50, 70, 90 e 95%, durante cerca de 10 minutos cada. A seguir utilizou-se o etanol 100% em três banhos de 20 minutos cada, deixando-se no último banho as estruturas imersas à temperatura ambiente por 12 horas.
A água ainda presente no material após a desidratação foi removida no processo de secagem, realizado pelo método do ponto crítico com dióxido de carbono (CO2) líquido. A amostra contida em um recipiente adequado foi transferida para a câmara de secagem do aparelho de ponto crítico (BAL-TEC-CPD 030 - Critical Point Dryer) onde, através de sucessivos banhos com dióxido de carbono líquido a 4°C, o etanol foi eliminado. Depois de completamente retirado o etanol, o material foi submetido a um aumento da temperatura até 40°C para que o dióxido de carbono passasse do estado líquido para o estado gasoso, o que acontece a 31°C - ponto crítico.
Com o material seco foi realizada a montagem das cócleas em porta-espécime cilíndrico (stubs) metálico com pasta condutiva de carbono. Depois recebeu uma fina camada de ouro aplicado com o vaporizador (BAL-TEC SCD 050 - Sputter Coater) para ficar eletricamente condutivo.
Terminados estes processos, as cócleas da cobaia e do rato tiveram suas estruturas avaliadas por microscopia eletrônica de varredura. O Microscópio utilizado foi o JEOL JMS 5200.
RESULTADOS
Foi possível observar que o rato não é tão simples de manipular quanto a cobaia, por não ser um animal tão dócil e devido ao menor tamanho da cabeça há fragilidade da bula timpânica, que fez com que a manipulação desta fosse mais delicada.
Observando todas as cobaias e ratos que foram trabalhados, os ratos apresentaram maior facilidade para desenvolver otite na orelha média do que a cobaia (5 orelhas médias de 3 ratos e 1 de 3 cobaias apresentaram otite média). Estas infecções tornam o osso mais rígido, o que dificulta a abertura da bula timpânica para fixação e facilita o dano a outras estruturas, como a cóclea, sistema vestibular e ossículos.
Microscopia Óptica de Luz
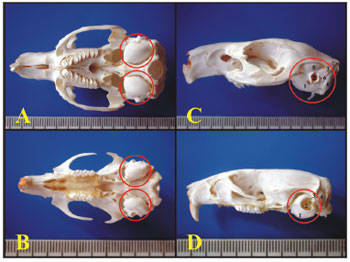
Através da Microscopia Óptica de Luz foi possível observar que a bula da cobaia e do rato se encontra na parte posterior-inferior do crânio e somente a porção petrosa e o osso timpânico são unidos. Na cobaia, na parte superior da bula, o osso escamoso forma um longo processo que continua adiante para compor o arco zigomático (Figura 1).
Figura 1. A) Base do crânio da cobaia mostrando as bulas timpânicas (vista inferior) (escala milimétrica); B) Base do crânio do rato mostrando as bulas timpânicas (vista inferior) (escala milimétrica); C) Vista lateral esquerda do crânio da cobaia jovem (escala milimétrica); D) Vista lateral esquerda do crânio do rato adulto - jovem (escala milimétrica). 1 - Bula; 2 - Conduto auditivo externo; 3 - Osso escamoso; 4 - Saliência do "sinus" aéreo posterior; 5 - Saliência do "sinus" aéreo anterior; 6 - Apófise para-occipital
Na microdissecção, através de microscopia óptica de luz, para abertura das bulas timpânicas, a do rato se mostrou mais fácil por apresentar uma junção frágil entre duas partes da bula. Isso não ocorre na cobaia, que possui uma bula timpânica inteiriça e rígida.
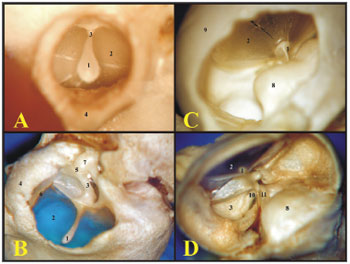
O conduto auditivo externo da cobaia é menor que o do rato, permitindo a visão somente da membrana timpânica e do cabo do martelo, enquanto que no rato é possível visualizar a membrana timpânica, que não veda todo o conduto auditivo externo, e a cadeia ossicular (Figura 2).
Figura 2. A) Visão através do conduto auditivo externo da cobaia jovem (fotomicrografia, aumento 60x); B) Visão através do conduto auditivo externo do rato adulto-jovem (fotomicrografia, aumento 75x); C) Visão interna da fenda auditiva da cobaia jovem (interior da bula timpânica esquerda) (fotomicrografia, aumento 58x); D) Visão interna da fenda auditiva do rato adulto-jovem (interior da bula timpânica esquerda) (fotomicrografia, aumento 75x). 1 - Cabo do martelo; 2 - Membrana timpânica; 3 - Martelo (colo); 4 - Conduto auditivo externo; 5 - Articulação incudomalear; 6 - Anel timpânico; 7 - Bigorna; 8 - Cóclea com cobertura óssea; 9 - Bula; 10 - Ramo longo da bigorna; 11 - Estribo
A inserção da cóclea na cobaia é mais saliente e maior que a do rato, permitindo observar a membrana timpânica, o cabo do martelo e a cóclea com a cobertura óssea, pois os outros ossículos ficaram encobertos pela cóclea. Já no rato, como a cóclea é menor e a sua inserção mais inferior, é possível ver a membrana timpânica, o cabo do martelo, a bigorna e parte do estribo (Figura 2).
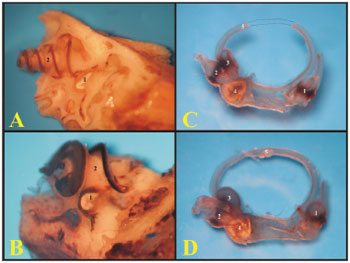
Quando a bula timpânica da cobaia é aberta, a cóclea é visualizada em seu interior, com sua cobertura óssea e a cadeia ossicular sendo possível notar somente a janela redonda, pois a janela oval fica coberta pelo estribo. No rato, quando a parte superior da bula é retirada, os ossículos, martelo e bigorna saem junto com a membrana timpânica, ficando em seu interior a cóclea com sua cobertura óssea e o estribo sobre a janela oval. A janela redonda não aparece, pois está encoberta pela artéria carótida que, no rato, passa entre os ramos do estribo (Figura 3).
Figura 3. A) Visão do interior da bula timpânica da cobaia jovem com ossículos e cóclea com a cobertura óssea (fotomicrografia, aumento 15x); B) Visão do interior da bula timpânica do rato adulto-jovem com estribo e a cóclea com a cobertura óssea (fotomicrografia, aumento 28x). 1 - Cóclea; 2 - Martelo; 3 - Ramo longo da bigorna; 4 - Platina do estribo sobre a janela oval (estribo); 5 - Janela redonda; 6 - Mastóide; 7 - Abertura da tuba auditiva (Trompa de Eustáquio); 8 - Projeção do canal semicircular lateral; 9 - Projeção óssea do canal do nervo facial; 10 - Projeção do canal semicircular posterior; 11 - Projeção do canal semicircular superior; 12 - Projeção do sinus aéreo posterior; 13 - Artéria carótida
Na microdissecção, quando a cobertura óssea da cóclea da cobaia e do rato é retirada para expô-la, não é possível manter os ossículos, e a janela oval é aberta.
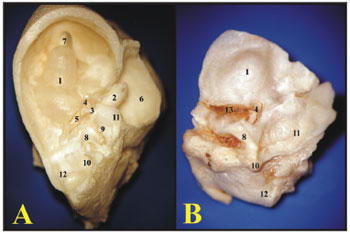
Quanto aos ossículos, na cobaia o martelo e a bigorna são fundidos, formando uma junção chamada incudomalear, enquanto que no rato estes não são fundidos. O estribo na cobaia é maior e tem um formato triangular, no rato os ramos anterior e posterior são mais estreitos e têm um formato arredondado (Figura 4).
Figura 4. A) Conjunto dos ossículos da cobaia jovem. Detalhe da articulação maleoloincudal (III) (fotomicrografia, aumento 58x); B) Conjunto dos ossículos do rato adulto-jovem (fotomicrografia, aumento 60x). I - Martelo - Bigorna 1 - Membrana timpânica; 2 - Cabo do martelo; 3 - Cabeça do martelo; 3' - Colo do martelo; 4 - Bigorna (soldada ao martelo); 4' - Superfície articular martelo-bigorna; 5 - Ramo longo da bigorna; 6 - Processo lenticular da bigorna; 7 - Ramo curto da bigorna II - Estribo 1 - Platina do estribo; 2 - Ramo anterior do estribo; 3 - Ramo posterior do estribo; 4 - Capítulo do estribo; 5 - Tendão do músculo estapédio III - Articulação incudomalear 1 - Martelo; 2 - Bigorna IV - Bigorna 1 - Superfície articular bigorna-martelo; 2 - Ramo curto da bigorna; 3 - Ramo longo da bigorna; 4 - Processo lenticular da bigorna
O sáculo na cobaia é mais estreito e fica inserido mais próximo à espira basal da cóclea, e no rato é mais largo e inserido próximo ao início da segunda espira da cóclea.
As ampolas da cobaia e do rato são semelhantes na aparência, mas com o tamanho proporcional aos animais. O utrículo do rato é mais facilmente retirado que o da cobaia (Figura 5).
Figura 5. A) Parede interna do labirinto esquerdo da cobaia jovem mostrando a região do vestíbulo (fotomicrografia, aumento 55x); B) Parede interna do labirinto esquerdo do rato adulto-jovem, mostrando a região do vestíbulo (fotomicrografia, aumento 60x); C) Labirinto membranoso esquerdo da cobaia jovem (fotomicrografia, aumento 48x); D)Labirinto membranoso esquerdo do rato adulto-jovem (fotomicrografia, aumento 48x). A e B) 1 - Sáculo; 2 - Cóclea C e D) 1 - Ampola do canal semicircular posterior; 2 - Ampola do canal semicircular superior; 3 - Ampola do canal semicircular lateral; 4 - Utrículo; 5 - Canal semicircular lateral
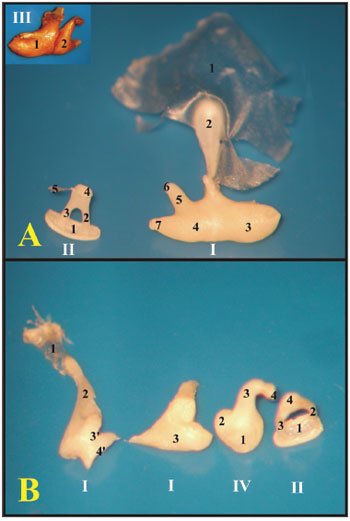
A cóclea da cobaia possui três e meia voltas (espiras) enquanto a do rato possui duas e meia voltas. A espira basal do rato é mais rígida e fundida à cobertura óssea da cóclea, por isso muitas vezes, na microdissecção, quando a cobertura óssea é retirada, esta espira é removida em conjunto (Figura 6).
Figura 6. A) Cóclea isolada da cobaia jovem, mostrando as espiras da cóclea com o labirinto membranoso (LM) (fotomicrografia, aumento 44x); B) Cóclea isolada do rato adulto-jovem, mostrando as espiras da cóclea com o labirinto membranoso (LM) (fotomicrografia, aumento 44x); C) Cóclea da cobaia vista ao Microscópio Eletrônico de Varredura (eletromicrografia de varredura, aumento 35x); D) Cóclea do rato vista ao Microscópio Eletrônico de Varredura (eletromicrografia de varredura, aumento 35x). 1 - Modíolo; 2 - Espira basal (E1); 3 - Espira 2 (E2); 4 - Espira 3 (E3); 5 - Espira apical; 6 - Nervo coclear
Microscopia Eletrônica de Varredura
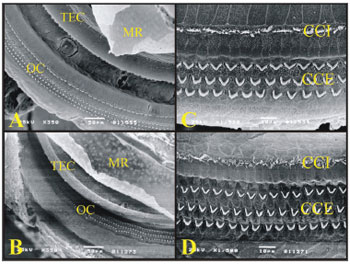
Com a Microscopia Eletrônica de Varredura as estruturas da cóclea foram analisadas mais detalhadamente e foi possível observar as três e meia voltas da cóclea da cobaia e as duas e meia voltas da cóclea do rato. A cobaia possui a espira basal, espira 2, espira 3 e a espira apical, enquanto que o rato possui a espira basal, espira 2 e a espira apical (Figura 6).
Em todas as espiras da cóclea da cobaia e do rato observa-se a Membrana Tectória, a Membrana de Raissner, o Órgão de Corti e as Células de Hensen.
A Membrana Tectória da cobaia e do rato é semelhante. No tratamento da cóclea para a Microscopia Eletrônica de Varredura, esta membrana se encolhe, soltando-se das células ciliadas externas, com sua ponta virada para cima.
A Membrana de Raissner também é semelhante na cobaia e no rato. Ela possui duas faces, a endolinfática e a perilinfática. Na cobaia e no rato a face endolinfática é mais lisa e a perilinfática possui algumas células que têm o núcleo realçado.
O Órgão de Corti da cobaia e do rato são parecidos no padrão W/V das células ciliadas externas (CCE) e na disposição destas e das células ciliadas internas (CCI). As CCEs da terceira fileira no rato apresentam células que se localizam fora da fileira a cada intervalo de espaço (Figura 7).
Figura 7. A) Espira da cobaia mostrando a Membrana de Raissner (MR), Membrana Tectória (TEC), Órgão de Corti (OC) (eletromicrografia de varredura, aumento 350x); B) Espira do rato mostrando a Membrana de Raissner (MR), Membrana Tectória (TEC), Órgão de Corti (OC) (eletromicrografia de varredura, aumento 350x); C) Órgão de Corti da espira basal da cóclea da cobaia com as células ciliadas externas (CCE) e células ciliadas internas (CCI) (eletromicrografia de varredura, aumento 1500x); D) Órgão de Corti da espira basal da cóclea do rato com as células ciliadas externas (CCE) e células ciliadas internas (CCI) (eletromicrografia de varredura, aumento 1500x).
Na espira basal da cóclea da cobaia e do rato o padrão W/V e o arranjo das CCEs e CCI são iguais (Figura 7).
Na espira 2 a terceira fileira de CCEs não tem o padrão W/V tão definido na cobaia e no rato a disposição destas células tem algumas variações.
A espira 3 só ocorre na cobaia e apresenta a segunda e a terceira fileiras sem um padrão W/V bem definido, algumas chegam a parecer uma meia-lua.
A espira apical, tanto da cóclea da cobaia quanto do rato, apresenta um desarranjo das CCEs e CCIs quanto ao padrão W/V e quanto ao enfileiramento das células que não é bem definido nas fileiras 2 e 3.
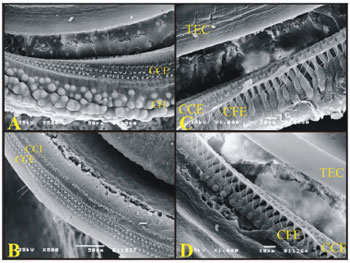
Nas espiras da cóclea da cobaia é possível observar as Células de Hensen bem definidas enquanto que nas espiras da cóclea do rato estas células não aparecem (Figura 8).
Figura 8. A) Espira 3 da cóclea da cobaia mostrando as Células de Hansen (CH) (eletromicrografia de varredura, aumento 500x); B) Espira 2 da cóclea do rato mostrando a ausência da definição das células de Hansen (eletromicrografia de varredura, aumento 500x); C) Espira basal da cóclea da cobaia mostrando as células falângicas externas (CFE) (Deiters) (eletromicrografia de varredura, aumento 1000x); D) Espira basal da cóclea do rato mostrando as células falângicas externas (CFE) (Deiters) (eletromicrografia de varredura, aumento 1000x).
Foi possível ver as células falângicas externas (Deiters) que sustentam as CCEs. São semelhantes nas cobaias e nos ratos.
DISCUSSÃO
Na pesquisa otológica os animais que são mais freqüentemente utilizados são a cobaia e o rato devido à similaridade da orelha destes com a orelha humana.
De acordo com o que se objetiva em cada experimento deve-se escolher uma espécie de animal.
O presente trabalho mostrou que na etapa de microdissecção o melhor animal para se manipular é a cobaia, devido ao seu tamanho e à rigidez do osso temporal que permitem maior facilidade para retirada das bulas timpânicas, enquanto que o rato é menor e a chance de se quebrar as bulas timpânicas no momento da sua retirada é maior.
Através da microscopia óptica de luz foi possível notar que o diâmetro do conduto auditivo externo da cobaia é menor que o do rato, mas a membrana timpânica na cobaia é muito maior do que o diâmetro do anel timpânico, de modo que se forma um espaço escondido anteriormente à membrana timpânica. Assim, estudos que visam à membrana timpânica podem ser mais bem desenvolvidos na cobaia.
Na membrana timpânica do rato há uma abertura entre a bigorna e o martelo que dá acesso à orelha média. Esta abertura pode ser a causa da ocorrência de otite média nestes animais.
Quando o objetivo da pesquisa é colher dados com os ossículos intactos, o melhor animal é a cobaia, pois, quando a bula timpânica é aberta os ossículos não são danificados. Ao contrário, no rato, como os ossículos são presos à membrana timpânica, quando a bula timpânica é aberta os ossículos são removidos com a membrana.
Devido ao processo maleoloincudal que se forma com a junção do martelo e da bigorna que são fundidos na cobaia, cirurgias que visam a substituição de somente um desses ossículos ficam dificultadas. Mas se a cirurgia visa a estapedotomia ou a aplicação de alguma droga através da janela oval ou redonda, o animal que melhor se adapta é a cobaia e o rato deve ser evitado, pois este possui a artéria carótida que passa entre os ramos do estribo e fica ao lado da janela redonda.
Como mostrado anteriormente, a cóclea da cobaia possui três e meia voltas e o rato possui duas e meia, portanto quando se procura testar alguma droga que fará efeito na cóclea o melhor animal a ser utilizado é a cobaia.
Com a Microscopia Eletrônica de Varredura foi possível notar que quanto ao número e aparência das CCEs e CCIs os dois animais são semelhantes, com diferença no número de espiras, possuindo o rato, uma a menos que a cobaia.
Outra diferença notada foi a presença das células de Hansen que só foram observadas nas espiras da cobaia, portanto quando o estudo é dirigido a este tipo celular, o melhor animal é a cobaia.
O desarranjo das CCEs da terceira fileira na cóclea do rato não parece interferir quando o experimento for com uma droga que causa esse efeito, pois esse desarranjo é contínuo.
Como a maioria das estruturas da cóclea é parecida à microscopia eletrônica de varredura, é possível que em estudos que utilizem esse método de análise sejam feitos tanto em cobaias quanto em ratos.
CONCLUSÕES
Concluídas as etapas da microdissecção, observou-se que o melhor animal para manipulação é a cobaia.
De acordo com as análises feitas ao microscópio óptico de luz é possível verificar que para experimentos que envolvam cirurgias como estapedotomia e cocleostomia deve-se evitar o uso de ratos como animais de experimentação, e em cirurgias que envolvam a membrana timpânica, o animal mais adequado é a cobaia.
As análises através da microscopia eletrônica de varredura mostraram que as estruturas da cóclea da cobaia e do rato são semelhantes, assim ambos podem ser utilizados em experimentos que utilizam este tipo de análise.
Desta forma, para os estudos de otologia a cobaia se aplica bem, com algumas vantagens em sua utilização, no entanto, o rato também pode ser utilizado, desde que tomados alguns cuidados já apresentados.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Schanaider A, Silva PC. uso de animais em cirurgia experimental. Acta Cir Bras . 2004;19(4): 441-7;
2. Oliveira JAA. Audio-Vestibular toxicity of drugs. Florida: CRC Press; 1989. p.560
3. Santos PF et al. Achados otomicrocópicos e histológicos da miringoes- clerose induzida em ratos: estudo crítico de um modelo experimental. Rev Bras Otorrinolaringol . 2005;71(5):668-74.
4. Judkins RF, LI H. Surgical anatomy of the rat middle ear. Otolaryngol Head Neck Surg . 1997;117(5):438-47.
5. Pinilla M, Ramírez-Camacho R, Jorge E, Trinidad A, Vergara J. Ventral approach to the rat middle ear for otologic research. Otolaryngol Head Neck Surg. 2001;124(5):515-7
1 Graduada em Ciências Biológicas, Técnica de Laboratório do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
2 Técnica de Laboratório do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
3 Professor Titular, Chefe do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP.
4 Professor-Doutor, Docente do Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço da Faculdade de Medicina de Ribeirão Preto - USP. Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo.
Endereço para correspondência: Agnes Afrodite Sumarelli Albuquerque - Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto - USP - Departamento de Oftalmologia, Otorrinolaringologia e Cirurgia de Cabeça e Pescoço Avenida Bandeirantes 3900 Ribeirão Preto SP 14049-900.
Tel. (0xx16) 3602-2861 - Fax (0xx16) 3602-2860.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 18 de setembro de 2007. cod.4801
Artigo aceito em 5 de novembro de 2007.