Ano: 2008 Vol. 74 Ed. 4 - Julho - Agosto - (3º)
Seção: Artigo Original
Páginas: 494 a 502
Miringosclerose em pacientes com insuficiência renal crônica: análise comparativa com um grupo controle
Myringosclerosis in patients with chronic renal failure: comparative analysis with a control group
Autor(es): Silvio Caldas Neto1, Fábio José Delgado Lessa2, Gabriel Alves Jr.3, Nelson Caldas4, Mariana de Carvalho Leal Gouveia5
Palavras-chave: insuficiência renal, orelha média, otoscopia.
Keywords: kidney failure, middle ear, otoscopy.
Resumo:
A miringoesclerose é uma alteração cicatricial da lâmina própria da membrana timpânica caracterizada por proliferação de fibras colágenas, seguida de hialinização, deposição de cálcio e fósforo, seguindo uma seqüência semelhante ao que ocorre em outros tipos de calcificação patológica comuns em pacientes com doença renal crônica. Objetivo: Verificar a influencia da insuficiência renal crônica (IRC) na prevalência da miringoesclerose. Método: Foi realizada otoscopia em 341 pacientes com IRC em hemodiálise e em 356 indivíduos de um grupo controle. Foi comparada a freqüência de otoscopia positiva entre os dois grupos, procurando-se relacionar com variáveis pessoais e relacionadas a IRC. Resultados: O grupo de pacientes apresentou 11,7% de otoscopia positiva contra 5,1% do grupo controle. Não houve influência do sexo ou cor na freqüência da miringoesclerose. Porém, os grupos foram heterogêneos em relação à faixa etária. Também não houve diferença importante no tempo de diálise nem nos níveis séricos de minerais e do PTH entre os pacientes do grupo de estudo que apresentavam otoscopia positiva ou negativa. Conclusão: Os achados, embora apontem para uma maior ocorrência da miringoesclerose nos pacientes renais crônicos, não nos permitem concluir com certeza que exista alguma relação entre a IRC e as alterações timpânicas.
Abstract:
Myringosclerosis is a scar of the tympanic membrane lamina propria, resulting from trauma or inflammation, characterized by proliferation of collagen, hyalinization, calcium and phosphate deposits and cartilaginous or osseous metaplasia of the middle ear mucosa, a sequence that is similar to that taking place in other types of pathologic calcification, common in chronic renal failure (CRF). Aim: To verify the influence of chronic renal failure on the prevalence of myringosclerosis. Method: The otoscopic examination was done in 341 chronic renal failure patients and in 356 normal control individuals. The frequency of positive otoscopies was compared between the two groups, based on individual variables and those pertaining to CRF. Results: 11.7% of the patients had a positive otoscopy in the CRF group, compared to 5.1% in the control group. There was no statistical diference in the frequency of myringosclerosis acording to gender, ethnic group, time of dialysis or serum minerals. The groups had a wide age range. Conclusion: Although the findings of this study suggest a higher ocurrence of myringosclerosis in patients with renal disease, they do not provide a basis for stating that there is any relation between renal failure and tympanic alterations.
![]()
INTRODUÇÃO
A timpanosclerose é uma alteração histológica caracterizada por degeneração hialina da mucosa da orelha média (OM), que pode se seguir de deposição de cálcio e fósforo na submucosa desta região1,2 que toma uma consistência endurecida, às vezes, óssea.
Ela pode ocorrer na espessura da membrana timpânica (MT), quando recebe o nome de miringosclerose3 e pode ser facilmente identificada ao exame otoscópico, ou em outras localizações na OM, entre as quais a preferencial é a região do ático.
Outras formas de calcificação patológica encontradas em diversos tecidos do organismo se processam de modo bastante semelhante ao da timpanosclerose e envolvem vesículas de matriz, fibroblastos, macrófagos e enzimas diversas.4-13 Tais calcificações são influenciadas por dismetabolismos do cálcio e fósforo, que são encontrados em diversas condições patológicas sistêmicas, entre as quais a insuficiência renal crônica (IRC) se inclui. Seguindo este raciocínio, este trabalho foi realizado com o objetivo de tentar encontrar uma possível relação de causa e efeito entre a IRC e a ocorrência de timpanosclerose.
OBJETIVO
Avaliar a influência da IRC na ocorrência da timpanosclerose.
CASUÍSTICA E METODOS
Trata-se de um estudo epidemiológico transversal, com um grupo de estudo (grupo A) e um grupo controle (grupo B). O grupo A foi composto de 341 pacientes portadores de IRC em terapia hemodialítica, e o grupo B foi constituído de 356 acompanhantes de pacientes do ambulatório e enfermaria do Serviço de Otorrinolaringologia, sem queixas otológicas e sem doença renal. Os 341 pacientes estudados eram provenientes de três serviços distintos de hemodiálise, todos situados na cidade de Recife. Esse trabalho foi aprovado pelo comite de ética da instituição.
A idade dos indivíduos variou de 10 a 88 anos, sendo a média, no grupo A, de 46,5 anos (DP ± 14,84) e, no grupo B, de 39,9 anos (DP ± 14,39). Do total de indivíduos, 422 eram mulheres e 275, homens; 101 eram brancos, 101 eram negros e 495 eram pardos.
A coleta de dados foi feita no período de março a junho de 2002. Todos os indivíduos foram submetidos a um questionário (Anexo A) e exame otoscópico.
O questionário foi aplicado através de entrevista com questões fechadas e continha, além dos dados de identificação (sexo, idade, cor) e história de morbidade otológica (antecedentes de otalgia e/ou otorréia).
A otoscopia foi realizada com um otoscópio da marca WELCH ALLYN, modelo 71000-C, de 3,5 V, com bateria recarregável 72300, sempre por dois examinadores, que foram os mesmos para todos os indivíduos do estudo.
Apenas para os 225 pacientes de uma das clínicas de hemodiálise, foram dosados a calcemia, fosfatemia e níveis séricos de PTH na ocasião da inclusão no estudo.
A otoscopia foi considerada positiva quando se observava a presença da placa típica na MT. Nos pacientes idosos, a opacificação difusa da MT, que pode ocorrer naturalmente nesta faixa etária, não foi considerada como miringosclerose.
A calcemia foi considerada normal numa faixa que ia de 8,4 a 10,2 mg/dl. A fosfatemia foi considerada normal entre 2,7 e 4,5mg/dl. Finalmente, os níveis de PTH foram tidos como normais quando variaram entre 14 e 106pg/ml.
O passado de otite foi considerado positivo quando havia relato pelo indivíduo de história de otalgia ou otorréia.
O tempo de diálise foi contado a partir da primeira sessão registrada no prontuário do paciente até o dia do exame otoscópico.
A fórmula utilizada para o cálculo do "n" foi a do módulo STATCALC do programa EPI-INFO 6.0, utilizando um nível de significância de 5% e poder do teste de 80%. A análise dos dados foi feita por meio de estatística descritiva, utilizando medidas de tendência central e dispersão, e estatística analítica, utilizando o teste do qui-quadrado (x2), com correção de Yates (p<0,05).
RESULTADOS
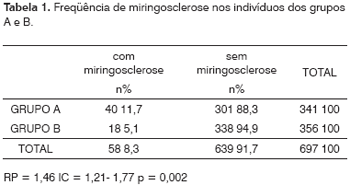
A prevalência geral de miringoesclerose nos 697 pacientes foi de 8,3% (n = 58), sendo a prevalência no grupo B de 5,1% (n = 18) e, entre os renais crônicos, de 11,7% (n = 40), apresentando este último grupo uma chance 2,5 vezes maior de apresentar otoscopia positiva do que o grupo controle (IC = 1,21 - 1,77; RP = 1,46; p = 0,002), como se observa na Tabela 1.
Houve ainda outros achados otoscópicos eventuais, como perfuração timpânica (em seis indivíduos do grupo A) e otite externa (em dois indivíduos do mesmo grupo).
Miringosclerose e história pregressa de otites
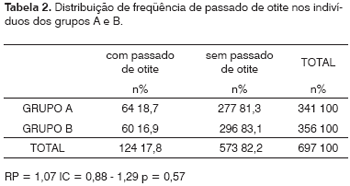
Dos 58 indivíduos com miringoesclerose, 10 (17,2%) tinham história compatível com doença inflamatória da OM, enquanto que 114 (17,8%) entre os 639 indivíduos sem miringoesclerose referiram episódio(s) prévio(s) de patologia otológica, o que não se mostrou estatisticamente significante, com um p = 0,94. Além disso, os grupos A e B foram semelhantes quanto ao passado de patologia otológica, que foi positivo em 64 (18,7%) dos pacientes com IRC e em 60 (16,9%) indivíduos do grupo controle (RP = 1,07; IC = 0,88 - 1,29; p = 0,57), sem significado estatístico, como se vê na Tabela 2.
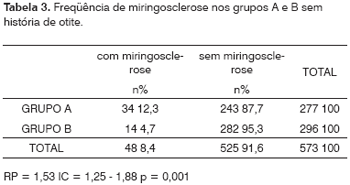
Por outro lado, ao eliminarmos, de ambos os grupos estudados, os indivíduos com história prévia de otites (64 do grupo A e 60 do grupo B), encontramos um total de 573 indivíduos, sendo 277 do grupo A e 296 do grupo B. Entre os 277 pacientes do grupo A, 34 (12,3%) tinham miringoesclerose, ao passo que este achado aconteceu em apenas 14 (4,7%) entre os 296 indivíduos do grupo controle (Tabela 3). Estes achados mostraram uma diferença estatística ainda maior do que quando todos os pacientes foram incluídos (RP = 1,53; IC = 1,25 - 1,88; p = 0,001).
Miringosclerose e Sexo
Do total de indivíduos, 422 (60,5%) foram do sexo feminino e 275 (39,5%) do sexo masculino, sendo que, dos indivíduos que apresentaram miringosclerose, 35 (60,3%) eram mulheres e 23 (39,7%), homens, com um p = 0,91.
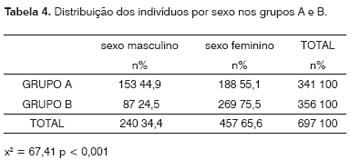
Entre os pacientes renais crônicos 153 (44,9%) eram do sexo masculino e 188 (55,1%) do feminino. Já entre os controles, essa relação foi de 87 (24,5%) para 269 (75,5%) indivíduos (x2 = 67,41, p < 0,001), como se percebe na Tabela 4.
Miringosclerose e Cor
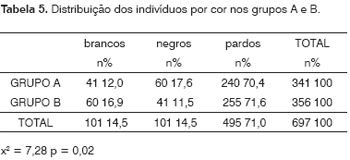
Avaliando a população total do estudo, 101 indivíduos (14,5%) eram brancos, 101 (14,5%) eram negros e 495 (71%), pardos.
Vê-se na Tabela 5 que, no grupo A, de pacientes renais crônicos, esta proporção foi de 41 (12,0%), 60 (17,6%) e 240 (70,4%), respectivamente, enquanto que, entre os indivíduos do grupo B, foram observados 60 (16,9%) brancos, 41 (11,5%) pretos e 255 (71,6%) pardos, formando grupos semelhantes em relação à cor (x2= 7,28, p = 0,02).
Se observarmos apenas os indivíduos com otoscopia positiva para miringosclerose, 11 (19,0%) eram brancos, 10 (17,2%) eram negros e 37 (63,8%) eram pardos. Já nos indivíduos sem miringosclerose, 90 (14,1%) tinham cor branca, 91 (14,2%) tinham cor negra e 458 (71,7%) eram de cor parda (x2 = 1,67, p = 0,43).
Miringosclerose e Idade
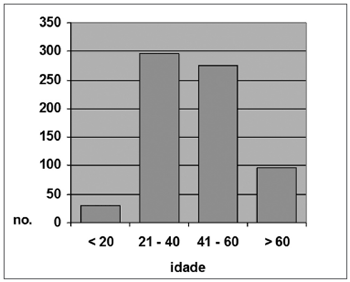
Os indivíduos estudados foram agrupados em 4 faixas de idade (<20 anos, 21 a 40, 41 a 60 e >60 anos). Do total de 697, 29 indivíduos (4,2%) tinham até 20 anos; 297 (42,6%) tinham entre 21 e 40 anos; 275 (39,4%), entre 41e 60 anos e; 96 (13,8%) estavam na faixa acima dos 60 anos de idade (Gráfico 1).
Gráfico 1. Distribuição por faixa etária, Total de indivíduos (N=697)
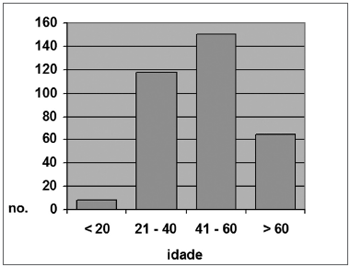
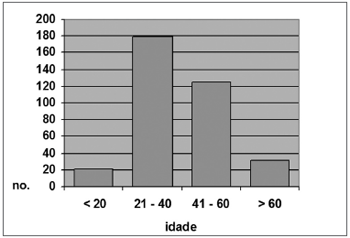
Entre os pacientes renais crônicos, 8 (2,3%) tinham até 20 anos; 118 (34,6%), entre 21 e 40 anos; 150 (43%), entre 41 e 60 anos e; 65 (19,1%), mais de 60 anos (Gráfico 2). A idade média neste grupo foi de 46,5 anos (DP ± 14,84), sendo a mínima de 16 e a máxima de 88 anos. Entre os controles, 21 indivíduos (5,9%) tinham 20 anos ou menos; 179 (50,3%) tinham entre 21 e 40 anos; 125 (35,1%), entre 41 e 60 anos e; 31 indivíduos (8,7%), mais de 60 anos (Gráfico 3). A idade média neste grupo foi de 39,9 anos (DP ± 14,39), sendo a mínima de 10 anos e a máxima de 82 anos.
Gráfico 2. Distribuição por faixa etária, Grupo A (N = 341)
Gráfico 3. Distribuição por faixa etária, Grupo B (N = 356)
Se estudarmos isoladamente as faixas etárias mais prevalentes (de 21 a 40 e de 41 a 60 anos), teremos os seguintes resultados (Tabelas 6 e 7):
Na faixa dos 21 aos 40 anos, entre os 118 pacientes do grupo A, 12 (10,1%) apresentaram miringosclerose, sendo este índice de 6,7% (12 casos entre 179) no grupo controle (p = 0,39). Já na faixa dos 41 aos 60 anos, a miringosclerose foi encontrada em 16 (10,7%) dos 150 pacientes do grupo A contra seis (4,8%) entre os 125 indivíduos do grupo B (p = 0,11).
Miringosclerose e Tempo de diálise
De todos os pacientes (com ou sem miringosclerose) 50,4% tinham menos de 2 anos de diálise, 25,3% tinham entre 2 e 5 anos de diálise e 24,3% tinham mais de 5 anos.
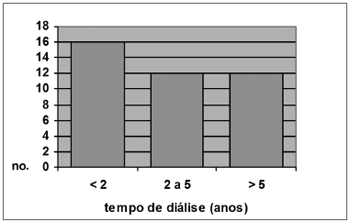
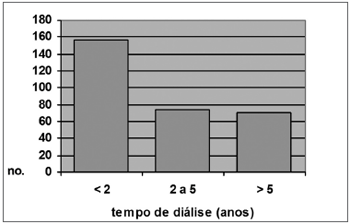
Dos pacientes renais crônicos que apresentaram miringosclerose à otoscopia, 16 (40%) tinham menos de 2 anos de diálise, 12 (30%) tinham de 2 a 5 anos e 12 (30%) tinham mais de 5 anos. Dos pacientes renais crônicos sem miringosclerose, 156 (42,4%) tinham menos de 2 anos, 74 (24,6%) tinham entre 2 e 5 anos e 71 (23,6%) tinham mais de 5 anos de diálise (x2 = 1,99 e p = 0,37). Estes dados estão representados nos Gráficos 4 e 5.
Gráfico 4. Distribuição por tempo de diálise, Grupo A c/ MS(N = 40)
Gráfico 5. Distribuição por tempo de diálise, Grupo A s/ MS(N = 301)
Miringosclerose e Calcemia
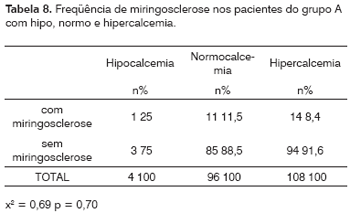
Dos 341 pacientes do grupo A em geral apenas 208 tiveram a sua calcemia dosada. Destes, quatro (2%) apresentavam hipocalcemia, enquanto que 96 (46%) tinham o cálcio dentro da faixa normal e 108 (52%) apresentavam hipercalcemia.
A Tabela 8 mostra que, entre os 4 pacientes com hipocalcemia, apenas um tinha miringosclerose. Dos 96 pacientes normocalcêmicos, 11 (11,5%) mostravam placa de miringosclerose à otoscopia e 85 (88,5%), não. Finalmente, dos 108 pacientes com hipercalcemia, 14 (13%) tinham miringosclerose e 94 (87%) tinham MT normal (x2 = 0,69; p = 0,70).
O valor mínimo da calcemia nestes pacientes foi de 4,2mg/dl, o máximo, de 108,0mg/dl e o desvio padrão, de ±12,84mg/dl.
Miringosclerose e Fosfatemia
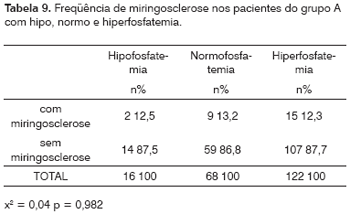
206 pacientes do grupo A tiveram determinada sua fosfatemia no momento do estudo. Destes 206, a hipofosfatemia foi observada em 16 (7,8%), enquanto que 68 (33%) apresentavam valores normais e 122 (59,2%) eram hiperfostatêmicos.
Na Tabela 9, mostra-se a freqüência da miringosclerose em cada um desses subgrupos (hiposfatêmico: 12,5% com miringosclerose; normofosfatêmico: 13,2% com miringosclerose; hiperfosfatêmico: 12,3% com miringosclerose), com um x2 = 0,04 e um p = 0,982.
A média foi de 5,92mg/dl, com o mínimo de 2,20mg/dl, máximo de 62,0mg/dl e desvio padrão de 5,26mg/dl.
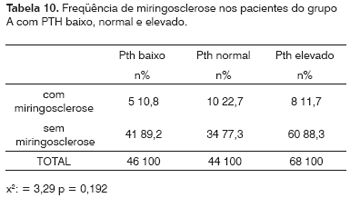
Miringosclerose e Nível Sérico de PTH
Foram dosados os níveis séricos do PTH em 158 pacientes com IRC, entre os quais 46 (29%) tinham PTH abaixo da faixa de normalidade, 44 (28%) apresentaram PTH sérico normal e 68 (43%) mostraram PTH elevado.
Dos 46 pacientes com PTH reduzido, cinco (10,8%) apresentaram placas de miringosclerose, enquanto que este achado otoscópico ocorreu em 10 (22,7%) dos 44 pacientes com PTH normal e 8 (11,7%) entre os 68 pacientes com PTH elevado (x2 = 3,29; p = 0,192), resultados estes demonstrados na Tabela 10.
A média foi de 285,3pg/ml. Os valores variaram de 1pg/ml a 1923pg/ml, com desvio padrão de 380,65pg/ml.
DISCUSSÃO
A timpanosclerose é o estágio final de um processo originado a partir de inflamação aguda ou crônica da lâmina própria da OM.14 Inúmeros autores têm caracterizado os processos patológicos que culminam com a timpanosclerose, que se inicia por uma hiperprodução de colágeno na lâmina própria da mucosa da OM, que sofre, em seguida, hialinização, calcificação e metaplasia óssea ou cartilaginosa.1,5,11,15,16
No entanto, a exata etiopatogenia da timpanosclerose e os motivos pelos quais apenas alguns pacientes apresentam este tipo de processo resolutivo da inflamação não são totalmente conhecidos. Alguns trabalhos têm tentado estabelecer uma associação etiopatogênica com diferentes fatores, como é o caso de Schiff et al.17 e Schiff; Yoo18, que encontram relação da timpanosclerose com reação auto-imune, e Koç; Uneri19, que levantam a hipótese de uma predisposição genética.
O processo de calcificação da placa timpanosclerótica tem várias características semelhantes ao que ocorre em outros tipos de calcificação patológica. Desde há muito, as calcificações ectópicas são estudadas nos seus aspectos estruturais e ultraestruturais. Existem basicamente duas formas de se depositar cristais de cálcio em tecidos diferentes do osso: a calcificação metastática e a calcificação distrófica. A calcificação metastática é aquela que ocorre passivamente pela precipitação de cristais de fosfato de cálcio presentes no soro de pacientes portadores de determinadas doenças.20 Tais calcificações parecem ser dependentes de hipercalcemia e hiperfosfatemia, tendo a elevação do produto cálcio x fósforo papel fundamental na gênese das mesmas.21 As calcificações distróficas envolvem um mecanismo ativo celular complexo que tem sido extensamente pesquisado, mas ainda pouco esclarecido. Este tipo é representado, na doença renal crônica, sobretudo pelas calcificações arteriais e viscerais.20 Alguns autores consideram incerto o papel dos níveis séricos de cálcio e fósforo na fisiopatologia desse tipo de calcificação20, porém vários trabalhos associam essas duas condições.22-24
A taxa de filtração glomerular alterada pela doença renal causa retenção de fosfato no soro. O fósforo sérico em excesso tende a se ligar ao cálcio livre, formando precipitados, que podem, já aí, originar calcificações ectópicas. Esta precipitação faz reduzir a calcemia, o que estimula a produção do PTH pelas glândulas paratireóides, hormônio que tem atuação sobre o metabolismo ósseo, podendo causar desmineralização, com lançamento desses minerais na corrente sangüínea, podendo causar novas calcificações.20,25,26 Parece haver uma falha no mecanismo de feedback entre a calcemia e as paratireóides de forma que se perpetua esse dismetabolismo, sem que haja inibição adequada da secreção do PTH, que também pode ser aumentado em função da redução do calcitriol.25
De um modo ou de outro, é quase certo que o dismetabolismo do cálcio de fósforo presente no doente renal crônico, pela própria doença ou decorrente do tratamento dialítico, é a base para a ocorrência de calcificações ectópicas, principalmente no sistema cardiovascular e nas vísceras. Elas não se dão por um mecanismo único, podendo ocorrer mais de uma via etiopatogênica para explicar os diversos tipos de calcificações e as variedades de dosagens bioquímicas que podem ser encontradas nestes pacientes.
Desde 1969, já são descritas vesículas de matriz como componente fundamental no processo de calcificação patológica de diversos tecidos.12,13 Essas vesículas são encontradas na matriz de colágeno dos tecidos conjuntivos e, à microscopia eletrônica, evidencia-se o seu conteúdo mineral. São originadas da membrana celular de células que sofreram apoptose e, derramadas na matriz colágena difusamente, posteriormente coalescem, culminando por formar uma placa calcária de fosfato de cálcio.12,13,22 Este processo foi demonstrado nas placas ateromatosas de pacientes renais crônicos, sendo fortes as evidências de que a hipercalcemia e a hiperfosfatemia têm participação na origem dessas vesículas.22,27
Vários outros tipos de calcificações, além da aterosclerose, têm também demonstrada a participação de vesículas de matriz, inclusive a timpanosclerose.4
Diversos outros elementos, celulares ou humorais, também são identificados em vários estudos como participantes ativos do processo de calcificação na timpanosclerose ou em outros tecidos acometidos. Os macrófagos, por exemplo, podem diferenciar-se em osteoclastos, bem como produzir proteínas osteoativas.6,7,11 Além desses, a fosfatase alcalina28 e a osteopontina, esta uma proteína de matriz óssea encontrada em vários tecidos calcificados7-10, também podem participar desse processo. Isto mostra nitidamente as enormes semelhanças que guarda o processo de calcificação que ocorre na timpanosclerose com aqueles que acometem diferentes tecidos no paciente renal crônico ou com outras doenças sistêmicas.
Essas semelhanças levantaram a idéia de que a timpanosclerose, apesar de ser um processo sabidamente desencadeado por uma inflamação local decorrente de trauma ou infecção aguda ou crônica da membrana mucosa da OM, podendo surgir independentemente da presença ou não de doenças associadas, poderia sofrer uma influência dos dismetabolismos minerais típicos do doente renal crônico que aumentasse a taxa de prevalência da timpanosclerose nesse grupo de pacientes.
No presente estudo, as características da amostra foram semelhantes, entre os grupos A e B, no que diz respeito à história pregressa de otites e à cor dos indivíduos. Mas diferiram em relação à idade e ao sexo.
Os resultados obtidos e expressos na Tabela 2 mostram que houve uma diferença estatisticamente significativa entre a ocorrência da miringosclerose nos pacientes renais crônicos e no grupo controle (11,7% contra 5,1%), com o grupo A apresentando um risco 1,46 vez maior de apresentar miringosclerose do que os indivíduos sadios. Além de demonstrar uma associação nítida entre a IRC e a ocorrência da miringosclerose, estes números podem também ser utilizados para estimar grosseiramente a prevalência da miringosclerose na população geral no nosso meio (5,1%), dado inexistente na literatura pesquisada.
Se formos analisar o relato, por parte dos indivíduos dos dois grupos, de história prévia de otites, perceberemos pelos dados da Tabela 2 que os dois grupos foram semelhantes, não podendo, portanto, esta variável ter influenciado nos resultados da Tabela 1. Ainda assim, para eliminar qualquer possibilidade deste tipo de influência, foram também analisados apenas os casos sem passado de otite de ambos os grupos. Embora as amostras tenham-se tornado menores com este critério de exclusão, pôde-se constatar que a significância estatística com relação à ocorrência da miringosclerose foi ainda mais alta em favor do grupo A (12,3% contra 4,7%), com um risco 1,53 vez maior. Deve-se, é claro, na análise destes números, levar em conta um viés de memória, pois vários destes pacientes eram idosos e poderiam não referir este dado (passado de otites) com precisão, muito embora ambos os grupos estejam igualmente sujeitos a este tipo de viés.
Com relação à variável sexo, não há trabalhos na literatura estudada que atribua de forma inequívoca, uma maior ou menor predisposição de um dos sexos à timpanosclerose. Entre os trabalhos que relatam a prevalência entre os sexos, existem alguns que não vêem nenhuma diferença2,29,30 e dois em que é encontrada uma prevalência maior no sexo masculino.31,32 Entretanto, nestes dois últimos estudos, admite-se que essa diferença em favor dos homens se deva à maior incidência (já bem conhecida) das doenças inflamatórias da OM nos homens.
Os grupos avaliados no presente estudo foram bastante diferentes quanto ao sexo (p < 0,001), com um predomínio muito maior do sexo feminino no grupo B. Isto pode ser explicado pelo fato de que este grupo foi formado por acompanhantes dos pacientes do ambulatório e enfermaria de Otorrinolaringologia, que têm as mesmas características sócio-econômicas dos pacientes estudados, porém, em sua grande maioria, são do sexo feminino. Entretanto, na verdade, se avaliarmos, entre os indivíduos deste estudo, a relação entre o sexo e a ocorrência de miringosclerose (nos grupo A ou B), veremos que, apesar de não haver diferença estatisticamente relevante (p = 0,94), as mulheres predominaram entre os indivíduos com miringosclerose (60,3% contra 39,7%). Se esta tendência fosse confirmada, seria esperada uma maior ocorrência da miringosclerose no grupo B, onde houve muito mais mulheres. Mesmo assim, o contrário ocorreu, como se vê na Tabela 1, reforçando a hipótese de que a IRC seja um fator predisponente à calcificação na OM.
Houve uma diferença estatisticamente relevante entre os dois grupos com relação à cor da pele. Entretanto, não acreditamos que essa desigualdade possa ter influenciado os resultados da comparação da ocorrência de miringosclerose entre os grupos A e B, uma vez que não há nenhum relato que aponte alguma diferença estatisticamente relevante entre as raças no tocante à prevalência da timpanosclerose. Por outro lado, quando comparamos a freqüência da miringosclerose entre os três diferentes grupos etários, não se percebe diferença significativa, o que elimina a possibilidade de esta variável ter influenciado os resultados.
Com relação à faixa etária, pode-se observar que os grupos foram diferentes na distribuição das faixas etárias. Existe controvérsia na literatura com respeito à faixa etária de maior acometimento da timpanosclerose. Alguns autores consideram-na mais prevalente nas crianças por serem essas mais sujeitas a otites médias e à cirurgia para colocação de tubos de ventilação. Outros, por ser a timpanosclerose um processo crônico irreversível, admitem que ela seja mais prevalente nas faixas etárias mais avançadas29,32, apesar de Møller10 ter demonstrado que este processo pode ser reversível. Parece haver uma curva bimodal na prevalência da timpanosclerose de acordo com a idade, com um primeiro pico nas crianças, que estão mais sujeitas a otites e a cirurgias de tubo de ventilação, e outro pico após os 40 anos, quando deve falar mais alto o caráter progressivo e irreversível da timpanosclerose do adulto. Entre esse dois picos, uma zona de menor prevalência poderia ser explicada pelo poder de regressão espontânea observado nas crianças. A nossa amostra não permite uma boa avaliação da faixa etária mais acometida por não possuir crianças ou adolescentes, apenas indivíduos adultos. Nesses, tanto no grupo A quanto no grupo B, nota-se uma maior ocorrência nas faixas etárias intermediárias (Gráficos 1, 2 e 3), de 21 a 40 e de 41 a 60 anos de idade. Entretanto, nota-se uma inversão na freqüência destas duas faixas entre os dois grupos, prevalecendo, no grupo A, os indivíduos acima de 40 anos (Tabelas 2 e 3). Isto pode ter tido alguma influência no resultado final, apesar de os trabalhos revistos não conseguirem definir de forma consensual a relação timpanosclerose x idade. Quando avaliamos a ocorrência da miringosclerose isoladamente em cada uma daquelas duas faixas de idade (Tabelas 4 e 5), podemos observar que a diferença encontrada foi menor do que a da análise global (RP = 1,29 com p = 0,39 na faixa dos 21 aos 40 anos e RP = 1,37 com p = 0,11 na faixa dos 41 aos 60 anos), não havendo diferença estatisticamente significante. Desse modo, não podemos afirmar com certeza que a IRC possa ter tido participação na gênese da miringosclerose nos pacientes estudados, muito embora note-se sempre uma tendência à maior ocorrência desta alteração timpânica no grupo de pacientes renais crônicos. É preciso também levar-se em consideração que o avanço da idade tende a coincidir tanto com o tempo de existência, bem como com a gravidade da doença renal, que entram em jogo como variáveis de confusão. Talvez a formação de um grupo controle pareado por idade pudesse esclarecer melhor estas questões.
Entre os pacientes do grupo A com e sem miringosclerose, não houve diferença significativa com relação ao tempo de diálise (p = 0,37). Isto coincide com a observação de Kabaya et al.33, que também não encontraram influência do tempo de diálise na incidência de calcificação vascular em pacientes hemodializados. Também está de acordo com Leskinen et al.34, que não acharam diferença importante nas calcificações carotídeas de pacientes renais crônicos antes ou após o tratamento dialítico. Muito embora vários autores admitem que alterações metabólicas induzidas pelo próprio tratamento dialítico possam ter ação na etiopatogenia das calcificações ectópicas em pacientes com IRC, não há consenso na literatura a esse respeito. Os nossos resultados sugerem que, em sendo a timpanosclerose um fenômeno possivelmente influenciado pela doença renal, o tempo de hemodiálise não parece ter um papel importante na gênese desse processo patológico.
Os níveis séricos de cálcio e fósforo, dosados em uma parte dos pacientes renais crônicos, não se mostraram diferentes entre os que apresentaram ou não otoscopia positiva. A presença de hipo ou hipercalcemia nestes pacientes não alterou a ocorrência da miringosclerose (p = 0,70), o mesmo ocorrendo com a hipo ou hiperfosfatemia (p = 0,982), como se vê nas Tabelas 6 e 7. Com relação ao PTH, a Tabela 8 mostra que houve uma ocorrência maior da miringosclerose justamente nos pacientes que possuíam esta dosagem normal (22,7% contra 10,8% e 11,7%, entre os pacientes com dosagem baixa e alta de PTH, respectivamente), o que, entretanto, não foi estatisticamente significativo (p = 0,192). Esses dados, à primeira análise, fazem supor que, se há uma relação de causa e efeito entre a IRC e a timpanosclerose, o mecanismo etiopatogênico dessa calcificação seja semelhante ao das calcificações vasculares e viscerais, conforme considera Alfrey.20 Entretanto, as dosagens de cálcio, fósforo e PTH dos pacientes deste estudo foram feitas uma única vez, na ocasião da inclusão do paciente no estudo, representando mais um retrato momentâneo da situação metabólica em um determinado instante do que um padrão de dismetabolismo instalado nos pacientes. É sabido que, nestes doentes, os níveis destes elementos no sangue podem variar e alternar enormemente de acordo com as diversas fases evolutivas da insuficiência renal, com tratamento dialítico e com fatores associados, como diabetes, regime alimentar, entre outros.
Considerando todas as variáveis estudadas, parece realmente poder haver uma influência significativa do estado de IRC no surgimento da timpanosclerose. Os mecanismos pelos quais a doença renal leva a este fato, entretanto, não ficam bem esclarecidos pelos achados deste estudo, pois não houve influência dos desvios metabólicos, nem do tempo de tratamento hemodialítico na freqüência da miringosclerose, muito embora seja sabido pela literatura que a ação das alterações do cálcio, fósforo e do PTH nas calcificações patológicas pode ser exercida sem que necessariamente haja detecção de elevação destes níveis séricos. De qualquer forma, como já está bem definido que as alterações ultraestruturais encontradas na timpanosclerose são bastante semelhantes àquelas encontradas nas calcificações vascular e visceral do doente renal crônico e, como as alterações metabólicas séricas destes pacientes estão presentes sistemicamente no organismo, é lógico inferir-se que o poder de atuação destas alterações sobre o processo de calcificação se exerça da mesma forma na lâmina própria da mucosa da OM. Isto parece ficar mais evidente no grupo de pacientes que, mesmo sem história de doença inflamatória otológica, apresentaram miringosclerose, tendo, como única causa evidente, a doença renal, apesar do viés de memória já comentado, que pode ter influenciado de forma incerta estes resultados.
Finalmente, se forem tomados apenas os indivíduos do grupo controle, pode-se considerar como sendo em torno de 5% a prevalência da timpanosclerose na população em geral acima dos 20 anos de idade. É possível que este índice fosse ainda maior se fossem incluídos na análise indivíduos de 0 a 20 anos, porém esta definição não foi objeto deste trabalho.
CONCLUSÕES
Não houve influência dos níveis séricos do cálcio, fósforo ou PTH na ocorrência da miringosclerose no grupo de estudo.
Não houve influência do tempo de hemodiálise na ocorrência da miringosclerose no grupo de estudo.
Houve diferença estatisticamente significante entre o grupo de pacientes portadores de IRC e o grupo controle com relação à freqüência de miringosclerose.
Não se pode, entretanto, por esses dados afirmar com certeza que a IRC tenha tido relação com o aumento da ocorrência de miringosclerose, uma vez que a variável idade pode ter influenciado nos resultados obtidos.
REFERÊNCIAS BIBLIOGRÁFICAS
1. House WF, Sheehy JL. Tympanosclerosis. Arch Otolaryngol 1960;72:38-43.
2. Buyanover D, Tetz A, Luntz M, Sadé J. The biochemical composition of tympanosclerotic deposits. Arch Otorhinolaryngol 1987;243:366-9.
3. Forséni M, Eriksson A, Bagger-Söbäck D, Nilsson J, Hulcrantz M. Development of Tympanosclerosis: Can Predicting factors BE IDENTIFIED? Am J Otol 1997;18:298-303.
4. Friedman I, Galey FR: Initiation and stages of mineralization in tympanosclerosis. J Laryngol Otol 1980;94:1215-29.
5. Zallone AZ, Teti A, Iurato S. Metaplasic bone tissue in tympanosclerosis. Acta Otolaryngol 1983;95:554-9.
6. Makiishi-Shimobayashi C, Tsujimura T, Sugihara A, Iwasaki T, Yamada N, Terada N, Sakagami M. Expression of osteopontin by exudate macrophages in inflammatory tissues of the middle ear: a possible association with development of tympanosclerosis. Hear Res 2001;153(1-2):100-7.
7. Shanahan CM, Cary NR, Metcalfe JC, Weissberg PL. High expression of genes for calcification-regulating proteins in human atherosclerotic plaques. J Clin Invest 1994;93:2393-402.
8. Hirota S, Imakita M, Kohri K, Ito A, Morii E, Adashi S, Kim HM, Kitamura Y, Yutani C, Nomura S: Expression of osteopontin messenger RNA by macrophages in atherosclerotic plaques: a possible association with calcification. Am J Pathol 1993;143:1003-8.
9. O'Brien KD, Kuussisto J, Reichnbach DD, Ferguson M, Giachelli CM, Alpers CE, Otto CM. Osteopontin is expressed in human aortic valvular lesions: evidence that aortic valve calcification may be actively regulated. Circulation 1995;92:2163-8.
10. Moller P. Tympanosclerosis of the ear drum. A scanning electronmicroscopic study. Acta Otolaryngol 1981;91:215-21.
11. Forséni Flodin M. Macrophages and possible osteoclast differenciation in the rat bullar bone during experimental acute otitis media, with reference to tympanosclerosis. Otol Neurotol 2001;22:771-5.
12. Anderson HC. Vesicles associated with calcification in the matrix of epiphyseal cartilage. J Cell Biol 1969;41:59-72.
13. Anderson HC. Mechanisms of pathological calcification. Rheum Dis Clin North Am 1988;14:303-19.
14. Ferlito A. Histopthogeneis of tympanosclerosis. J Laryngol Otol 1979;93:25-37.
15. Zöllner F. Tympanosclerosis. Arch Otolaryng (Chic)1963;78:538-44.
16. Zöllner F. Tympanosclerosis. Arch Otolaryngol 1969;89:207-11.
17. Schiff M, Poloquin JF, Catanzarro A, Ryan AF. Tympanosclerosis. A theory of pathogenesis. Ann Otol Rhinol Laringol 1980;86:1-16.
18. Schiff M, Yoo TJ. Immunologic aspects of otologic disease: an overview. Laryngoscope 1985;95:259-69.
19. Koç A, Üneri C. Genetic predisposition for tympanosclerotic degeneration. Eur Arch Otorhinolaryngol 2002;259:180-3.
20. Alfrey AC. Phosphate, aluminum, and other elements in chronic renal failure. In: Schrier RW, Gottschalk CW (eds.): Diseases of the Kidney, 6th ed., vol. III, Boston: Little Brown and Co., 1997. p. 2899-911
21. Di Leo C, Gallieni M, Bestetti A, Tagliabue L, Cozzolino M, Carpani P, Pozzato C, Tarolo GL, Brancaccio D. Cardiac and pulmonary cacification in a hemodialisis patient: partial regression 4 years after parathyroidectomy. Clin Nephrol 2003;59:59-63.
22. Shioi A, Taniwaki H, Jono S, Okuno Y, Koyama H, Mori K, Nishizawa Y. Mönckeberg's medial sclerosis and inorganic phosphate in uremia. Am J Kidney Dis 2001(Suppl);138:S47-9.
23. Moe SM, O'Neill KD, Duan D, Ahmed S, Chen NX, Leapman SB, Fineberg N, Kopecky K. Medial artery calcification in ESRD patients is associated with deposition of bone matrix proteins. Kidney Int 2002;61:638-47.
24. Reslerova M, Moe S. Vascular calcification in dialysis patients: pathogenesis and consequences. Am J Kidney Dis 2003;41(Suppl 3):S96-9.
25. Andress DL, Donald JS. The osteodystrofhy of chronic renal failure. In: Schrier RW, Gottschalk CW (eds.): Diseases of the Kidney, 6th ed., vol. III, Boston: Little Brown and Co.; 1997. 2597-624.
26. Hruska KA, Slatopolsky E. Disorders of phosphorus, calcium, and magnesium metabolism. In: Schrier RW, Gottschalk CW (eds.): Diseases of the Kidney, 6th ed., vol. III, Boston: Little Brown and Co.; 1997. 2477-526.
27. Tanimura A, McGregor DH, Anderson HC. Clacification in atherosclerosis. I. Human studies. J Exp Pathol 1986;2:261-73.
28. Chen NX, O'Neill KD, Duan D, Moe SM. Phosphorus and uremic serum up-regulate osteopontin expression in vascular smooth muscle cells. Kidney Int 2002;62:1724-31.
29. Kinney SE. Postinflamatory ossicular fixation in tympanoplasty. Laryngoscope 1978;88:821-38.
30. da Costa SS, Paparella MM, Schachern PA, Yoon TH, Kimberley BP. Temporal bone histopthology in chronically infected ears with intact and perforated tympanic membranes. Laryngoscope 1992;102:1229-36.
31. Koç A, Uneri C. Sex distribution in children with tympanosclerosis after insertion of a tympanostomy tube. Eur Arch Otorhinolaryngol 200;258:16-9.
32. Bhaya MH, Schachern PA, Morizono T, Paparella MM. Pathogenesis of tympanosclerosis. Otolaryngol Head Neck Surg 1993;109:413-20.
33. Kabaya T, Nitta K, Kimura H, Kawashima A, Narusaka K, Nihei H. Increased aortic calcification index in hemodialysis patients. Nephron 1999;81:354-5.
34. Leskinen Y, Lehtimäki T, Loimaala A, Lautamatti V, Kallio T, Huhtala H, Salenius JP, Saha H. Carotid atherosclerosis in chronic renal failure - the central role of increased plaque burden. Atherosclerosis 2003;171:295-302.
1 Livre-Docente. Professor Adjunto e Coordenador da Disciplina de Otorrinolaringologia da UFPE.
2 Mestrado em Saúde Pública. Professor Assistente da Disciplina de Bases da Fonoaudiologia da UFPE.
3 Especialista em otorrinolaringologia. Médico Otorrinolaringologista.
4 Professor Livre-Docente pela Universidade Federal de Pernambuco.
5 Doutorado. Médica preceptora voluntária do serviço de otorrinolaringologia do Hospital das Clínicas - UFPE.
Trabalho realizado nos Serviços de Otorrinolaringologia e de Nefrologia do Hospital das Clínicas da Universidade Federal de Pernambuco - UFPE.
Endereço para correspondência: Silvio Caldas Neto - Rua Poeta Zezito Neves 38 ap. 1801 51020-200 Recife PE.
Tel. (0xx81) 3467-1256/3416-1634/3416-1635 - E-mail: caldas@hotlink.com.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 31 de outubro de 2006. cod 3483
Artigo aceito em 23 de outubro de 2007.