Ano: 2008 Vol. 74 Ed. 3 - Maio - Junho - (6º)
Seção: Artigo Original
Páginas: 342 a 349
Estudo audiológico de uma população idosa brasileira
Audiological study of an elderly brazilian population
Autor(es): Luís Cláudio do Carmo1, José Alexandre Médicis da Silveira2, Sílvio Antônio Monteiro Marone3, Fabiana Gonçalez D'Ottaviano4, Ludmila Lima Zagati5, Eliane Maria Dias von Söhsten Lins6
Palavras-chave: audiometria tonal, idoso, presbiacusia
Keywords: tonal audiometry, elderly, presbycusis
Resumo:
A população idosa brasileira cresce e representa 8,6% do total populacional. Fatores ambientais, hábitos de vida, sexo e fatores genéticos interferem na evolução da presbiacusia que reduz a qualidade de vida. Objetivo: Investigar queixas audiológicas e vestibulares em idosos, executar audiometria tonal, verificar se há diferenças entre os sexos. Forma de Estudo: Clínico prospectivo de corte transversal. Material e Método: 320 pacientes idosos (160 homens e 160 mulheres) foram submetidos a anamnese audiológica e audiometria tonal. Análise estatística dos resultados pelos testes ANOVA, Mann-Whitney e Qui-Quadrado. Resultado: As queixas audiológicas e vestibulares (perda auditiva, tinnitus, plenitude auricular, tontura) foram similares entre os sexos (exceção, a tontura: p<0,05); audiometria tonal apresentou diferença significante, com perda auditiva nas altas freqüências entre os homens, e entre as mulheres, curvas descendentes e planas. Esses resultados foram estaticamente significantes (p<0,001). Conclusão: Os resultados permitem concluir que, quando comparados os sexos, a perda auditiva no idoso possui sintomatologia semelhante, mas apresenta diferenças significativas na audiometria tonal.
Abstract:
The Brazilian elderly population is growing, and already represents 8,6% of our total population. Environmental factors, lifestyle, gender and genetics impact the development of presbycusis, which reduces quality of life. Aim: investigate audiologic and vestibular complaints in the elderly; perform tonal audiometry and check to see if there are differences between genders. Study: Cross-sectional clinical prospective study. Materials and Methods: 320 elderly patients (160 men and 160 women) were submitted to audiologic interview and tonal audiometry. The results were statistically analyzed by the following methods: ANOVA, Mann-Whitney and Chi-Squared. Results: audiologic and vestibular complaints (hearing loss, tinnitus, ear fullness, dizziness) were similar between the genders (except for dizziness: p<0,05); tonal audiometry showed a significant difference, with hearing loss in the high frequencies among men; and among women the curves were descending and flat. These results were statistically significant (P<0,001). Conclusion: our results lead us to conclude that, when the genders are compared, hearing loss in the elderly has similar symptoms; however, there are significant differences in tonal audiometry.
![]()
INTRODUÇÃO
No Brasil, a situação do idoso passou a despertar o interesse de diferentes áreas da sociedade após 1976, quando foram realizados os primeiros seminários sobre a problemática das pessoas idosas em nosso meio. Consultando-se os dados do IBGE1, pode-se constatar que nas últimas décadas têm sido, de fato, acelerado o processo de crescimento da população brasileira considerada idosa (indivíduos com 60 anos ou mais de idade).
O Censo Nacional de 1960 revelava que a população brasileira era constituída por 4,7% de idosos, subindo vagarosamente para 5,1% nos anos 70 e alcançando 6.1% de idosos no início da década de 801.
No Censo Nacional de 2000, descobriu-se que os idosos no Brasil representam 8,6% da população, o que equivale a um contingente de 14,5 milhões de pessoas. Em relação a 1991, houve um crescimento de 35,5% na quantidade total de pessoas idosas. Naquele ano, a proporção desse segmento na população total era igual a 7,3% ou 10,7 milhões de idosos1.
O aumento da população de idosos poderia sugerir sua associação com o aumento da esperança média de vida da população brasileira, indicador social da melhoria da qualidade de vida e bem-estar social. Entretanto, ainda que se tenha elevado a esperança média de vida, isso não significa que tenham melhorado as condições objetivas de vida para o idoso2. Sem dúvida alguma, a privação sensorial proveniente do declínio da acuidade auditiva representa uma das mais terríveis causas de isolamento social para o idoso3.
Berkowitz4 afirmou que aproximadamente 55% dos adultos americanos com perda auditiva significativa suficiente para interferir com a recepção de fala estão com mais de 65 anos. Estatísticas mais recentes revelaram que a presbiacusia afeta aproximadamente 25% da população americana entre 65 e 74 anos e 38% da população acima dessa idade5.
Zwaardemaker6 foi o primeiro pesquisador a descrever a perda auditiva para freqüências altas e, mais tarde, a utilizar o termo presbiacusia, o qual, literalmente, significa "perda auditiva no velho", ou, segundo Davis7, o decréscimo fisiológico da audição com a idade. Estritamente, a presbiacusia poderia ser caracterizada como "uma perda auditiva bilateral para tons de alta freqüência, devida a mudanças degenerativas e fisiológicas no sistema auditivo com o aumento da idade"8.
Bunch9 demonstrou as mudanças audiométricas para as altas freqüências, documentando o declínio da função auditiva nas freqüências acima de 500Hz, à medida que a idade avançava. Ainda observou que a presbiacusia atinge a população na seguinte ordem: homens brancos > mulheres brancas > homens negros > mulheres negras.
Crowe et al.10 e Saxén11 foram os primeiros a associar patologias de orelha interna com a perda auditiva para as altas freqüências. Descreveram duas mudanças patológicas: uma, envolvendo o órgão de Corti e outra, envolvendo os neurônios do gânglio espiral. A perda auditiva indicada pelo audiograma foi atribuída tanto à atrofia do órgão de Corti, quanto à atrofia do nervo coclear, na porção basal da cóclea.
Schuknecht12 classificou a presbiacusia em quatro categorias: sensorial, neural, metabólica e mecânica. Johnson & Hawkins13 criaram mais duas categorias de presbiacusia: vascular e central. Por fim, Corso8 enfatizou que uma vez que esses seis tipos de presbiacusia tenham sido identificados, raramente, ocorreriam separadamente.
Kirikae et al.14 encontraram mudanças degenerativas nos núcleos da via auditiva e concluíram que "mudanças senis das células nervosas devem ser consideradas como um importante fator na origem da presbiacusia".
Hansen & Reeske-Nilsen15 realizaram uma pesquisa nos núcleos cocleares em 12 cérebros de pessoas idosas e concluíram que deve haver uma redução nas células do núcleo coclear comparadas a cérebros normais.
Suga & Linsay16 observaram que a mudança histopatológica mais proeminente na orelha interna era uma diminuição na população de células do gânglio espiral.
Schuknecht17 afirmou que com o aumento da idade, há diminuição da capacidade de mitose de certas células, diminuição de proteína nuclear, acúmulo de pigmentos e outros compostos insolúveis no citoplasma e alterações químicas no fluido intercelular.
Em relação aos fatores predisponentes para perda auditiva no idoso, Glorig & Nixon18 criaram o termo "socioacusia", isto é, o efeito global inevitável da exposição diária não-ocupacional ao ruído, infecções, drogas e trauma acústico. A perda auditiva no envelhecimento seria, para aqueles autores, o efeito combinado da presbiacusia, socioacusia e ruído ocupacional.
Rosen et al.19 realizaram uma avaliação audiométrica em homens pertencentes a uma tribo no Sudão, os Mabaans, grupo este não afetado por ruído, arteriosclerose, fumo e drogas. Os resultados deste estudo revelaram um declínio mínimo da audição à medida que a idade aumentou, assim, com poucos indícios de perda auditiva relacionada à idade ou ao sexo.
Outros dados importantes foram obtidos através da comparação entre o modo de vida dos habitantes rurais e urbanos feita por Weston20. Os resultados demonstraram que a sensibilidade auditiva dos habitantes rurais era, significativamente, superior a dos moradores urbanos.
Hinchcliffe21 examinou uma população semelhante na Jamaica, obtendo resultados que mostraram muito pouca diferença nas perdas auditivas relacionadas à idade entre os idosos jamaicanos e escoceses.
Para Gilad & Glorig22, a perda auditiva devida ao envelhecimento seria o resultado do efeito cumulativo de vários fatores extrínsecos adicionados aos modelos de idade, geneticamente, determinados.
Anderson & Meyerhoff23 também afirmaram que a evolução da presbiacusia parece estar relacionada também a outros fatores, tais como: dieta, metabolismo, níveis de colesterol, pressão arterial, arteriosclerose, exercício físico, hábito de fumar, exposição ao ruído e estresse.
De acordo com Mader24, pessoas idosas com perda auditiva sensorineural seriam, provavelmente, melhor descritas como possuidoras de perda auditiva devido ao envelhecimento, sendo que tal perda engloba: presbiacusia ou degeneração fisiológica, socioacusia que inclui trauma por ruído ambiental, trauma por ruído ocupacional, nosacusia (componente da perda auditiva relacionado a outras doenças ou efeito de ingestão de drogas, medicamentos), predisposição genética.
Segundo Gates25, estudos audiométricos realizados em populações isoladas não-industrializadas identificaram um declino mínimo da audição em função do aumento da idade, diferentemente das populações industrializadas, reforçando as condições sociais como exposição ao ruído, uso do álcool e fumo, características de alimentação e fatores genéticos como agravantes da perda auditiva no idoso.
O estudo de Cruickshanks et al.26 revelou que os fumantes apresentam desenvolvimento quase duas vezes maior de perda auditiva que os não-fumantes. Não obstante, a associação do tabagismo com dislipidemias parece agravar ainda mais a evolução da presbiacusia, bem como antecedentes de hipertensão arterial isolada ou associada a outros fatores de risco que podem ser potencializadores do quadro27.
A interação entre exposição ao ruído e presbiacusia também foi estudada e demonstrou envolver mecanismos mais complexos que uma simples somação de perdas. Em experimentos nos quais os animais de laboratório eram submetidos a níveis de ruído de baixa a moderada intensidade por longo tempo, nas exposições de curta duração e de alta intensidade, esse mecanismo parece não ser exato28.
Sobre a presença de sintomas associados à perda auditiva no idoso, Bora et al.29 afirmaram que presbiacusia, desequilíbrio, vertigem e tinnitus representam as principais queixas otorrinolaringológicas dos pacientes geriátricos.
Segundo Schneider et al.30, tinnitus é um dos sintomas mais importantes em neurootologia depois de vertigem, náusea e perda auditiva, havendo um aumento de todas essas queixas com a idade. Ahmad & Seidman (2004)31 afirmaram que a prevalência do tinnitus aumenta com a idade e que há uma maior incidência quando a perda auditiva no idoso é induzida pelo ruído.
Para Rosenthall & Karlsson32, os tinnitus estariam presentes de forma constante em 8 a 15% dos casos, normalmente quando há perdas auditivas maiores e, como um sintoma intermitente, em cerca de 20 a 42%. Na pesquisa de Nondahl et al.33, a prevalência variou de 5,7 a 8,2% dos pacientes idosos. No estudo de Sindhusake et al.34 com 2015 idosos, a prevalência de tinnitus foi de 30,3%, com 48% desses com queixa bilateral, sendo que somente 6% receberam algum tratamento para esse problema.
Por outro lado, os sintomas labirínticos também podem acompanhar o quadro de perda auditiva e seriam decorrentes da incidência de alterações degenerativas no sistema vestibular, como degeneração do feixe nervoso sacular e de seu neuroepitélio, assim como do sistema otolítico sacular e, em menor grau, do sistema otolítico utricular35. Para Katsarkas36, 12,22% dos pacientes internados na clínica de vertigem do Royal Victoria Hospital tinham 70 anos ou mais na primeira visita médica.
Segundo Huang et al.37, nos pacientes idosos, vertigem e distúrbios do equilíbrio seriam causados por diferentes tipos de disfunções patológicas vestibulares periféricas e centrais. Da mesma forma, o decréscimo funcional dos sistemas e órgãos vestibulares afetados pelos processos patológicos do envelhecimento e diferentes doenças concomitantes, assim como fatores ambientais e psicogênicos, também poderiam estar envolvidos37.
Os objetivos desse estudo foram investigar as queixas audiológicas e labirínticas de uma amostra da população idosa brasileira e caracterizar o perfil audiométrico desses idosos, avaliando diferenças entre os sexos.
MATERIAL E MÉTODO
Realizou-se um estudo do tipo corte transversal em uma unidade de atendimento ambulatorial (nível secundário), numa região onde a maior parte da população idosa é bastante carente (classes D e E)1. O projeto de pesquisa foi submetido e aprovado pelo Comitê de Ética em Pesquisa (CEP) responsável pela instituição (CAAE 010.0.253.000-06).
A casuística foi constituída por um grupo de 320 indivíduos portadores de uma ou mais queixas audiológicas ou labirínticas associadas (disacusia, tinnitus, plenitude auricular, tontura), de limite mínimo de idade de 60 anos ("idosos") para os sexos masculino e feminino.
Interrogou-se a presença das queixas acima mencionadas. Investigou-se ainda a presença de fatores agravantes da perda auditiva no idoso, tais como hipertensão arterial sistêmica, diabetes mellitus, hiperlipidemia, tabagismo e exposição ocupacional a ruídos, a fim de caracterizar melhor a população estudada.
Realizou-se audiometria tonal liminar, determinando-se os limiares de audibilidade nas vias aérea e óssea. Definiu-se o tipo de perda auditiva, conforme preconizam Santos & Russo38, em: normal, condutiva, mista e sensorineural. Utilizaram-se as denominações descendentes, ascendentes, horizontais e irregulares para subdividir a perda sensorineural, segundo a mesma referência. A classificação do grau de disacusia segundo o limiar seguiu as orientações de Kemker39: <25dBNA normal; 26-40dBNA leve; 41-55 dBNA moderado; 56-70 dBNA moderadamente severo; 71-90dBNA severo; 91-110 dB NA profundo. Para caracterização das freqüências, utilizou-se a classificação de Davis7, ou seja, médias de 500, 1000 e 2000Hz (graves) e de 3000 e 4000Hz (agudos).
Para comparação dos resultados entre os sexos, utilizaram-se os testes de ANOVA e Mann-Whitney na análise de variáveis quantitativas e o teste de Qui-Quadrado para as variáveis qualitativas. O nível de significância (?) para rejeição da hipótese de nulidade foi fixada em 5% (ou seja, p < 0,05). O software utilizado foi o EpiInfo, versão 3.3.2.
RESULTADOS
A análise dos indivíduos idosos (n=320), segundo a idade e o sexo, apresentou dois grupos homogêneos, de distribuição normal e com diferença estatisticamente significativa (Tabela 1).
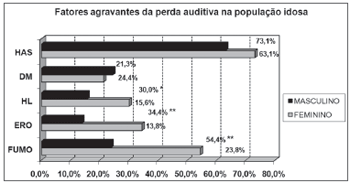
A investigação de fatores agravantes da perda auditiva no idoso demonstrou uma elevada porcentagem de doenças cardiovasculares e metabólicas e também de fatores extrínsecos, como tabagismo e exposição a ruídos (Gráfico 1). Houve relação entre a presença de alguns desses fatores e o sexo (hiperlipidemia: p<0.05; tabagismo e exposição a ruídos: p<0,001).
Gráfico 1. Distribuição dos indivíduos idosos(n=320) segundo a presença de fatores agravantes e o sexo. - HAS:hipertensão arterial sistêmica; DM:diabetes mellitus; HL:hiperlipidemia; ERO:exposição a ruído ocupacional; FUMO: tabagismo; Qui-quadrado: *p<0,001
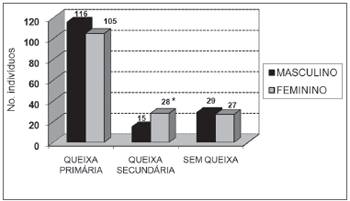
Dentre os sintomas investigados, a perda auditiva foi o mais freqüente, seguido pelos tinnitus, tontura e plenitude auricular (Gráficos 2 e 3). Encontrou-se relação com o sexo somente a tontura (p<0,05).
Gráfico 2. Distribuição dos indivíduos idosos(n=320) segundo a presença de queixas audiológicas ou labirínticas e o sexo. - Qui-quadrado: *p<0,05
Gráfico 3. Distribuição dos indivíduos idosos(n=320) segundo a queixa de perda auditiva e o sexo. - Qui-quadrado: *p<0,05
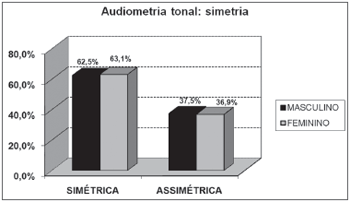
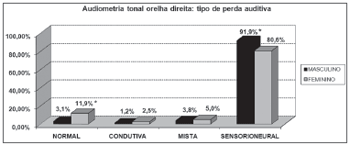
Em relação à audiometria tonal, observou-se importante proporção de assimetria entre as orelhas, sem relação com o sexo (Gráfico 4). As perdas sensorineurais foram as mais encontradas, notando-se diferenças significativas entre os sexos (Gráficos 5 e 6).
Gráfico 4. Distribuição dos indivíduos idosos(n=320) segundo a simetria das orelhas na audiometria tonal e o sexo. - Qui-quadrado: p>0,05
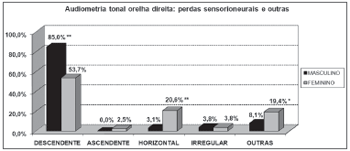
Gráfico 5. Distribuição dos indivíduos idosos(n=320) segundo a classificação da perda auditiva na audiometria tonal de orelha direita e o sexo. - Qui-quadrado: *p<0,05
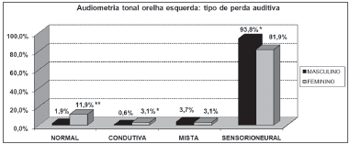
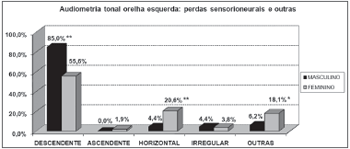
Gráfico 6. Distribuição dos indivíduos idosos(n=320) segundo a classificação da perda auditiva na audiometria tonal de orelha esquerda e o sexo. - Qui-quadrado: *p<0,001
Sobre o tipo de curva mais comum, encontrou-se predomínio de perdas mais acentuadas em agudos que em graves (curvas descendentes) em ambos os sexos (Gráficos 7 e 8). Contudo, no sexo feminino, a presença de curvas horizontais foi bastante freqüente, demonstrando relação entre as duas variáveis (p<0,001).
Gráfico 7. Distribuição dos indivíduos idosos(n=320) segundo o tipo de perda sensorioneural na audiometria tonal de orelha direita e o sexo. - Qui-quadrado: *p<0,001
Gráfico 8. Distribuição dos indivíduos idosos(n=320) segundo o tipo de perda sensorioneural na audiometria tonal de orelha esquerda e o sexo. - Qui-quadrado: *p<0,001
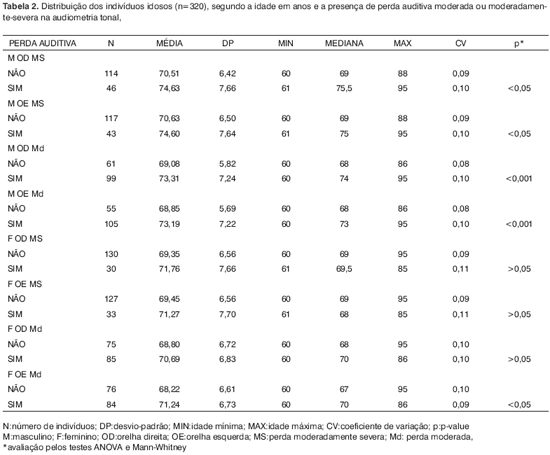
Com os resultados dos limiares tonais e considerando perda auditiva moderadamente severa (>55dBNA), em graves ou agudos, como sinal de agravamento da disacusia, encontrou-se relação entre o aumento da idade e piora da perda auditiva somente no sexo masculino (p<0.05). Quando se considerou grau moderado de perda auditiva (>41dB NA), essa relação se torna ainda mais evidente, com p<0,001 (Tabela 2).
DISCUSSÃO
A partir dos resultados obtidos com a análise descritiva da população idosa pesquisada, consegue-se notar que os dois grupos formados (masculino e feminino), em relação à idade, possuem distribuição normal, com semelhante variabilidade de dados, favorecendo, dessa forma, a confiabilidade da inferência estatística.
Observou-se alta incidência de fatores agravantes da perda auditiva na população estudada, principalmente hipertensão arterial sistêmica (63,1%, homens; 73,1%, mulheres), tabagismo e exposição nos homens (54,4% e 34,4, respectivamente) e hiperlipidemia nas mulheres (30,0%). Vários autores, desde Rosen et al.19 e sua pesquisa com os Mabbans até mais recentemente Huang37, têm pesquisado sobre a interação de doenças cardiovasculares e fatores extrínsecos com a presbiacusia18-28,37. Os dados de nosso estudo conseguem ilustrar a necessidade de controle dessas patologias para o êxito na condução do paciente geriátrico com queixas auditivas e labirínticas.
A freqüência de tinnitus (64,4% e 72,5%, respectivamente, homens e mulheres) em nosso estudo foi superior a outros trabalhos envolvendo idosos (Rosenthall 20 a 42%; Nondahl, 5,7 a 8,2%; Sindhusake 30,3%)32-34. Essa diferença talvez tenha relação com o fato de que foram inclusos em nossa pesquisa apenas idosos com uma ou mais queixas audiológicas. Assim, teríamos uma maior porcentagem de tinnitus quando associado a perdas auditivas maiores32.
Sobre a queixa de tontura, houve relação com o sexo (p<0,05), sendo mais comum nas idosas (20,0%). Em sua pesquisa, Kamierczak & Doroszewska40 concluem que apesar de não ter encontrado nenhuma diferença na distribuição de tontura entre homens e mulheres idosos, a vertigem é mais freqüente entre as mulheres. Ainda mais, que déficits multissensoriais, drogas ou doenças sistêmicas, comum nos idosos, podem ser as causas de vertigem40.
Segundo os resultados da audiometria tonal, constataram-se elevação dos limiares auditivos, principalmente nas altas freqüências, em ambos os sexos. Porém, a perda auditiva pior em agudos foi mais evidente entre os homens que nas mulheres, o que pode ser visto através da maior porcentagem de curvas descendentes no sexo masculino (85,0% em ambas as orelhas) que no feminino (53,7% e 55,6%, respectivamente, direita e esquerda).
Por outro lado, observou-se significativa relação entre o sexo feminino e a alteração audiométrica de agudos e graves. Essa relação foi caracterizada pela presença de curvas horizontais bastante freqüentes entre as idosas (20.6% em ambas as orelhas). O mesmo não foi observado entre os homens (3,1% e 4,4%, respectivamente, direita e esquerda).
A elevação gradual dos limiares de audibilidade com o aumento da freqüência já era esperada nos dois sexos, uma vez que a presbiacusia é uma perda sensorineural que se desenvolve primeira e mais severamente para as freqüências altas, pois, de acordo com os estudos histológicos realizados Crowe et al. e Schuknecht, há uma atrofia do órgão de Corti e do ramo coclear do nervo vestíbulo-coclear na porção basal da cóclea10,12.
Vários outros autores já afirmaram que nos idosos haveria elevação maior dos limiares auditivos em agudos3,8,9,18,21,41,42. Para Gates, essa variação não seria diferente segundo o gênero, mesmo embora os homens possuíssem limiares mais pobres25.
Contudo, haveria algumas diferenças na evolução da perda auditiva quando se comparam homens e mulheres. O sexo masculino geralmente apresenta queda mais pronunciada nas freqüências agudas, ao passo que nas mulheres, com a evolução do processo, ocorre aumento acentuado dos limiares nas freqüências graves, em torno de 500Hz3,25. Goetzinger et al., avaliando a audição de idosos de 60 a 98 anos, chegaram às mesmas conclusões43.
Trabalhos realizados em nosso meio também confirmam perda gradual da audição à medida que a idade avança, sendo mais acentuada nas freqüências altas que nas baixas para ambos os sexos, porém com as mulheres apresentando configurações audiométricas mais horizontalizadas que os homens41.
Em seu trabalho com 912 indivíduos dos dois sexos, com idades variando entre 18 e 65 anos, Corso concluiu que as mulheres apresentam melhores limiares tonais para as freqüências altas do que os homens, muito embora o oposto aconteça para as freqüências baixas (250 e 500Hz)8.
O autor explicou este fenômeno declarando que:
1. o início da perda auditiva em função da idade é mais gradual para as mulheres do que para homens;
2. uma vez iniciada a perda auditiva se desenvolve mais rapidamente para as mulheres, embora a perda relativa para graves nestas últimas venha a exceder a dos homens;
3. a taxa de deterioração da audição nas mulheres é mais uniforme em função da idade; para os homens esta taxa varia com a idade de modo mais descontínuo.
Moller e Kryter atribuíram o fato de as mulheres idosas apresentarem menor perda auditiva para freqüências altas, como decorrência de seu trabalho como donas-de-casa, menos expostas a ruídos nocivos do que os homens. Desta forma, seus limiares de audibilidade refletem, mais homogeneamente, a perda auditiva decorrente do processo de envelhecimento44,45.
Por último, quando buscamos correlacionar o aumento da idade com o agravamento da perda auditiva, encontramos piora dos limiares tonais somente no sexo masculino (Tabela 2). Nas mulheres, não houve relação da piora dos limiares audiométricos com as maiores faixas etárias, ao contrário do encontrado por Corso, Moller, Kryter8,44,45.
CONCLUSÕES
Os resultados obtidos neste estudo permitem concluir que, quando comparados os sexos, a perda auditiva no idoso possui - excetuando-se a tontura - sintomatologia semelhante e diferenças significativas na audiometria tonal.
REFERÊNCIAS BIBLIOGRÁFICAS
1. INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA. "Anuário Estatístico do Brasil - IBGE - Censos demográficos - Dados gerais." Rio de Janeiro, 1968, 1973, 1983, 1991, 2002.
2. Haddad EGM. A ideologia da velhice. São Paulo: Cortez Editora; 1986.
3. Russo ICP. Uso de próteses auditivas em idosos portadores de presbiacuisa: indicação, adaptação e efetividade. São Paulo, 1998. Tese (Doutorado) - Universidade Federal de São Paulo.
4. Berkowitz A. Audiological rehabilitation of the geriatric patient. Hear Aid J 1975;8:30-4.
5. Fischel-Ghodsian N, Bykhovskaya Y, Taylor K, Kahen T, Cantor R, Ehrenman K, Smith R, Keithley E. Temporal bone analysis of patients with presbycusis reveals high frequency of mitochondrial mutations. Hear Res 1997;110:147-54.
6. Zwaardemaker H. Du Verlus an Hohen Tonen mit Zunehmenden Alter: Ein Neles Gesetz. Arch Ohren Nasen Kehlkopfheilkd 1891;32-53.
7. Davis H. A functional classification of auditory defects. Ann Otol Rhinol Laryngol 1962;71:693-704.
8. Corso JF. Presbycusis, hearing aids and aging. Audiology 1977;16(2):146-63.
9. Bunch CC. Age variations in auditory acuity. Arch Otolaryngol Head 1929;9:625-36.
10. Crowe SJ, Guild SR, Polvogt LM. Observations of the pathology of high tone deafness. Bull John Hopkins Hosp 1934;54:315-80.
11. Saxén A. Pathologie und Klinik der Alferssehwerhougkeit. Acta Otolaryngol 1937;23:1-85.
12. Schuknecht H. Further observations on the pathology of presbycusis. Arch Otolaryngol Head 1964;80:369-82.
13. Johnson LG , Hawkins JE. Vascular changes in the human inner ear associated with aging. Ann Otol Rhinol Laryngol 1972;81:364-76.
14. Kirikae I, Sato T, Shitara T. A study of hearig in advanced age. Laryngoscope 1964;74:205-20.
15. Hansen CC , Reske-Nielsen E. Pathological studies in presbycusis. Arch Otolaryngol Head 1965;82:115-32.
16. Suga F , Lindsay JR. Histopathological observations of presbycusis. Ann Otol Rhinol Laryngol 1976;85:169-85.
17. Schuknecht HF. Deafness of aging 86-91. In: Maran AGD , Stell PM - Clinical Otolaryngology. Oxford, Blackwell Scientific Publications, 1979.
18. Glorig A , Nixon J. Hearing loss as a function of age. Laryngoscope 1962:72:1596-610.
19. Rosen S, Bergman M, Plester D, El-Mofty A, Satti MH. Presbycusis study of a relatively noise free population in the Sudan. Ann Otol Rhinol Laryngol 1962;71:727-43.
20. Weston TET. Presbycusis: a clinical study. J Laryngol Otol 1964;78:273-86.
21. Hinchcliffe R. Hearing levels of elderly in Jamaica. Ann Otol Rhinol Laryngol 1964;73:1012-19.
22. Gilad C, Glorig A. Presbycusis: the aging ear. Part. II. J Am Aud Soc 1979;4(6):207-17.
23. Anderson RG, Meyerhoff WL. Otologic manifestations of ageing. Otolaryngol Clin North Am 1982;15(2):353-70.
24. Mader S. Hearing impairment in elderly persons. J Am Geriatr Soc 1984;32(7):548-53.
25. Gates GA. Hearing in elderly. The Framingham cohort, 1983-1985. Hear Res 1990;11(4):247.
26. Cruickshanks KJ, Klein BE, Wiley TL, Nondahl DM. Cigarette smoking and hearing loss: the epidemiology of hearing loss study. JAMA 1998;279(21):1715-9.
27. Gates GA, Cobb JL, D'Agostino RB, Wolf PA. The relation of hearing in the elderly to the presence of cardiovascular disease and cardiovascular risk factors. Arch Otolaryngol Head Neck Surg 1993;119(2):156-61.
28. Mills JH, Dubno JR, Boettcher FA. Interaction of noise-induced hearing loss and presbyacusis. Scand Audiol Suppl 1998;48:177-22.
29. Bora H, Bandyopadhyay SN, Basu Sk, Majhi PK. Geriatric problems in otolaryngology. J Indian Med Assoc 2004;102:366-70.
30. Schneider D, Schneider L, Shulman A, Claussen CF, Just E, Koltchev C, Kersebaum M, Dehler R, Goldstein B, Claussen E. Gingko biloba (Rokan) therapy in tinnitus patients and measurable interactions between tinnitus and vestibular disturbances. Int Tinnitus J 2000;6(1):56-62.
31. Ahmad N, Seidman M. Tinnitus in the older adult: epidemiology, pathophysiology and treatment options. Drugs Aging 2004;21(5):297-305.
32. Rosenthall U, Karlsson AK. Tinnitus in old age. Scand Audiol 1991;20(3)165-71.
33. Nodahl DM, Cruickshanks KJ, Wiley Tl, Klein R, Klein BE, Tweed TS. Prevalence and 5-year incidence of tinnitus among older adults: the epidemiology of hearing loss study. J Am Acad Audiol 2002;13(6):323-31.
34. Sindhusake D, Mitchell P, Newall P, Golding M, Rochtchina E, Rubin G. Prevalence and characteristics of tinnitus in older adults: the Blue Mountains Hearing Study. Int J Audiol 2003;42(5):289-94.
35. Chobaut JC, Manière C. Presbyacousie. EMC-ORL 1995;10:1-7.
36. Katsarkas A. Dizziness in aging: a retrospective study of 1194 cases. Otolaryngol Head Neck Surg 1994;110(3):296-301.
37. Huang WN, Xu J, Gao B, Zhou JM, Liu GF. Study on the causes and risk factors on vertigo and balance disorders in 118 elderly patients. Zhonghua Liu Xing Bing Xue Za Zhi, 2005;26(9):720-2.
38. Santos TMM, Russo ICP. A Prática da Audiologia Clínica. São Paulo: Cortez Editora; 1986.
39. Kemker FJ. Symposium on sensorineural hearing loss in children: early detection and intervention. Classifications of auditory impairment. Otolaryngol Clin North Am 1975;8(1):3-17.
40. Kazmierczak H, Doroszewska G. Metabolic disorders in vertigo, tinnitus, and hearing loss. Int Tinnitus J 2001;7(1): 54-8.
41. Russo ICP. Achados audiométricos em uma população de idosos presbiacúsicos brasileiros em função do sexo e da faixa etária. Pró-Fono 1993;5(1):8-10.
42. Alberti PW. Hearing aids and aural rehabilitation in a geriatric population. J Otolaryngol 1977;6(4):1-50.
43. Goetzinger C, Proud G, Dirks D, Embrey J. A study of hearing in advanced age. Arch Otolaryngol Head 1961;73:662-74.
44. Moller MB. Hearing in 70 and 75 year old people. Results from a cross sectional and longitudinal population study. Am J Otolaryngol 1981;2(1):22-9.
45. Kryter KD. Presbycusis, sociocusis and nosocusis. J Acoust Soc Am 1983;73:1897-917.
1 Doutor em ORL pela FMUSP, Chefe da Residência em ORL do Hospital Santa Marcelina e Clínica Otorhinus.
2 Doutor em ORL pela FMUSP, Chefe da Residência em ORL do Hospital Santa Marcelina e Clínica Otorhinus.
3 Doutor em ORL pela FMUSP, Professor Titular da Disciplina de ORL da PUC-Campinas e HCFMUSP.
4 Mestranda em ORL pela FCMSCSP, Preceptora da Residência em ORL do Hospital Santa Marcelina e Clínica Otorhinus.
5 Médica, Residente em ORL do Hospital Santa Marcelina.
6 Médica, Residente em ORL do Hospital Santa Marcelina.
Centro de Referência do Idoso (SES-SP).
Endereço para correspondência: Luís Cláudio do Carmo - Rua Ivaí 318 apto. 102 A Tatuapé São Paulo SP 03080-010.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 14 de janeiro de 2007. Cod. 3601.
Artigo aceito em 28 de março de 2007.