Ano: 2008 Vol. 74 Ed. 3 - Maio - Junho - (4º)
Seção: Artigo Original
Páginas: 331 a 336
O papel da imunofluorescência direta na fisiopatologia e no diagnóstico diferencial da estomatite aftóide recorrente
The role of immunoflorescence in the physiopathology and differential diagnosis of recurrent aphthous stomatitis
Autor(es): Niels Salles Willo Wilhelmsen1, Raimar Weber2, Ivan Dieb Miziara3
Palavras-chave: aftas, dermatopatias bolhosas, microscopia de fluorescência, pênfigo vulgar
Keywords: aphthous stomatitis, vesiculobullous skin diseases, fluorescence microscopy, pemphigus vulgaris
Resumo:
A estomatite aftóide recorrente é doença caracterizada por aparecimento periódico de aftas na mucosa oral, cuja etiologia e fisiopatologia não estão bem explicadas. Estudos recentes com imunofluorescência direta mostram resultados controversos. Alguns revelam que o distúrbio básico está relacionado à imunidade humoral, enquanto outros apontam alterações da imunidade celular. Formas atípicas de estomatite aftóide podem fazer diagnóstico diferencial com doenças vésico-bolhosas como pênfigo vulgar. Objetivo: Verificar a presença de imunecomplexos na mucosa de pacientes com estomatite aftóide e utilidade do método no diagnóstico diferencial com dermatopatias bolhosas. Casuística e Método: 23 pacientes portadores de estomatite aftóide, de modo prospectivo, foram incluídos no estudo. Todos foram submetidos à biópsia de mucosa sob anestesia local para retirada de dois fragmentos. Um deles foi enviado para exame histológico e, outro, para ser realizada a imunofluorescência direta. Resultados: As 23 amostras no exame histológico revelaram processo inflamatório inespecífico ulcerado. As amostras enviadas para imunofluorescência resultaram negativas e apenas uma revelou presença de complemento em membrana basal. Conclusão: Baseado em nossos resultados, concluímos que pacientes portadores de EAR não apresentam depósitos de imunecomplexos na mucosa da cavidade bucal e a imunofluorescência é útil no diagnóstico diferencial entre a doença e dermatopatias bolhosas.
Abstract:
Recurrent aphthous stomatitis (RAS) is a disease characterized by the periodic appearance of aphthous lesions on the oral mucosa, of which etiology and physiopathology are not well explained. Recent studies with direct immunofluorescence show controversial results. Some reveal that the basic disorder is associated with humoral immunity, while others point to changes in cellular immunity. Atypical forms of aphthous stomatitis may have its differential diagnosis carried out with vesicobullous diseases, such as pemphigus vulgaris. Aim: Check the presence of immunocomplexes in the mucosa of patients with aphthous stomatitis and the usefulness of the differential diagnosis method with bullous skin diseases. Materials and methods: 23 patients with aphthous stomatitis were prospectively included in the study. There were all submitted to mucosa biopsy under local anesthesia for the removal of two fragments. One of these was sent to histology and, the other to direct immunofluorescence. Results: The 23 samples from the histology exam revealed an ulcerated inflammatory process. The samples referred to immunofluorescence resulted negative and only one showed the presence of complement in the basal membrane. Conclusion: Based on our results, we conclude that the patients with RAS do not show deposits of immunocomplexes in their oral cavity mucosa and immunofluorescence is useful in the differential diagnosis between this disease and bullous skin diseases.
![]()
INTRODUÇÃO
A Estomatite Aftóide Recorrente (EAR) é uma doença comum na cavidade bucal, atingindo cerca de 20% da população mundial1, acometendo mais o sexo feminino e surgindo na maioria dos casos já na primeira década de vida.
A doença pode se manifestar de três formas. A forma minor é caracterizada por pequena úlcera com tamanho de três a 10 milímetros de diâmetro, localizando-se em mucosa não-queratinizada, surgindo isoladamente ou até mesmo em grande quantidade na cavidade bucal2,3(Figura 1). A forma major caracteriza-se por apresentar extensa úlcera dolorida, com mais de 10 milímetros de diâmetro. Localiza-se também em mucosa queratinizada, normalmente de forma isolada, chegando a levar mais de 15 dias a um mês para completa cicatrização, podendo deixar cicatrizes na mucosa (Figura 2). A terceira forma é a herpetiforme, que apresenta como característica o surgimento de várias úlceras pequenas que se coalescem, sendo a forma mais rara da doença2,3.
Figura 1. Afta minor em borda lateral da língua
Figura 2. Afta major em lábio inferior. Repare nas lesões cicatriciais
Apesar da etiologia ser desconhecida, vários são os fatores que podem estar associados ou desencadear surtos de EAR. Dentre eles, podemos citar: desordem imunopatológica4, deficiência hemática2,3,5,6, deficiência vitamínica7, hipersensibilidade a alimentos8, deficiência a zinco9, fatores psicológicos10, fatores genéticos11, fatores infecciosos e virais12,13 e doença reumática14.
As principais hipóteses fisiopatológicas da origem das lesões da EAR são de a doença estar ligada a alterações na imunidade humoral ou celular4,15-20. A maioria dos estudos citados acima, entre outros exames, lançou mão de imunofluorescência direta (IfD) para tentar comprovar a presença ou ausência de depósitos de imunecomplexos na mucosa de pacientes portadores de EAR.
Já Lehner15 e Sistig et al.4 defendem a tese da fisiopatologia da EAR estar ligada a uma desordem na imunomodulação. Estes autores, além de não encontrarem positividade à imunofluorescência direta (IfD) em portadores de EAR, se baseiam no fato de que os linfócitos T são as células predominantemente encontradas nas lesões aftóides. Além disto, outro dado que corrobora esta hipótese é o fato de se encontrar uma variação na proporção de células linfocitárias T CD4+ / T CD8+ na mucosa oral acometida durante seus diferentes estágios evolutivos.
Em contrapartida, outros autores16-18 por terem encontrado em seus estudos a presença de IgG e C3, à IfD, defendem o fato de a resposta humoral estar presente na gênese da EAR.
Um outro aspecto importante é que, dependendo de seu estágio evolutivo, as lesões aftóides podem se assemelhar a algumas doenças bolhosas de caráter auto-imune, como o pênfigo vulgar (PV) ou o penfigóide de membranas mucosas (PMM)21. Sabe-se, no entanto, que estas doenças comprovadamente apresentam positividade à IfD - o PV com a presença de depósitos intra-epiteliais de imunoglobulinas e o PMM com depósitos semelhantes em zona de membrana basal22. Desse modo, a realização de IfD em pacientes portadores de EAR, principalmente em suas formas atípicas, e caso se revele negativa, teria importante papel no diagnóstico diferencial entre essas doenças.
OBJETIVOS
1) tentar demonstrar a presença ou ausência de imunoglobulinas na mucosa perilesional de pacientes portadores de EAR, por meio da IfD, a fim de somar dados às hipóteses de que a fisiopatologia da doença esteja ou não ligada a alterações da imunidade humoral;
2) verificar se a IfD tem relevante papel no diagnóstico diferencial entre EAR e doenças vésico-bolhosas, como o PV e o PMM.
MATERIAL E MÉTODO
Neste estudo participaram 23 pacientes consecutivos, portadores de EAR, que relataram possuir pelo menos um episódio de aftas por mês, por um período mínimo de dois anos. O estudo foi desenvolvido no período de março de 2004 a maio de 2006, com desenho de coorte histórica e corte transversal.
Os pacientes assinaram termo de consentimento esclarecido e o estudo foi aprovado pelo comitê de ética da instituição sob o número 876/04, como parte de um projeto maior para investigação de aspectos clínicos, laboratoriais e genéticos de pacientes portadores de EAR.
Todos os pacientes foram submetidos a protocolo que constou de anamnese geral e otorrinolaringológica, exame físico, especialmente da cavidade oral, hemograma completo, coagulograma completo, pesquisa de ferritina sérica, dosagem de G6PD (glicose 6-fosfato desidrogenase), fator anti-núcleo (FAN), fator reumatóide, sorologia para Lues (RSS e Fta-ABS), anti-HIV 1 e 2, dosagem sérica de Imuneglobulinas (Ig) A, G e M, proteína C reativa.
Critérios de inclusão:
- História clínica compatível com EAR, i.e, surtos de lesões aftóides em cavidade oral, com periodicidade mensal (ou menor), há pelo menos dois anos;
- Presença de lesão aftóide em mucosa oral;
- Ausência de alterações nos exames solicitados no protocolo;
- Ausência de sinais clínicos e/ou laboratoriais compatíveis com doença sistêmica que curse com lesão oral.
- Abstinência de uso de corticosteróide tópico sobre a lesão por, ao menos, duas semanas anteriores à biópsia.
Critérios de exclusão:
- História clínica não compatível com EAR;
- Presença de alterações nos exames solicitados no protocolo;
- Presença de sinais clínicos e/ou laboratoriais compatíveis com doença sistêmica que curse com lesão oral.
- Uso de corticosteróide tópico lesional por menos de duas semanas anteriores à biópsia.
Para afastar outras doenças que afetam a cavidade oral e fazem diagnóstico diferencial com EAR (Doença de Behcet, Pênfigos e Penfigóides, Eritema multiforme etc.) foi realizada biópsia da lesão, com colheita de fragmento de tecido perilesional para imunofluorescência direta (IfD).
A biopsia foi realizada sob anestesia infiltrativa com xilocaína 2% sem vasoconstritor, com a utilização de um Punch de 4mm de diâmetro, na mucosa adjacente a lesão (perilesional) para IfD e outro fragmento foi colhido na transição entre área ulcerada e área sã da mucosa para exame histológico.
O fragmento para exame histológico foi colocado em recipiente apropriado contendo formol a 10%.
A superfície externa do epitélio perilesional colhido para IfD foi corada com solução de azul de metileno, para melhor identificação. O fragmento coletado foi enviado em gaze umedecida com solução fisiológica 0,9%, ao Laboratório de Imunopatologia Cutânea do Departamento de Dermatologia HC-FMUSP.
Esses fragmentos foram congelados com meios de inclusão (Tissue Tek, Leica, Alemanha), envoltos em um envelope de papel alumínio, e levadas ao freezer -20°C até o momento do processamento.
Em seguida foram cortados em criostato, em temperatura de -20ºC (criossecção). Três cortes de cada doente, com 4 micra de espessura foram colocados sobre lâminas albuminizadas.
Para a reação imune, as lâminas foram colocadas em câmara úmida, à temperatura ambiente, e sobre os cortes foram adicionados os conjugados (anti-imunoglobulinas humanas produzidas em animais imunizados e marcadas com isotiocianato de fluoresceína). Os conjugados foram diluídos em TBS-cálcio (TBS-Ca++) ("trisma base solution", pH 7,5) contendo 3 mg% de corante Azul de Evans (marca Interlab). Foram utilizados anti- IgA humana, marca SIGMA (diluição de 1:20); anti- IgM humana, marca SIGMA (diluição 1:20); anti -IgG humana, marca SIGMA (diluição 1:130) e anti- C3c humano, marca DAKO (diluição 1:40). Após um período de 30 minutos de incubação, as lâminas foram lavadas em TBS por 2 períodos de 10 minutos cada.
Para a montagem das lâminas, utilizou- se glicerina tamponada (pH 9/ 0,5M) e lamínula de vidro. A leitura foi realizada em microscópio de epiluminescência HBO 50w (filtro CB12) marca Zeiss, com ocular de 10x e objetivas de 16x e 40x.
RESULTADOS
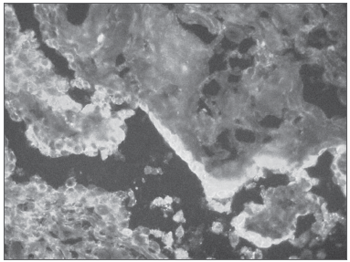
Em nossa casuística nove pacientes eram do sexo masculino e 14 do sexo feminino. A faixa etária variou entre 18 e 70 anos de idade (média = 36,14 anos; desvio padrão = 15,33 anos). Todos os exames histológicos revelaram a presença de lesão ulcerada na mucosa, acompanhada de processo inflamatório agudo e crônico inespecíficos na submucosa. As colorações de rotina e pesquisa de fungos e BAAR resultaram negativas, assim como as análises imunohistoquímicas. Das 23 amostras enviadas para IfD, apenas uma amostra apresentou discreta presença granulosa de C3 na zona de membrana basal. Com relação a IgG, IgM e IgA todas as 23 amostras apresentaram ausência de fluorescência específica tanto na zona de membrana basal quanto nas paredes dos vasos (Figura 3).
Figura 3. Imunofluorescência direta negativa em Estomatite Aftóide Recorrente
DISCUSSÃO
O papel principal da utilização da imunofluorescência direta é identificar anticorpos e outras proteínas inflamatórias na região lesada por alguma doença e assim confirmar ou excluir a suspeita clínica diagnóstica de lesão de etiologia ligada a distúrbios da imunidade humoral23.
É de se supor, portanto, que uma doença que apresente fluorescência positiva na mucosa para imunoglobulinas esteja condicionada a distúrbios na produção de anticorpos e seja de natureza auto-imune, como acontece, por exemplo, em pacientes portadores de Pênfigo Vulgar (Figura 4)23.
Figura 4. Imunofluorescência direta positiva em Pênfigo Vulgar
Por conseguinte, a IfD é um ótimo exame para fazer diagnóstico diferencial entre doenças auto-imunes e entre aquelas que não têm relação com alterações da imunidade humoral23. Em contrapartida, é bom lembrar que fluorescência negativa não é um dado patognomônico de doença ligada a distúrbios da imunidade celular23.
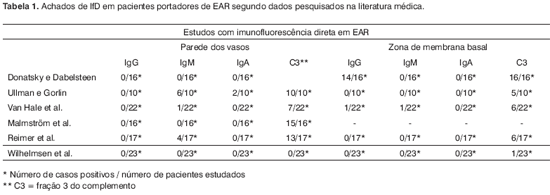
No presente estudo, realizamos exames histológicos e de IfD em 23 pacientes portadores de EAR. Nossos resultados, podem ser comparados, diretamente, com os achados de outros autores que utilizaram a IfD em portadores de EAR na Tabela 1. É importante notar que dentre todos os trabalhos citados, o nosso é que apresenta a maior casuística de estudos com IfD.
Donatsky e Dabelsteen16 ao analisar com imunofluorescência direta biopsia de 16 pacientes portadores de EAR, encontraram na zona de membrana basal a presença de IgG em 14 pacientes sendo que, todos apresentaram depósitos de C3, havendo ausência de fluorescência específica de IgM e IgA. Nas paredes dos vasos não houve presença de marcadores para IgG, IgM e IgA.
Presença significativa de C3 na zona de membrana basal também foi achado por Ullman e Gorlin17. Em seu estudo, cinco de 10 pacientes apresentaram este resultado, porém não foi encontrado fluorescência nesta região para IgG, IgM e IgA. Já nas paredes dos vasos eles obtiveram resultado negativo para IgG, positivo em 6 pacientes para IgM, 2 pacientes para IgA e todos os 10 pacientes foram positivos para C3.
Estudando uma população semelhante à nossa, de 22 pacientes, VanHale et al.18 encontraram ausência de IgA tanto nas paredes dos vasos quanto na zona de membrana basal. A presença de IgG nas paredes dos vasos também foi negativa. Houve a ocorrência positiva para IgM em apenas um caso tanto na zona de membrana basal quanto nas paredes dos vasos. Com relação à presença de C3, ela foi positiva em seis casos nas paredes dos vasos e sete na zona de membrana basal.
Malmström et al.19 encontraram ausência de fluorescência para IgM, IgG e IgA em todos os 16 casos avaliados, entretanto em 15 deles houve presença de fluorescência para C3 ao longo das paredes dos vasos
Reimer et al.20 em 17 casos obtiveram ausência de fluorescência na zona de membrana basal para IgG, IgA e IgM, porém em seis casos obteveram fluorescência para C3. Nas paredes dos vasos não apresentaram fluorescência IgG e IgA. A fluorescência esteve presente em 4 casos para IgM e em 13 casos para C3.
Nosso estudo com imunofluorescência direta em 23 pacientes entra em conflito com os achados por dois desses autores16,17 e concorda parcialmente com os de VanHale 18 et al., Malmström 19 et al. e Reimer 20 et al. Em nossa casuística, não conseguimos encontrar fluorescência específica para IgG, IgA, IgM nas paredes dos vasos e também na zona de membrana basal. Em apenas um caso observamos fluorescência para C3, mesmo assim discreta, na zona de membrana basal.
É importante salientar que os pacientes que participaram deste estudo não fizeram uso de nenhum medicamento antes da realização da biópsia, já que resultados falso-negativos podem ser causados se a região for tratada com esteróide tópico previamente à biópsia23.
Por outro lado, nossos resultados estão de acordo com os achados de Lehner15 e Sistig el al.4, os quais também não puderam comprovar a positividade da IfD em portadores de EAR. Estes autores não concordam com a afirmação da EAR ser uma resposta humoral, acreditando ser o processo ulcerativo desencadeado por alterações da imunidade celular.
Conforme recentemente descrito por Natah et al.24 Scully et al.25, a imunopatogênese da EAR envolve um mecanismo de resposta imune mediada por células, com a geração de linfócitos T e fator de necrose tumoral alfa (TNF-a) por outros leucócitos (macrófagos e mastócitos). Sabe-se ainda que na fase ulcerativa da doença há um predomínio de linfócitos T CD8+ e diminuição de linfócitos T CD4+ na mucosa afetada.
Nossos achados mostram que a realização da IfD é imprescindível no diagnóstico diferencial entre a EAR de forma atípica e as doenças vesico-bolhosas, que, comprovadamente, apresentam depósitos de imunocomplexos no epitélio. Como bem demonstrou Femiano et al.21, existem formas de EAR, notadamente as de tipo major, que acarretam grandes áreas de ulceração mucosa e podem se confundidas facilmente com o PV e o PMM, causando grandes transtornos diagnósticos, impedindo a instituição da terapêutica correta em prazo adequado.
CONCLUSÃO
Baseado em nossos achados, concluímos que:
1) A IfD é negativa em mucosa perilesional de pacientes portadores de EAR. Este dado acaba por fortalecer a hipótese de que a doença esteja ligada, principalmente, a distúrbios da imunidade celular;
2) O uso da IfD é importantíssimo no diagnóstico diferencial entre formas atípicas de EAR (onde o exame é negativo) e doenças vésico-bolhosas (onde o exame apresenta fluorescência positiva no epitélio oral).
REFERÊNCIAS BIBLIOGRÁFICAS
1. Casiglia JM. Recurrent aphthous stomatitis: Etiology, diagnosis, and treatment. General Dentistry 2002;50(2):157-66.
2. Porter SR, Scully C, Pedersen A. Recurrent aphthous stomatitis. Crit Rev Oral Biol Med 1998;9(3):306-21.
3. Porter SR, Hegarty A, Kaliakatsou F, Hodgson T, Scully C. Recurrent aphthous stomatitis. Clin Dermatol 2000;18:569-78.
4. Sistig S, Cekic-Arambasin A, Rabatic S, Vucicevic-Boras V, Kleinheinz J, Piffko J. Natural immunity in recurrent aphthous ulceration. J Oral Pathol Med 2001;30:275-80.
5. Challacombe SJ, Scully C, Keevil B, Lehner T. Serum ferritin in recurrent oral ulceration. J Oral Pathol 1983;12:290-9.
6. Field EA, Rotter E, Speechley JA, Tyldesley WR. Clinical and haematological assessment of children with recurrent aphthous stomatitis. Br Dent J 1987;163:19-22.
7. Nolan A, McIntosh WB, Allam BF, Lamey PJ. Recurrent aphthous ulceration: Vitamin B1, B2 and B6 status and response to replacement therapy. J Oral Path Med 1991;20:389-91.
8. Hay D, Reade PC. The use of an elimination diet in the treatment of recurrent aphthous ulceration of the oral cavity. Oral Surg Oral Med Oral Pathol 1984;57:504-7.
9. Endre L. Recurrent aphthous ulceration with zinc deficiency and cellular immune deficiency. Oral Surg Oral Med Oral Pathol 1991;72:559-61.
10. Pedersen A. Psychologic stress and recurrent aphthous ulceration J Oral Pathol Med 1989;18:119-22.
11. Jaber L, Weinberger A, Klein T, Yaniv I, Mukamel M. Close association of HLA-B52 and HLA-B44 antigens in Israeli arab adolescents with recurrent aphthous stomatitis. Arch Otolaryngol Head Neck Surg 2001;127:184-7.
12. Birek C, Grandhi R, McNeill K, Singer D, Ficarra G, Bowden G. Detection of Helicobacter pylori in oral aphthous ulcers. J Oral Pathol Med 1999;28:197-203.
13. Leimola-Virtanen R, Happonen RP, Syrjanen S. Cytomegalovirus (CMV) and Helicobacter pylori (HP) found in oral mucosal ulcers. J Oral Pathol Med 1995;24:14-7.
14. Livneh A, Zaks N, Katz J, Langevitz P, Shemer J, Pras M. Increased prevalence of joint manifestations in patients with recurrent aphthous stomatitis (RAS). Clin Exp Rheumatol 1996;14:407-412.
15. Lehner T. Stimulation of lymphocyte transformation by tissue homogenates in recurrent oral ulceration. Immunology 1967;13:159-166.
16. Donatsky O, Dabelsteen E. Deposits of immunoglobulin C and complement C3 in recurrent aphthous ulceration. Scand J Dent Res 1977;85:419-25.
17. Ullman S, Gorlin RJ. Recurrent aphthous stomatitis: An immunofluorescence study. Arch Dermatol 1978;114:955-56.
18. Van Hale HM, Rogers III RS, Doyle JA, Schroeter AL. Immunofluorescence Microscopic Studies of recurrent aphthous stomatitis. Arch Dermatol 1981;117:779-81.
19. Malmström M, Salo OP, Fyhrquist F. Immunogenetic markers and immune response in patients with recurrent oral ulceration. Int J Oral Surg 1983;12:23-30.
20. Reimer R, Luckner L, Hornstein OP. Direct immunofluorescence in Recurrent Aphthous Ulcers and Behçet's Disease. Dermatologica 1983;167:293-8.
21. Femiano F, Gombos F, Nunziata M, Espósito V, Scully C. Pemphigus mimicking aphthous stomatitis. J Oral Pathol Med 2005;34:508-10.
22. Weinberg MA, Insler MS, Campen RB. Mucocutaneous features of autoimmune blistering diseases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997;84:517-34.
23. Jordan RCK, Daniels TE, Greenspan JS, Regezi JA. Advanced diagnostic methods in oral and maxillofacial pathology. Part II: Immunohistochemical and immunoflorescent methods. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002;93:53-74.
24. Natah SS, Hayrinen-Immonen R, Hietanen J. Increased density of lymphocytes bearing gamma/delta T-cell receptors in recurrent aphtous ulceration (RAU). Int J Oral Maxillofac Surg 2000;29:375-80.
25. Scully C, Gorsky M, Lozada-Nur F. The diagnosis and management of recurrent aphtous stomatitis. JADA 2003;134:200-7.
1 Doutorando em ciências da Disciplina de ORL da Faculdade de Medicina da USP, Odontólogo-colaborador do grupo de Estomatologia do Ambulatório ORL do HC-FMUSP.
2 Doutorando em ciências da Disciplina de ORL da Faculdade de Medicina da USP, Médico Preceptor da Clínica ORL do HC-FMUSP.
3 Professor Livre-Docente pela Faculdade de Medicina da USP, Professor colaborador da Disciplina de ORL da Faculdade de Medicina da USP Médico responsável pelo grupo de Estomatologia do Ambulatório de ORL do Hospital das Clínicas - FMUSP.
Grupo de Estomatologia - Ambulatório da Divisão de Clínica ORL - Hospital das Clínicas - Faculdade de Medicina da USP.
Endereço para correspondência: Ivan Dieb Miziara - Av. Enéas de Carvalho Aguiar, 155 6º andar São Paulo SP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 31 de dezembro de 2006. Cod. 3574.
Artigo aceito em 12 de fevereiro de 2007.