Ano: 2008 Vol. 74 Ed. 3 - Maio - Junho - (3º)
Seção: Artigo Original
Páginas: 328 a 330
Avaliação da cicatrização de feridas em dorso de ratos tratados com mitomicina C tópica e posterior reforço com injetável
Study of wound healing in rats treated with topical and injected mitomycin-C
Autor(es): Fernando de Andrade Quintanilha Ribeiro1, Janaína de Pádua Borges2, Lusiele Guaraldo3, Maria Regina Vianna4
Palavras-chave: cicatrização de feridas, injetável, mitomicina C, ratos
Keywords: wound healing, topical, mitomycin-C, rats
Resumo:
Estudo experimental em animais. A mitomicina C vem sendo usada como inibidor de fibroblastos, acarretando, com isso, diminuição do processo cicatricial em feridas cirúrgicas. Objetivo: Este trabalho visa avaliar o uso de Mitomicina C para diminuir o processo cicatricial, através de seu uso tópico com reforços posteriores injetáveis. Material e Métodos: Foi usado um modelo de feridas em dorso de ratos, com retirada circular da pele e cicatrização por segunda intenção. Foram usados 18 ratos, divididos em três grupos: controle; com uso tópico; e com reforço de mitomicina C injetável, mensalmente e por 2 meses. Após 3 meses os animais foram sacrificados e as cicatrizes retiradas cirurgicamente e submetidas a estudo histológico. Resultados: Notou-se sob vários critérios que a cicatrização com o uso tópico é menos intensa, mas ao se usar o reforço injetável os parâmetros voltam a ser comparados ao do grupo controle. Discussão: Acreditamos que a administração injetável de mitomicina C nas cicatrizes, pela sua elevada característica tóxica, acarreta destruição tecidual e neoformação cicatricial. Conclusões: A mitomicina C diminui o processo cicatricial quando usada topicamente, mas acarreta aumento da cicatrização quando nestas feridas são feitos reforços injetáveis.
Abstract:
Experimental study in animals. Introduction: Mitomycin C has been used as a fibroblasts inhibitor, thus reducing the scaring process in surgical wounds. Aim: This paper aims at assessing the use of Mitomycin C to reduce the scaring process through its topical use and later injected reinforcements. Materials and Methods: We used a model of a creating a wound in the dorsum of rats, removing a circular piece of skin and letting it heal by itself. We used 18 rats, divided in three groups. The first group - Control, the second with topical use, and a third group with injected mitomycin C reinforcement, monthly for 2 months. After 3 months the animals were slaughtered and the scars were surgically removed and sent for histology study. Results: We noticed, under different criteria, that healing with topical mitomycin is less intense; however, when it was injected, the parameters were again comparable to those from the control group. Discussion: We believe that injected mitomycin C in the scar, since it is highly toxic, it destroys tissue and brings about scar neoformation. Conclusions: Mitomycin C reduces the scaring process when used topically; however, it increases scar tissue formation when injected in these wounds.
![]()
INTRODUÇÃO
A Mitomicina C é amplamente usada como quimioterápico1, mas ultimamente, e cada vez mais, sua característica como inibidora de fibroblastos2 a faz ser usada para conter o processo cicatricial, principalmente em cirurgias onde seqüelas como estenoses ou aderências podem ocorrer. Muitos trabalhos na literatura mostram este efeito em cirurgias, vários deles dentro da área da otorrinolaringologia3-7. Trabalhos em modelos animais também têm sido feitos8,9, mas um consenso a este respeito ainda não foi proposta e há evidências contraditórias quanto a sua real eficácia. Como há trabalhos demonstrando que o uso apenas tópico da mitomicina C pode não surtir os efeitos esperados10, foi proposto o uso injetável desta droga para fazer um reforço seqüencial nas cicatrizes e com isso diminuir ainda mais a fibrose cirúrgica11-13.
OBJETIVO
Este trabalho visa avaliar, em modelo de feridas em dorso de ratos, o efeito comparativo entre o uso apenas tópico e o com reforço mensal injetável.
MATERIAL E MÉTODOS
Este trabalho foi aprovado pela comissão de ética em pesquisa animal da instituição, protocolo no 10 de 14/05/2002. Foram utilizados 18 ratos adultos machos jovens, todos da linhagem Wistar, com pesos entre 355 e 400g, que foram acomodados em gaiolas individuais no biotério da Unidade de Técnica Cirúrgica da Instituição. Estes ratos foram anestesiados com Quetamina (Francotar®) 10ml na concentração de 100mg/ml na dose de 0,5 ml/rato e Xilasina (Rompun®) 10ml na concentração de 20mg/ml na dose de 0,1ml/rato. Sob anestesia geral foram feitas, em seus dorsos, feridas circulares idênticas de 2cm de diâmetro. Os 18 ratos foram numerados de 1 a 18 e divididos em três grupos de 6. No grupo controle as feridas foram tratadas topicamente com gaze embebida em soro fisiológico por 5 minutos. Nos dois outros grupos foram colocadas em suas feridas gazes embebidas em 1ml de mitomicina C na concentração de 0,5ml/mg por 5 minutos e depois lavadas com 10ml de soro fisiológico. No grupo de número 3, a cada 30 dias, e por duas vezes, foi injetada na cicatriz uma solução de mitomicina C na concentração de 0,01mg/ml. O mesmo volume de soro fisiológico foi injetado como controle nos outros dois grupos. A concentração tópica foi usada baseando-se no que usualmente é relatado na literatura10,13. A escolha da concentração injetada foi baseada em trabalho anterior onde a mesma foi a única que não apresentou necrose tecidual no dorso dos ratos11. Houve perda de dois ratos do grupo controle no ato anestésico. Os ratos foram sacrificados após 90 dias (KCl 19,1% intracardíaco, após anestesia geral), suas cicatrizes retiradas cirurgicamente e encaminhadas para exame histológico. As peças foram renumeradas aleatoriamente, sem o conhecimento do anatomopatologista que as examinou, emblocadas, cortadas e coradas com hematoxilina-eosina. As lâminas foram avaliadas sobre o grau de fibrose, proliferação vascular, número de fibroblastos e de fibrócitos.
RESULTADOS
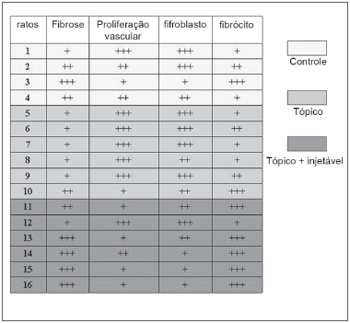
O material foi observado e cada parâmetro recebeu o grau de +, ++ ou +++, de acordo com a intensidade avaliada. Estes resultados são observados no Quadro 1.
Quadro 1. Avaliação nos ratos, em +, quanto aos parâmetros de fibrose, proliferação vascular, número de fibroblastos e número de fibrócitos.
DISCUSSÃO
Quanto ao grau de fibrose
Podemos caracterizar a intensidade de um tecido cicatricial pelo seu grau de fibrose constituída.
Quanto à proliferação vascular
Esta se faz mais presente em tecidos cicatriciais menos definidos ou evoluídos.
Quanto ao número de fibroblastos
O maior número de fibroblastos caracteriza um processo cicatricial menos maduro e menos constituído.
Quanto ao número de fibrócitos
Seu maior número caracteriza uma cicatriz mais antiga e intensa.
Como podemos notar, o grupo 2, referente ao uso apenas tópico da mitomicina C é o que tem um quadro cicatricial menos intenso e mais jovem. O grupo 3, tópico mais injetável, que deveria ser ainda menos intenso, pois houve o reforço a cada 30 dias de mitomicina C injetável, se mostra com grau de cicatrização mais intensa. Isto talvez se deva às características altamente tóxicas e necrosantes da mitomicina C. Assim, a cada 30 dias uma nova agressão se fazia no tecido em cicatrização, o que retomava o processo. Talvez a concentração de 0,01ml/mg, mesmo muito baixa, possa ser diminuída, com resultados melhores. O fator mecânico da injeção foi descartado, pois os outros grupos também foram injetados na mesma quantidade e pelas mesmas vezes, com soro fisiológico.
Além da constatação visual tentamos uma avaliação estatística, mas o n se mostrou pequeno para tanto. Assim consideramos, também, uma avaliação por escores de +. Para cada rato avaliado somamos ou diminuímos as cruzes dependendo do parâmetro avaliado quanto ao grau de cicatrização. Demos sinais (+) para fibrose e fibrócito e (-) para proliferação vascular e fibroblasto. Assim, os ratos tiveram os seguintes dados:
1:+1-3-3+1= - 4.
2:+2-2-3+2=-1
3:+3-1-1+3= + 4
4: +2-2-2+1= - 1
5:+1-3-3+1= - 4
6:+1-3-3+2= - 3
7: +1-3-3+1= - 4
8: +1-3-2+1= - 3
9: +1-3-3+2= - 3
10: +2-1-1+3= + 3
11: +2-1-2+3= + 2
12: +1-3-3+1= - 4
13: +3-1-2+3= + 3
14: +3-2-1+3= + 3
15: +3-1-1+3=+ 4
16: +3-1-1+3= + 4
Somando os escores dos ratos do número 1 ao 4 (controle) obtivemos-2
Somando os escores dos ratos do número 5 ao 10 (Tópico) obtivemos-14
Somando os escores dos ratos do numero 11 ao 16 (Tópico+injetável)+12
Mesmo retirando o resultado mais discrepante de cada grupo (número 3 no controle, 10 no tópico e 12 no tópico +injetável), obtivemos os resultados:
Controle - 6
Tópico- 17
Tópico+injetável+ 16
Assim, considerando que a cicatrização possa ser avaliada como mais intensa quanto ao grau de fibrose e número de fibrócitos (+) e menos intensa quanto ao grau vascularização e número dede fibroblastos (-), notamos que após 90 dias, e comparativamente, o grupo de uso apenas tópico da Mitomicina C tem um grau de cicatrização menor que o controle, mas o grupo de uso tópico mais injetável tem um grau de cicatrização muito maior.
Devemos observar que o grande número de fibroblastos e de proliferação vascular no grupo de uso tópico lhe confere a característica de cicatrização mais frouxa ou delicada neste momento (90 dias), mas se faz necessário estudo a prazo ainda maior para averiguar se estas características perduram.
CONCLUSÕES
A mitomicina C se mostrou, após um prazo de 90 dias, um fator de controle do processo cicatricial mais eficiente se usada apenas topicamente. Quando usados 2 reforços injetáveis, 1 a cada 30 dias a cicatrização se tornou mais intensa que no grupo controle.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Bradner WT. Mitomycin C: a clinical update. Cancer Treat Rev 2001; 27(1):35-50.
2. Hu D, Sires BS, Tong DC, Royack GA, Oda D. Effect of brief exposure to mitomycin C on cultured human nasal mucosa fibroblasts: Ophthal Plast Reconstr Surg 2000; 16(2):119-25.
3. Ingrams DR, Volk MS, Biesman BS, Pankratov MM, Shapshay SM. Sinus surgery: does mitomicyn-C reduce stenosis? Laryngoscope 1998; 108:883-6.
4. Spector J E, Werkhaven J A, Spector N C, Huang S, Page RN, Baranowski B, Luther M, McGehee B, Reinisch L. Preservation of function and histologic appearance in the injured glottis with topical mitomycin C. Laryngoscope 1999; 109:1125-9.
5. Jassir D, Buchman CA, Gomez-Marin O. Safety and efficacy of topical mitomycin C in myringotomy patency. Otolaryngol Head Neck Surg 2001; 124(4):368-73.
6. Estrem SA, Batra PS. Preventing myringotomy closure with topical Mitomicin C in rats. Otolaryngol Head Neck Surg 1999; 120(6):794-8.
7. Yazawa Y, Suzuki M, Kitano H, Kitajima K. Intraoperative mitomicyn-C in endolynphatic sac surgery for Ménière's disease: a pilot study: ORL J Otorhinolaryngol Relat Spec 1999; 61:188-94.
8. Sampaio MW, José NK, Alves MR. Efeitos do uso tópico da Mitomicina C em olhos de ratas. Arq Bras Oftalmol 1995; 58:56-9.
9. Mattar DB, Alves MR, Silva MHT, José NK. Estudo da influência da aplicação subconjuntival da Mitomicina C na reparação de defeito epitelial corneano, em coelhas. Arq Bras Oftalmol 1995; 58:65-7.
10. Ribeiro FAQ, Guaraldo L, Borges JP, Zacchi FFS, Eckley CA. Clinical and Histological Healing of Surgical Wounds Treated with Mitomicyn C. Laryngoscope 2004; 114:148-52.
11. Ribeiro FAQ, Borges JP, Zacchi FFS, Guaraldo L. O Comportamento clínico e histológico da pele do rato submetida ao uso tópico e injetável de Mitomicina C. Rev Bras Otorrinolaringol 2003; 69(2):151-8.
12. Ferguson B, Gray SD, Thibeault S. Time and dose effects of mitomycin C on extracellular matrix fibroblasts and proteins. Laryngoscope 2005; 115(1):110-5.
13. Gray SD, Tritle N, Li W. The effect of mitomycin on extracellular matrix proteins in a rat wound model. Laryngoscope 2003; 113(2):237-42.
1 Prof. Adjunto do Departamento de Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
2 Mestrado pelo Dep. de Farmacologia da USP, Farmacêutica da técnica cirúrgica da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
3 Prof. Adjunto do Departamento de Ciências Fisiológicas da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
4 Prof. Dra. pela USP. Anatomopatologista do Hospital Alemão Oswaldo Cruz.
Departamento de ORL da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
Endereço para correspondência: Rua Itapeva 500 10B Bela Vista São Paulo SP 01332-000.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 13 de janeiro de 2007. Cod. 3597.
Artigo aceito em 4 de agosto de 2007.