Ano: 2008 Vol. 74 Ed. 2 - Março - Abril - (21º)
Seção: Artigo de Revisão
Páginas: 284 a 292
Líquen plano bucal: considerações clínicas e histopatológicas
Oral lichen planus: clinical and histopathological considerations
Autor(es): Fernando Augusto Cervantes Garcia de Sousa1, Luiz Eduardo Blumer Rosa2
Palavras-chave: diagnóstico, literatura de revisão, líquen plano, mucosa bucal
Keywords: diagnosis, literature review, lichen planus, mouth mucosa
Resumo:
O líquen plano é uma das doenças dermatológicas mais comuns que acometem a cavidade bucal, com prevalência de 1% a 2% na população geral. Contudo, apesar de relativamente freqüente, o líquen plano bucal é alvo de muita controvérsia, especialmente em relação ao seu potencial de malignização. Objetivo: O presente trabalho tem como objetivo tecer considerações clínicas e histopatológicas a respeito do líquen plano bucal, favorecendo seu entendimento por parte dos profissionais da saúde e, conseqüentemente, reforçando a importância do acompanhamento a longo prazo dos pacientes acometidos pela doença. Conclusão: A possibilidade da lesão sofrer transformação maligna justifica a importância do acompanhamento a longo prazo dos pacientes com a doença.
Abstract:
Oral lichen planus is one of the most common dermatological diseases presenting in the oral cavity; the prevalence in the general population is 1% to 2%. Although relatively frequent, oral lichen planus is the target of much controversy, especially in relation to its potential for malignancy. Aim: This study aimed to make clinical and histopathological considerations regarding oral lichen planus to increase the level of knowledge about this condition among health professionals, underlining the importance of long-term follow-up of these patients. Conclusion: The possibility of this lesion to turn malignant justifies the importance of long term follow up for patients with such disease.
![]()
INTRODUÇÃO
O líquen plano, doença inflamatória crônica que envolve pele e mucosa, é uma das doenças dermatológicas mais comuns que acometem a cavidade bucal, com prevalência de 1% a 2% na população geral. Todavia, nota-se uma forte predileção pelo sexo feminino1.
Sousa & Rosa2, após levantamento de 79 casos de líquen plano bucal diagnosticados no período de 1974 a 2003, observaram que as mulheres são quase quatro vezes mais acometidas do que os homens e que indivíduos da raça branca possuem um risco cinco vezes e meia maior de desenvolver a doença, comparado com as demais raças.
Contudo, tais características são um dos poucos pontos de concordância, uma vez que quase todos os aspectos relacionados a esta doença são alvos de muita controvérsia, especialmente em relação ao seu potencial de transformação maligna. Assim, o objetivo deste trabalho é tecer considerações clínicas e histopatológicas a respeito do líquen plano bucal, favorecendo seu entendimento por parte dos profissionais da saúde e, consequentemente, reforçando a importância do acompanhamento a longo prazo dos pacientes acometidos pela doença.
ETIOPATOGENIA
Embora o líquen plano bucal tenha sido descrito inicialmente em 1869, pouco se sabe a respeito dos mecanismos pelos quais se desenvolve a doença.
Sugerman et al.3, no entanto, acreditam que mecanismos específicos e não-específicos podem estar envolvidos na sua etiopatogenia, sendo que os primeiros incluem apresentação de antígenos por queratinócitos da camada basal e morte de queratinócitos antígeno-específicos por linfócitos T citotóxicos, enquanto que os últimos incluem degranulação dos mastócitos e ativação de metaloproteinases da matriz. Estes mecanismos combinados levariam então ao acúmulo de linfócitos T na lâmina própria subjacente ao epitélio, rompimento da membrana basal, migração de linfócitos T intra-epitelial e apoptose dos queratinócitos, achados característicos do líquen plano bucal. Além disso, para estes autores a cronicidade da doença pode ser explicada em parte por uma deficiência nos mecanismos de imunossupressão mediada pelo fator transformador de crescimento beta 1.
Todavia, as causas que levam ao inicio deste processo ainda não foram totalmente esclarecidas. Ainda assim, estresse; alimentos como tomate, frutas cítricas e pratos condimentados; procedimentos odontológicos; doenças sistêmicas; consumo exagerado de álcool e uso do tabaco em todas as suas formas têm sido associados a períodos de exacerbação da doença4. Entre eles, as doenças sistêmicas, em especial, as decorrentes da infecção pelo vírus da hepatite C vêm ganhando grande destaque nos últimos anos.
Lodi et al.5 avaliaram através do teste ELISA (do inglês, Enzyme-Linked Immunosorbent Assay) a presença de anticorpos contra o vírus da hepatite C em 581 pacientes, sendo 303 com diagnóstico clínico e histopatológico de líquen plano bucal, e 278 sem qualquer evidência da doença (grupo controle). Dos 303 pacientes com o diagnóstico de líquen plano bucal, 58 (19,1%) mostraram positividade para o vírus da hepatite C, comparado a apenas nove (3,2%) do grupo controle. Além disso, os autores, após reverem os resultados de outros 24 estudos semelhantes realizados no período de 1994 a 2003, constaram haver diferença significativa estatisticamente na proporção de indivíduos soropositivos para o vírus da hepatite C entre os pacientes com líquen plano bucal, comparados com o grupo controle.
No entanto, a relação entre o líquen plano e o vírus da hepatite C não é consistente, uma vez que a prevalência deste vírus em pacientes com a doença varia imensamente, oscilando de 0% a mais de 60%, de acordo com o país em que tais estudos foram realizados. Acredita-se que tais diferenças se devam principalmente a discrepâncias geográficas na prevalência deste vírus na população geral6.
Henderson et al.7 questionam esta hipótese. Estes autores, após avaliarem a saúde bucal e o acesso a atendimento odontológico de pacientes infectados pelo vírus da hepatite C no Reino Unido, observaram evidências clínicas do líquen plano em 20% dos pacientes avaliados, valor muito superior ao encontrado na população geral, na qual a prevalência da doença não ultrapassava 1%. Fato que chamou a atenção dos autores, uma vez que a prevalência do vírus da hepatite C é baixa, contrariando a literatura, que afirma haver uma relação diretamente proporcional entre a prevalência do vírus da hepatite C e a do líquen plano bucal.
Cunha et al.8 verificaram algo semelhante ao estudarem 134 pacientes soropositivos para o vírus da hepatite C no Brasil. Embora o país possua uma elevada prevalência deste vírus, a porcentagem de paciente com líquen plano foi de 1,5%, não havendo, portanto, diferença significativa estatisticamente em relação ao grupo controle, no qual 1,1% dos pacientes apresentaram sinais da doença.
De fato, nem sempre se pode observar uma associação direta entre o líquen plano e o vírus da hepatite C. Micó-Llorens et al.9, por exemplo, não encontraram alterações na mucosa bucal dos cem pacientes infectados pelo vírus da hepatite B, C ou ambos, que participaram de estudo realizado pelo Serviço de Patologia do Aparelho Digestivo do Hospital "Príncipes de España de Bellvitge", entre setembro e outubro de 2000.
Romero et al.10, no entanto, reforçam a necessidade de se pesquisar a presença de anticorpos contra o vírus da hepatite C em todos os pacientes com líquen plano bucal. Para estes autores, a existência de variações clínicas da doença, no que se refere à sua localização e ao número de lesões intra-orais entre pacientes infectados e não infectados pelo vírus da hepatite C, sugerem o importante papel deste vírus na sua evolução.
Outro fator que vem sendo fortemente associado ao líquen plano nos últimos anos são os distúrbios psicológicos, em particular níveis exacerbados de estresse e ansiedade. Todavia, embora tal associação seja conhecida há décadas, a dificuldade em se mensurar de modo objetivo tais variáveis fez com que só recentemente a importância da ansiedade e do estresse na etiopatogenia do líquen plano passasse a ser amplamente reconhecida, tornando-se alvo de inúmeras pesquisas.
Soto-Araya et al.11 investigaram a relação entre alterações psicológicas, tais como estresse, ansiedade e depressão, e algumas patologias da mucosa bucal. Para tanto, foram estudados 18 pacientes com estomatite aftosa recorrente, nove com líquen plano bucal, sete com síndrome da ardência bucal e vinte sem qualquer lesão aparente, através de testes que avaliavam seu perfil psicológico. Os resultados indicaram haver uma relação significativa estatisticamente entre a presença de alterações psicológicas e as patologias estudadas. Os autores observaram que o nível de estresse era maior nos pacientes com estomatite aftosa recorrente e líquen plano bucal. Por outro lado, os níveis de ansiedade foram maiores nos três grupos de pacientes com alterações na mucosa bucal, comparados com o grupo controle. Evidências de depressão foram particularmente observadas nos pacientes com síndrome da ardência bucal. Frente a estes resultados, os autores concluíram haver íntima relação entre alterações psicológicas e determinadas patologias que acometem a mucosa bucal, destacando a influência de fatores psíquicos na manutenção da saúde bucal.
Koray et al.12 estudaram a relação entre ansiedade e os níveis de cortisol, hormônio associado ao estresse, na saliva de 40 pacientes com líquen plano bucal. Depois da avaliação e comparação dos níveis de ansiedade, e de cortisol na saliva destes pacientes com os do grupo controle, os autores concluíram que estes níveis eram consideravelmente maior nos pacientes com líquen plano bucal do que naqueles não tinham a doença, reforçando ainda mais a ligação entre níveis alterados de estresse e ansiedade e sua evolução. Tal conclusão é confirmada por Ivanovski et al.13 após observarem resultados semelhantes num estudo realizado basicamente nos mesmos moldes.
Nota-se, portanto, a grande discussão existente de torno dos mecanismos pelos quais o líquen plano se desenvolve e do porquê deles ocorrerem. Contudo, apesar de haver evidências indicando que fatores como infecções virais, especialmente as causadas pelo vírus da hepatite C, e a somatização de desordem psicológicas, como estresse e ansiedade, possam ser apontados como possíveis causas da doença, faltam informações que comprovem de modo definitivo tal ligação, levando ao surgimento de uma discussão ainda maior a respeito da natureza maligna ou não do líquen plano bucal.
CARACTERÍSTICAS CLÍNICAS
O líquen plano é uma doença mucocutânea bastante comum, que afeta principalmente mulheres entre a quinta e sexta décadas de vida2,4,14-16. Contudo, de acordo com Laeijendecker et al.17, a doença também pode acometer indivíduos com menos de 18 anos, preservando as mesmas características clínicas com as quais se manifesta nos adultos, porém com prognóstico mais favorável.
Clinicamente o líquen plano bucal possui características distintas e fáceis de serem identificadas18, podendo apresentar-se sob duas formas principais: reticular e erosiva, embora outras formas de apresentação da doença não sejam raras14. De fato, segundo Mollaoglu19 (2000), originalmente outras quatro formas foram descritas: papular, "em placa", bolhosa e atrófica.
A forma reticular ocorre com maior freqüência e se caracteriza por linhas brancas entrelaçadas, conhecidas como estrias de Wickham, em geral, cercadas por uma discreta borda eritematosa. Tais características, no entanto, podem não ser evidentes em alguns locais, como o dorso da língua, onde as lesões se apresentam como placas queratóticas. A forma reticular normalmente não causa sintomas e envolve a mucosa jugal posterior bilateralmente. Outras localizações, porém, podem estar envolvidas ao mesmo tempo, como o dorso e a parte lateral da língua, as gengivas e o palato14-15,19.
A forma erosiva, embora não seja tão comum quanto a reticular, é mais significativa para o paciente, pois as lesões comumente são sintomáticas, variando desde simples desconforto até episódios de dor intensa capaz de interferir com a função mastigatória. Clinicamente o líquen plano erosivo se manifesta por áreas atróficas e eritematosas frequentemente cercadas por finas estrias radiantes. Todavia, em alguns casos, se o componente erosivo for muito grave, poderá ocorrer separação do epitélio, resultando numa forma relativamente rara da doença, conhecida como líquen plano bolhoso14-15.
Algumas vezes, a atrofia e ulceração estão confinadas à mucosa gengival, produzindo um padrão de reação chamado gengivite descamativa. Em tais casos, amostras de biópsia devem ser obtidas para os exames de imunofluorescência e microscopia ótica do tecido perilesional, já que o penfigóide benigno de mucosa e o pênfigo vulgar podem se apresentar de forma semelhante15.
Mignogna et al.20, após avaliarem 700 pacientes com líquen plano bucal, relataram que 48% tinham comprometimento gengival e que em 7,4% dos pacientes pesquisados, as lesões limitavam-se somente à mucosa gengival. Além disso, os autores também observaram que 20% dos casos de transformação maligna envolviam a mucosa gengival, reforçando ainda mais a importância do exame histopatológico no diagnóstico final da doença.
Pacientes com a doença freqüentemente apresentam um ou mais lesões extrabucais. Eisen4, por exemplo, menciona que aproximadamente 25% das mulheres com líquen plano oral apresentam também envolvimento concomitante das mucosas vulvar e vaginal, e que cerca de 15% de todos os pacientes com a doença exibem lesões cutâneas. Segundo Neville et al.15, as lesões em pele têm sido classificadas como pápulas poligonais pruríticas e purpúreas. Elas normalmente afetam as superfícies do flexor das extremidades. Escoriações podem não estar visíveis, apesar do fato de que as lesões dão uma sensação de irritação, pois doem quando o paciente coça. O exame cuidadoso da superfície das pápulas de pele revela uma fina rede em forma de laço de linhas brancas (estrias de Wickham). Outros locais de envolvimento extrabucal incluem as unhas, couro cabeludo, glande peniana e mucosa esofágica.
As lesões cutâneas facilitam consideravelmente o diagnóstico da doença. No entanto, com exceção da forma reticular que possui características patognomônicas, a maioria dos casos é diagnosticada por meio do exame histopatológico. De fato, o líquen plano erosivo faz diagnóstico diferencial com carcinoma epidermóide, lúpus eritematoso discóide, candidíase crônica, penfigóide benigno de mucosa, morsicatio buccarum, reação liquenóide ao amálgama ou a drogas, doença do enxerto versus hospedeiro e eritema multiforme O próprio líquen plano reticular faz, em alguns casos, diagnóstico diferencial com a leucoplasia14.
DIAGNÓSTICO E TRATAMENTO
Os aspectos clínicos característicos do líquen plano bucal são, na maioria das vezes, suficientes para o diagnóstico correto da doença. Ainda assim, a biópsia associada ao exame histopatológico é recomendada para confirmar o diagnóstico clínico e, principalmente, para excluir a presença de atipias epiteliais ou mesmo indícios de malignidade18.
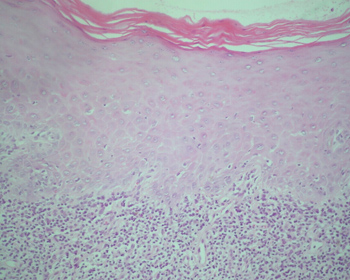
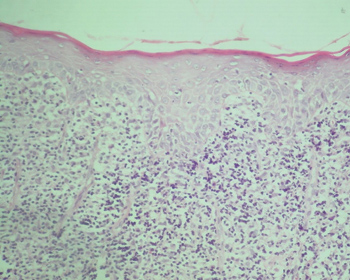
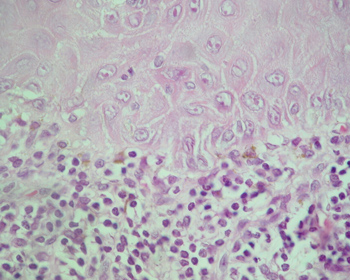
Os achados histopatológicos clássicos do líquen plano bucal incluem: liquefação da camada basal, acompanhada por um intenso infiltrado linfocitário disposto em faixa, imediatamente subjacente ao epitélio; presença de numerosos corpúsculos colóides eosinofílicos na interface epitélio-tecido conjuntivo (corpos de Civatte); cristas interpapilares ausentes, hiperplásicas ou, mais freqüentemente, em forma de "dente de serra"; variações da espessura da camada espinhosa e graus variáveis de orto ou paraqueratose14-15,21-22 (Figuras 1 a 4).
Figura 1. Líquen plano. Corte histológico exibindo epitélio com hiperparaqueratose, discreta acantose e liquefação da camada basal acompanhada por um intenso infiltrado linfocitário disposto em faixa, imediatamente subjacente ao epitélio. H/E - 400x.
Figura 2. Líquen plano. Observar áreas de atrofia epitelial. Na lâmina própria intenso infiltrado linfocitário disposto em faixa, imediatamente subjacente ao epitélio. H/E - 400x.
Figura 3. Líquen plano. Epitélio mostrando queratinócitos volumosos com nucléolos proeminentes e liquefação da camada basal. Na lâmina própria queda de pigmentação melânica e intenso infiltrado linfocitário disposto em faixa, imediatamente subjacente ao epitélio. H/E - 400x.
Figura 4. Líquen plano. Epitélio exibindo liquefação da camada basal. Corpo de Civatte (centro). H/E - 400x.
Outras condições, no entanto, podem apresentar características histopatológicas semelhantes às encontradas no líquen plano bucal, incluindo reações liquenóides, lúpus eritematoso, leucoplasia, eritroleucoplasia e leucoplasia verrucosa proliferativa. Esta última possui na sua fase inicial achados clínicos e histopatológicos que podem ser facilmente confundidos com aqueles exibidos pelo líquen plano, todavia ela revela frequentemente graus variados de atipia epitelial e altas taxas de transformação maligna23.
Por esse motivo, Kolde et al.24 sugerem a utilização da imunofluorescência direta como procedimento de rotina no diagnóstico do líquen plano bucal, especialmente, quando outras doenças de caráter auto-imune fazem parte das hipóteses diagnósticas. De fato, segundo Regezi & Sciubba22, a imunofluorescência direta revela a presença de fibrinogênio ao longo da zona da membrana basal, entre 90% a 100% dos casos. Embora também possam ser encontrados fatores do complemento e imunoglobulinas, são muito menos comuns do que a deposição de fibrinogênio.
De qualquer forma, o diagnóstico histopatológico do líquen plano bucal exige atenção redobrada. Van der Meij & Van der Waal25, por exemplo, verificaram que 42% dos casos, nos quais houve plena concordância a respeito do diagnóstico clínico da doença, não existiu consenso em relação ao diagnóstico histopatológico. Por outro lado, em 50% dos casos, em que se chegou a tal consenso, faltou concordância clínica.
Além disso, alguns autores sugerem que o líquen plano reticular e erosivo deveriam ser considerados separadamente. Segundo Karatsaidis et al.26, o aumento considerável da proliferação celular no líquen plano erosivo comparado ao reticular indica que a forma erosiva possui maior atividade, o que reforça a importância de se estudar cada uma das formas de apresentação da doença isoladamente. Seoane et al.27 confirmam tal importância, afirmando que as formas reticular e erosiva apresentam comportamento biológico distintos.
Finalmente, Lukac et al.28, após avaliarem a concentração sérica de anticorpos circulantes contra a desmogleína-1 e -3, através do teste ELISA, em 32 pacientes com líquen plano erosivo, 25 com reticular, 13 com estomatite aftosa recorrente e cinqüenta sem qualquer alteração clínica, concluíram que as diferenças nas concentrações séricas de anticorpos contra a desmogleína-1 e -3 indicam que os mecanismos envolvidos com a etiopatogenia do líquen plano reticular e erosivo não são os mesmos.
Outro ponto que deve ser considerado no diagnóstico histopatológico do líquen plano bucal, devido principalmente ao seu possível potencial de malignização, é a integridade das margens da lesão. Conforme Redahan et al.29, cerca de 50% dos casos biopsiados apresentam as margens comprometidas, sugerindo que o exame dos tecidos circunvizinhos deveria fazer parte de qualquer protocolo de acompanhamento da doença.
Uma vez confirmado o diagnóstico, o tratamento da doença tem como objetivo o alívio dos sintomas, pois a cura nem sempre é possível. Segundo Regezi & Sciubba22, os corticoesteróides são os medicamentos de escolha no tratamento do líquen plano, o que se deve a sua capacidade de modular a resposta inflamatória e imunológica. A aplicação tópica, bem como a injeção local de esteróides, têm sido usadas com sucesso no controle da doença. Todavia, nos casos em que os sintomas são graves, pode-se optar pelo uso sistêmico. A adição de antifúngicos ao tratamento potencializa os resultados clínicos. Tal fato aparentemente é conseqüência da eliminação do crescimento secundário da Candida albicans no tecido envolvido pelo líquen plano. Os antifúngicos também previnem o crescimento associado ao uso de corticoesteróides.
Ainda assim, outros medicamentos têm sido utilizados, com excelentes resultados, no tratamento do líquen plano, entre os quais, destacam-se os agentes imunossupressores, como a ciclosporina30 e o tacrolimus31-32, embora teoricamente tais medicamentos possam aumentar a possibilidade de transformação maligna, pois, além de atuarem sobre o sistema imunológico, agem diretamente sobre as células23.
Becker et al.33, por exemplo, acreditam que a relação entre o uso tópico do tacrolimus e o desenvolvimento do carcinoma epidermóide em pacientes com líquen plano bucal não se limita à mera supressão do sistema imunológico. Para estes autores, o tacrolimus parece interferir sobre algumas importantes vias de sinalização intracelular, especialmente as relacionadas com a proteína P53, cuja alteração está presente em diversos tipos de câncer.
POTENCIAL DE MALIGNIZAÇÃO
Durante as últimas décadas, numerosos estudos têm indicado um aumento no risco de desenvolvimento de câncer em pacientes com líquen plano bucal, fazendo com que Organização Mundial da Saúde classificasse esta doença como condição pré-maligna. Contudo, a associação entre o líquen plano bucal e o carcinoma epidermóide ainda é bastante polêmica, uma vez que muitos autores acreditam não haver dados suficientes que comprovem tal associação. Para estes autores, a grande maioria dos casos de transformação maligna não poderiam ser assim considerados, por já apresentarem alterações sugestivas de malignidade no momento em que se chegou ao diagnóstico inicial de líquen plano. Ainda assim, não são poucos os estudos que destacam o seu potencial de malignização21,34.
Eisen4 estudou o potencial de transformação maligna do líquen plano bucal, além de suas características clínicas e possíveis relações com alterações sistêmicas. Após acompanhamento de 723 pacientes com a doença num período de seis meses a oito anos, foi constatado o desenvolvimento do carcinoma epidermóide em locais previamente diagnosticados como líquen plano em 0,8% dos pacientes avaliados. Frente a isto, o autor afirma ser fundamental o acompanhamento periódico dos pacientes com líquen plano bucal, devido ao aumento do risco de desenvolvimento do carcinoma epidermóide em locais acometidos pela doença.
Gandolfo et al.35, num estudo semelhante, avaliaram 402 pacientes com líquen plano bucal, diagnosticados entre janeiro de 1988 e julho de 1999, e acompanhados periodicamente até fevereiro de 2001. Neste período dois homens (1,3%) e sete mulheres (2,8%) desenvolveram carcinoma epidermóide, mostrando um risco de transformação maligna maior entre as mulheres do que entre os homens. Além disso, foi observado que pacientes infectados pelo vírus da hepatite C tinham uma chance três vezes superior de desenvolver câncer bucal do que os não infectados. Estes resultados não só reforçam as suspeitas quanto ao potencial de transformação maligna do líquen plano como também chamam a atenção para a participação do vírus da hepatite C neste processo.
Xue et al.16 estudaram as características clínicas do líquen plano bucal em 674 pacientes atendidos pelo Setor de Estomatologia da Universidade de Wuhan, China, entre 1963 e 2003. Dos 674 pacientes avaliados, aproximadamente 0,65% desenvolveram carcinoma epidermóide em locais previamente diagnosticados como líquen plano erosivo ou atrófico, sugerindo que ambas as formas de apresentação da doença possuem maior risco de transformação maligna que a reticular. Além disso, os autores chamaram a atenção para a necessidade de se acompanhar os pacientes com líquen plano por muitos anos, uma vez que num dos casos de transformação maligna esta ocorreu 21 anos após o diagnóstico inicial da doença.
De fato, tais resultados confirmaram os obtidos por Lanfranchi-Tizeira et al.36 em 2003. Estes autores, após avaliarem 719 casos de líquen plano bucal diagnosticados pelo Serviço de Patologia e Clínica Bucodental II da Faculdade de Odontologia da Universidade de Buenos Aires, Argentina, no período de 1991 a 1997, verificaram que todos os 32 (6,51%) casos de transformação maligna observados ocorrem a partir de formas atípicas da doença, que incluem o líquen plano em placa, erosivo e atrófico.
Contudo, ainda não se sabe com certeza o porquê de tal transformação acontecer. Para Mignogna et al.37 (2004), atualmente existem evidências suficientes comprovando que processos inflamatórios crônicos, como é o caso do líquen plano bucal, criariam um micro-ambiente baseado em citocinas capaz de influenciar a sobrevida das células, além do seu crescimento, proliferação e diferenciação, contribuindo conseqüentemente com a iniciação, promoção e progressão do câncer.
Alguns autores, por outro lado, acreditam que tal transformação seja favorecida por alterações na expressão de proteínas que regulam os mecanismos de apoptose, como, por exemplo a p53. Realmente, segundo Neppelberg et al.38, há aumento considerável do número de células epiteliais em apoptose nos locais de acometimento da doença em comparação com o epitélio normal.
Valente et al.39 analisaram a superexpressão da proteína p53 em biópsias de 28 pacientes com líquen plano bucal feitas periodicamente durante 96 meses. Em 15 destes pacientes nenhuma alteração displásica ocorreu no período de tempo em questão (grupo 1). Em outros sete, houve sincronismo entre o diagnóstico da doença e o desenvolvimento do carcinoma epidermóide (grupo 2), enquanto que no restante dos pacientes, tal desenvolvimento só foi observado meses ou anos depois (grupo 3). A porcentagem de células epiteliais p53-positivas foi consideravelmente mais alta nos grupos 2 e 3 do que no grupo 1. Em contraste, a taxa de proliferação celular, determinada através da avaliação da expressão imunohistoquímica da proteína MIB-1, não mostrou diferença estatística entre os três grupos. Embora não se possa chegar a nenhuma conclusão a respeito das rotas moleculares que levam o líquen plano bucal a sofrer transformação maligna, os resultados indicam que a avaliação imunohistoquímica da expressão da p53 pode ser uma ferramenta bastante útil na seleção dos casos em que há maior potencial de malignização.
Lee et al.40 investigaram a expressão das proteínas p53 e PCNA (do inglês, Proliferating Cell Nuclear Antigen) no líquen plano bucal e sua relação com o comportamento clínico da doença e com os hábitos dos pacientes. Para tanto, os autores avaliaram imunohistoquimicamente a expressão destas proteínas em 56 pacientes, comparando-a com a observada em amostras de mucosa bucal normal, hiperqueratótica, displásica e carcinoma epidermóide. A expressão da p53 e da PCNA no líquen plano bucal foi similar à mucosa hiperqueratótica, mas superior à normal e inferior à displásica e ao carcinoma epidermóide. Todavia, não foi observada correlação significativa entre a expressão destas duas proteínas e qualquer característica clínica da doença. A expressão da p53 porém, foi mais alta nos pacientes que tinham o hábito de mascar uma mistura de noz de areca com tabaco e cal apagada, enquanto que a expressão da PCNA foi maior nas formas atróficas da doença do que nas hipertróficas. Nos pacientes que apresentavam as formas atróficas da doença e possuíam tal hábito, a expressão destas proteínas foi consideravelmente mais elevada, aproximando-se da encontrada na mucosa displásica e no carcinoma epidermóide. Segundo os autores, tais resultados confirmam a natureza pré-maligna do líquen plano bucal e sugerem que as formas atróficas da doença possuem um maior potencial de malignização, especialmente quando associadas à determinado hábito.
Bascones et al.41 estudaram a influência dos mecanismos de interrupção do ciclo celular e de apoptose no processo de transformação maligna do líquen plano bucal. Após avaliarem o índice de apoptose pelo método TUNEL (do inglês, Terminal Deoxyribonucleotidyl Transferase Mediated dUTP Nick End Labelling) e a expressão imunohistoquímica das proteínas bax, caspase-3 e p21 em amostras da mucosa bucal de 32 pacientes com a doença, os autores concluíram que a baixa resposta das células epiteliais aos mecanismos de interrupção do ciclo celular e de apoptose pode favorecer tal transformação.
No entanto, embora existam inúmeros estudos que comprovam a natureza pré-maligna do líquen plano bucal, outros tantos afirmam o contrário. Sousa et al.42 (2005), por exemplo, não encontraram nenhuma ligação entre o líquen plano bucal e o carcinoma epidermóide em relação a aspectos como sexo, raça, idade e localização de maior prevalência da doença, indicando que o perfil dos pacientes acometidos pelo líquen plano difere consideravelmente daquele observado nos pacientes com carcinoma epidermóide.
Vários autores acreditam que grande parte dos casos de transformação maligna descritos na literatura não deveriam ser assim considerados, pois exibiriam graus variados de atipia epitelial no momento do diagnóstico inicial, o que definiria uma condição com características histopatológicas distintas, denominada displasia liquenóide. Segundo Lodi et al.23, o próprio processo inflamatório presente no líquen plano bucal é capaz de levar ao aparecimento de alteração celular semelhante àquelas vistas na atipia epitelial, tornando ainda mais difícil diferencia-lo da displasia liquenóide.
Estudos recentes reformam a idéia de que o líquen plano e a displasia liquenóide devem ser considerados como duas entidades distintas. Além disso, hoje se sabe que é a presença de atipias epiteliais que confere a uma determinada lesão seu potencial de malignização, portanto a displasia liquenóide, e não o líquen plano, deveria ser classificada como uma lesão pré-maligna. De fato, a possibilidade de transformação maligna reflete uma série de alterações moleculares intrínsecas às células, alterações estas observadas na displasia liquenóide43.
Kim et al.44, após avaliarem o potencial de malignização do líquen plano bucal, comparando o grau de instabilidade genética entre casos da doença curados clinicamente e casos que sofreram transformação maligna, concluíram que a displasia liquenóide deve ser encarada como uma lesão pré-maligna de alto risco e que a monossomia do cromossomo nove pode ter importante papel no processo de transformação maligna desta lesão.
Van der Meij et al.45 realizaram um estudo prospectivo no qual acompanharam 62 pacientes com líquen plano bucal e 111 com displasia liquenóide durante um período de 6,6 a 72 meses. Dos 173 pacientes avaliados, três (1,7%), desenvolveram carcinoma epidermóide, sendo que todos os casos de transformação maligna ocorreram em pacientes com displasia liquenóide. Contudo, os autores sugerem que novos estudos prospectivos, envolvendo um número bem maior de pacientes, deveriam ser realizados antes de se chegar a um parecer final a respeito do potencial de malignização do líquen plano bucal e da displasia liquenóide. Eles também salientam que, independentemente do líquen plano ser considerado, ou não, como lesão pré-maligna, a simples suspeita já justifica a proservação dos pacientes a longo prazo.
Para Mattsson et al.46, no entanto, apesar de existirem indícios suficientes comprovando o potencial de malignização do líquen plano, a baixa incidência de transformação maligna da doença torna o acompanhamento periódico dos pacientes inviável financeiramente, em particular, quando realizado por especialistas. Ainda assim, é importante que todos os profissionais de saúde conheçam os sinais precoces do câncer de boca, assegurando sua detecção durante o atendimento de rotina. Além disso, os pacientes precisam ser instruídos a informar qualquer mudança em sua condição.
CONCLUSÃO
Independentemente da grande polêmica em torno do líquen plano bucal, esta deve se restringir apenas ao nível acadêmico, pois na prática a mera possibilidade dele sofrer transformação maligna já justifica a importância do acompanhamento a longo prazo dos pacientes com a doença. Tal importância fica ainda mais evidente frente às dificuldades existentes em relação ao seu diagnóstico clínico e histopatológico. No entanto, deve-se tomar cuidado ao se informar o paciente quanto à sua condição, para não lhe transmitir uma preocupação excessiva que só serviria para agravar o quadro da doença.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Gorsky M, Epstein JB, Hasson-Kanfi H, Kaufman E. Smoking habits among patients diagnosed with oral lichen planus. Tobacco Induced Diseases 2004;2(2):103-8.
2. Sousa FACG, Rosa LEB. Perfil epidemiológico dos casos de líquen plano oral pertencentes aos arquivos da Disciplina de Patologia Bucal da Faculdade de Odontologia de São José dos Campos - UNESP. Cienc Odontol Bras 2005;8(4):96-100.
3. Sugerman PB, Savage NW, Walsh LJ, Zhao ZZ, Zhou XJ, Khan A et al. The pathogenesis of oral lichen planus. Crit Rev Oral Biol Med 2002;13(4):350-65.
4. Eisen D. The clinical features, malignant potential, and systemic associations of oral lichen planus: a study pf 723 patients. J Am Acad Dermatol 2002;46(2):207-14.
5. Lodi G, Giuliani M, Majorana A, Sardella A, Bez C, Demarosi F et al. Lichen planus and hepatitis C virus: a multicentre study of patients with oral lesions and a systematic review. Br J Dermatol 2004;151(6):1172-81.
6. Nagao Y, Sata M. Hepatitis C virus and lichen planus. J Gastroenterol Hepatol 2004;19(10):1101-13.
7. Henderson L, Muir M, Mills PR, Spence E, Fox R, McCruden EAB et al. Oral health of patients with hepatitis C virus infection: a pilot study. Oral Dis 2001;7(5):271-5.
8. Cunha KSG, Manso AC, Cardoso AS, Paixão JBA, Coelho HSM, Torres SR. Prevalence of oral lichen planus in Brazilian patients with HCV infection. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;100(3):330-3.
9. Micó-Llorens JM, Molina ED, Comellas CB, Aytés LB, Escoda CG. Relación entre la hepatitis crónica vírica B y/o C y el liquen plano bucal. Med Oral 2004;9:183-90.
10. Romero MA, Seoane J, Varela-Centelles P, Diz-Dios P, Otero XL. Clinical and pathological characteristics of oral lichen planus in hepatitis C-positive and -negative patients. Clin Otolaryngol 2002;27(1):22-26.
11. Soto-Araya M, Rojas-Alcayaga G, Esguep A. Asociación entre alteraciones psicológicas y la presencia de líquen plano oral, síndrome boca urente y estomatitis aftosa recividante. Med Oral 2004;9:1-7.
12. Koray M, Dülger O, Ak G, Horasanli S, Üçok A, Tanyeri H et al. The evaluation of anxiety and salivary cortisol levels in patients with oral lichen planus. Oral Dis 2003;9(6):298-301.
13. Ivanovski K, Nakova M, Warburton G, Pesevska S, Filipovska A, Nares S. et al. Psychological profile in oral lichen planus. J Clin Periodontal 2005;32(10):1034-40.
14. Edwards PC, Kelsch R. Oral lichen planus: Clinical presentation and management. J Can Dent Assoc 2002;68(8):494-9.
15. Neville BW, Dann DD, Allen CM, Bouquet JE. Patologia oral & maxilofacial, 2. ed. Rio de Janeiro: Guanabara Koogan; 2004. 784 p.
16. Xue JL, Fan M-W, Wang S-Z, Chen X-M, Li Y, Wang L. A clinical study of 674 patients with oral lichen planus in China. J Oral Pathol Med 2005;34(8):467-72.
17. Laeijendecker R, Joost TV, Tank B, Oranje AP, Neumann HAM. Oral lichen planus in childhood. Pediatr Dermatol 2005;22(4):299-304.
18. Eisen D, Carrozzo M, Sebastian J-VB, Thongprasom K. Oral lichen planus:clinical features and management. Number V. Oral Dis 2005;11(6):338-49.
19. Mollaoglu N. Oral lichen planus:a review. Br J Oral Maxillofac Surg 2000;38(4):370-7.
20. Mignogna MD, Lo Russo L, Fedele S. Gingival involvement of oral lichen planus in a series of 700 patients. J Clin Periodontol 2005;32(10):1029-33.
21. Eisenberg E. Oral lichen planus: a benign lesion. J Oral Maxillofac Surg 2000;58(11):1278-85.
22. Regezi JA, Sciubba JJ. Patologia bucal: correlações clínico-patológicas. 3. ed. Rio de Janeiro: Guanabara Koogan, 2000. 475 p.
23. Lodi G, Scully C, Carrozzo M, Griffiths M, Sugerman PB, Thongprasom K. Current controversies in oral lichen planus: report of an international consensus meeting. Part 2. Clinical management and malignant transformation. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;100(2):164-78.
24. Kolde G, Wesendahl C, Stein H, Reichart PA. Oral lichen planus: diagnostic immunofluorescence testing on routine histological material. Br J Dermatol 2003;148(2):374-6.
25. Van Der Meij EH, Van Der Waal I. Lack of clinicopathologic correlation in the diagnosis of oral lichen planus based on the presently available diagnostic criteria and suggestions for modifications. J Oral Pathol Med 2003;32(9):507-12.
26. Karatsaidis A, Schreurs O, Helgeland K, Axéll T, Schenck K. Erythematous and reticular forms of oral lichen planus and oral lichenoid reactions differ in pathological features related to disease activity. J Oral Pathol Med 2003;32(5):275-81.
27. Seoane J, Romero MA, Varela-Centelles P, Diz-Dios P, Gacia-Pola MJ. Oral lichen planus: a clinical and morphometric study of oral lesions in relation to clinical presentation. Braz Dent J 2004;15(1):9-12.
28. Lukac J, Brozovic S, Vucicevic-Boras V, Mravak-Stipetic M, Malenica B, Kusic Z. Serum autoantibodies to desmogleins 1 and 3 in patients with oral lichen planus. Croat Med J 2006;47(1):53-8.
29. Redahan S, O´Regan E, McCartan B, Toner M. Histological evidence for lichen planus in clinically normal perilesional tissue. Int J Oral Maxillofac Surg 2005;34(6):674-7.
30. Demitsu T, Sato T, Inoue T, Okada O, Kubota T. Corticosteroid-resistant erosive oral lichen planus successfully treated with topical cyclosporine therapy. Int J Dermatol 2000;39(1):79-80.
31. Morrison L, Kratochvil FJ, Gorman A. An open trial of topical tacrolimus for erosive oral lichen planus. J Am Acad Dermatol 2002;47(4):617-20.
32. Shichinohe R, Shibaki A, Nishie W, Tateishi Y, Shimizu H. Successful treatment of severe recalcitrant erosive oral lichen planus with topical tacrolimus. J Eur Acad Dermatol Venereol 2006;20(1):66-8.
33. Becker JC, Houben R, Vetter CS, Bröcker EB. The carcinogenic potential of tacrolimus ointment beyond immune suppression: a hypothesis creating case report. BMC Cancer 2006;6:7.
34. Rödström PO, Jontell M, Mattsson U, Holmberg E. Cancer and oral lichen planus in a Swedish population. Oral Oncol 2004;40(2):131-8.
35. Gandolfo S, Richiardi L, Carrozzo M, Broccoletti R, Carbone M, Pagano M et al. Risk of oral squamous cell carcinoma in 402 patients with oral lichen planus: a follow-up study in an Italian population. Oral Oncol 2004;40(1):77-83.
36. Lanfranchi-Tizeira H, Aguas SC, Sano SN. Transformación maligna del Líquen Plano Bucal atípico: Análisis de 32 casos. Med Oral 2003;8:2-9.
37. Mignogna MD, Fedele S, Lo Russo L, Lo Muzio L, Bucci E. Immune activation and chronic inflammation as the cause of malignancy in oral lichen planus: is there any evidence? Oral Oncol 2004;40(2):120-30.
38. Neppelberg E, Johannessen AC, Jonson R. Apoptosis in lichen planus. Eur J Oral Sci 2001;109(5):361-4.
39. Valente G, Pagano M., Carrozzo M, Carbone M, Bobba V, Palestro G et al. Sequential immunohistochemical p53 expression in biopsies of oral lichen planus undergoing malignant evolution. J Oral Pathol Med 2001;30(3):135-40.
40. Lee JJ, Kuo M-J, Cheng S-J, Chiang C-P, Jeng J-H, Chang H-H et al. Higher expressions of p53 and proliferating cell nuclear antigen (PCNA) in atrophic oral lichen planus and patients with areca quid chewing. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005;99(4):471-8.
41. Bascones C, Gonzalez-Moles MA, Esparza G, Bravo M, Acevedo A et al. Apoptosis and cell cycle arrest in oral lichen planus Hypothesis on their possible influence on its malignant transformation. Arch Oral Biol 2005;50(10):873-81.
42. Sousa FACG, Fontes PC, Bolanho A, Rosa LEB. Estudo comparativo entre o líquen plano e o carcinoma epidermóide em mucosa bucal. Cienc Odontol Bras 2005;8(1):55-60.
43. Epstein JB, Wan LS, Gorsky M, Zhang L. Oral lichen planus: progress in understanding its malignant potential and implications for clinical management. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003;96(1):32-7.
44. Kim J, Yook JI, Lee EH, Ryu MH, Yoon JH, Hong JC et al. Evaluation of premalignant potential in oral lichen planus using interphase cytogenetics. J Oral Pathol Med 2001;30(2):65-72.
45. Van Der Meij EH, Schepman KP, Van Der Waal I. The possible premalignant character of oral lichen planus and oral lichenoid lesions: A prospective study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003;96(2):164-71.
46. Mattsson U, Jontell M, Holmstrup P. Oral lichen planus and malignant transformation: is a recall of patients justified? Crit Rev Oral Biol Med 2002;13(5):390-6.
1 Mestre em Biopatologia Bucal pela FOSJC/UNESP, Cirurgião-Dentista.
2 Professor Adjunto de Patologia Bucal da FOSJC/UNESP, Cirurgião-Dentista.
Endereço para correspondência: Fernando Augusto Cervantes Garcia de Sousa - Rua Irmã Maria Demétria Kfruri 196 Jardim Esplanada II São José dos Campos SP 12242-500. CAPES.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 27 de julho de 2006. cod. 3302.
Artigo aceito em 30 de setembro de 2006.