Ano: 2008 Vol. 74 Ed. 1 - Janeiro - Fevereiro - (4º)
Seção: Artigo Original
Páginas: 21 a 28
Deficiência auditiva na toxoplasmose congênita detectada pela triagem neonatal
Hearing loss in congenital toxoplasmosis detected by newborn screening
Autor(es): Gláucia Manzan Queiroz de Andrade 1, Luciana Macedo de Resende 2, Eugênio Marcos Andrade Goulart 3, Arminda Lucia Siqueira 4, Ricardo Wagner de Almeida Vitor 5, José Nelio Januario 6
Palavras-chave: perda auditiva, toxoplasmose congênita, triagem neonatal.
Keywords: hearing loss, congenital toxoplasmosis, newborn screening.
Resumo:
A toxoplasmose congênita pode causar déficit neurossensorial em até 20% dos casos e o tratamento no primeiro ano de vida melhora o prognóstico. No Brasil, desconhece-se o impacto da infecção na hipoacusia. Objetivo: Avaliar a audição de crianças com toxoplasmose congênita identificadas pela triagem neonatal. Material e Método: Estudo prospectivo de crianças com toxoplasmose congênita identificadas pela triagem neonatal (IgM anti-T. gondii) em Belo Horizonte, durante 2003/2004. Realizada sorologia confirmatória (mãe/filho) e consideradas positivas as crianças apresentando IgM e/ou IgA nos primeiros seis meses ou IgG aos 12 meses de vida. Avaliações auditivas ao diagnóstico e após 12 meses incluíram Audiometria Comportamental, Emissões Otoacústicas, Imitanciometria, Audiometria de Tronco Encefálico. Resultados: Dentre 30.808 crianças triadas (97% dos nascidos vivos), 20 apresentavam toxoplasmose congênita, 15 (75%) com infecção subclínica. Dezenove crianças realizaram avaliação auditiva. Quatro apresentaram déficit neurossensorial (21,1%). Uma criança apresentou outros fatores de risco para hipoacusia; nas outras três, a toxoplasmose foi o único fator observado. Duas crianças, tratadas adequadamente com antiparasitários, apresentaram déficit auditivo, em desacordo com a literatura. Conclusão: Os achados sugerem que a toxoplasmose congênita, prevalente no Brasil, é um fator de risco para hipoacusia e o impacto dessa infecção nas perdas auditivas deve ser estudado.
Abstract:
Congenital toxoplasmosis may cause sensorineural deficit in up to 20% of the patients and proper treatment in the first year improves prognosis. In Brazil, this infection's impact on hearing impairment is unknown. Aim: To evaluate hearing of newborns with congenital toxoplasmosis identified by the newborn screening service. Method: This prospective study analyzed children with congenital toxoplasmosis identified by newborn screening (IgM anti-T.gondii) in Belo Horizonte during 2003/2004. The presence of IgM and/or IgA in the first 6 months or IgG at 12 months-of age in serology was used as case definition. Hearing tests were carried out at the time of diagnosis and 12 months later, including behavioral audiometry, evoked otoacoustic emission and brainstem evoked responses audiometry. Results: Among 30.808 screened children (97% of live births), 20 had congenital toxoplasmosis, 15 (75%) were asymptomatic at birth. Nineteen children were evaluated by hearing tests. Four had sensorineural impairment (21.1%). One child had other risk factors for hearing impairment; the other three had no other risk factors but toxoplasmosis. Two properly children treated still had hearing loss, in disagreement with current literature. Conclusion: Results suggest that congenital toxoplasmosis, common in Brazil, is a risk factor for hearing impairment and its impact on hearing loss deserves further studies.
![]()
INTRODUÇÃO
A audição desempenha papel importante no desenvolvimento do ser humano. O sistema auditivo periférico apresenta-se totalmente formado ao nascimento, enquanto o sistema auditivo central irá amadurecer até os dois anos de idade. Este período corresponde ao de maior plasticidade neuronal da via auditiva, e o amadurecimento depende da quantidade e da qualidade dos estímulos externos captados. A identificação da perda auditiva e a reabilitação precoces são essenciais para o desenvolvimento da fala (período crítico e período ótimo)1, da linguagem e outras funções cognitivas durante a idade escolar2.
A redução da acuidade auditiva (hipoacusia) tem evolução silenciosa, principalmente nos primeiros anos de vida, quando a criança ainda não queixa dificuldade auditiva. Na infância, apresenta uma prevalência mundial de 1/1000 nascidos vivos3,4, sendo mais elevada (2-4%) em egressos de unidade de terapia intensiva neonatal (UTI)2,5. Está associada a causas genéticas e ambientais, mas em um número significativo de crianças a etiologia é desconhecida4,6. Dentre os fatores de risco para hipoacusia destacam-se a história familiar de déficit auditivo, malformação craniofacial, síndrome genética, peso de nascimento menor que 1000 g, asfixia, hiperbilirrubinemia e uso de ventilação mecânica5.
As perdas auditivas podem ser classificadas quanto ao tipo (neurossensorial ou condutiva), lateralidade, simetria, característica clínica (sindrômica ou não), momento de aquisição (congênita, peri ou pós-natal), hereditariedade (genética ou não), momento de manifestação (pré-lingual, perilingual ou pós-lingual)4. Podem também ser classificadas quanto à intensidade em leve, moderada, grave e profunda. Na hipoacusia condutiva ocorre impedimento da condução eficaz do som do meio externo até a cóclea e na hipoacusia neurossensorial ocorre comprometimento da cóclea e/ou nervo coclear (via auditiva central).
Já está bem estabelecida a associação entre algumas infecções congênitas e perda auditiva. Os agentes infecciosos mais freqüentemente associados com hipoacusia são o Citomegalovirus (CMV)7, o vírus da rubéola3,8-10, o Toxoplasma gondii e o vírus herpes11. Recentemente, os recém-nascidos portadores do vírus HIV também estão sendo incluídos nesse grupo de risco12. Crianças com rubéola congênita apresentam déficit auditivo em cerca de 20% dos casos4,9 e as com infecção pelo CMV, especialmente as sintomáticas, em até 40%.
O Toxoplasma gondii tem sido associado a lesão das vias auditivas desde a década iniciada em 195013, com demonstração de depósitos de cálcio (similares às calcificações encontradas nos cérebros das crianças com toxoplasmose congênita) no ligamento espiral e cóclea14. O déficit auditivo tem sido relatado em cerca de 20% dos casos de toxoplasmose congênita, principalmente nas crianças não-tratadas ou tratadas por período muito curto4,15,16. Eichenwald (1947), estudando crianças não-tratadas durante o primeiro ano de vida, encontrou surdez em 17% (12/70) das crianças com a forma neurológica da doença e em 10% (3/31) com a forma generalizada. A ocorrência de surdez grave tem sido quase totalmente limitada a casos com manifestações clínicas de grande intensidade17, mas Wilson et al.18,19 relataram a ocorrência de perda auditiva unilateral ou bilateral em 5 (26%) de 19 crianças com infecção subclínica. Outros autores não têm encontrado associação entre a parasitose e hipoacusia, quando as crianças são tratadas15,20, persistindo dúvidas quanto à freqüência com que a toxoplasmose pode levar a déficit auditivo13,17,21.
Considerando-se a escassez de informação sobre a ocorrência de perdas auditivas significativas nas crianças portadoras de toxoplasmose congênita, especialmente aquelas com infecção subclínica, esse estudo se propõe a caracterizar o padrão de perda auditiva em crianças com toxoplasmose congênita identificadas pela triagem neonatal em Belo Horizonte, Minas Gerais.
MATERIAL E MÉTODO
No período de setembro de 2003 a outubro de 2004 foi realizado em Belo Horizonte, Minas Gerais, um projeto piloto de triagem neonatal, utilizando o imunoensaio IgM anti-T. gondii em sangue seco, para avaliar a incidência de toxoplasmose congênita em nascidos vivos no município e a triagem neonatal como estratégia para o diagnóstico e tratamento precoces das crianças infectadas. O Programa de Triagem Neonatal em Minas Gerais testa cerca de 97% dos nascidos vivos conforme dados do SINASC/SES fornecidos para o ano de 2004. Os critérios para definição de toxoplasmose congênita foram aqueles aceitos consensualmente pelos estudiosos do tema: IgM e/ou IgA positivos nos primeiros seis meses, ou IgG persistentemente positiva aos 12 meses de vida da criança22.
As crianças infectadas foram tratadas (sulfadiazina, pirimetamina e ácido folínico) durante 12 meses23, acompanhadas durante 24-36 meses e submetidas à avaliação multiprofissional, que consistiu em exame pediátrico, oftalmológico e auditivo. A avaliação auditiva foi realizada ao diagnóstico e após 12 meses no Serviço de Audiologia do Hospital das Clínicas da UFMG (HCUFMG) e consistiu em Audiometria Comportamental, Emissões Otoacústicas Evocadas Transientes e por Produto de Distorção, Imitanciometria e Potencial Evocado Auditivo de Tronco Encefálico (PEATE). Quando necessário e com o consentimento do responsável pela criança, o PEATE foi realizado sob sedação, no bloco cirúrgico do HCUFMG. Diante de um resultado duvidoso, os exames foram repetidos em momentos diferentes ao longo do crescimento da criança. A coleta de dados para esse estudo foi interrompida aos 24-36 meses de vida das crianças, mas seu seguimento continua nos Serviços de Infectologia Pediátrica e Audiologia do HCUFMG. As crianças portadoras de déficits auditivos foram encaminhadas para fonoterapia e protetização, quando pertinente.
Para a anamnese fonoaudiológica foi utilizado o protocolo do Serviço de Audiologia do HCUFMG que investiga as variáveis mais comumente associadas com hipoacusia4: história familiar de perda auditiva; intercorrências durante a gestação (infecções do grupo TORCHS, uso de drogas abortivas e ototóxicas); intercorrências durante o parto (hipóxia - Apgar entre 0-4 no 1º minuto e 0-6 no 5º minuto, prematuridade, baixo peso de nascimento, hiperbilirrubinemia, trauma de parto, drogas ototóxicas, ruído), intercorrências pós-natais (uso de fototerapia por mais que dois dias, uso de incubadora por mais que cinco dias, uso de ventilação mecânica por mais que cinco dias, otites de repetição, sarampo, meningite bacteriana, caxumba, encefalite, uso de drogas ototóxicas por mais que cinco dias, traumatismo cranioencefálico, trauma acústico, sepse). Foi utilizada a anamnese cuidadosa como critério para estabelecer as possíveis associações etiológicas, por ser esse método considerado eficiente6.
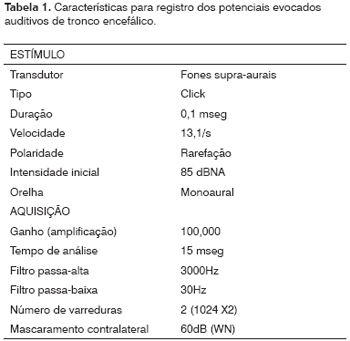
Os equipamentos utilizados para a realização dos exames audiológicos foram: Audiômetro Pediátrico (PA5) e Imitanciômetro da marca Interacoustics, padrão de calibração ANSI S3.6/ISO 389. Na audiometria comportamental foram utilizados instrumentos musicais (agogô, sino, guizo, reco-reco, coco, chocalho) padronizados para a avaliação. As emissões otoacústicas foram pesquisadas com equipamento da marca Biologic, AuDX Plus (protocolos descritos na Tabela 1). O PEATE foi realizado com equipamento Biologic Navigator, através do software EP317. Este equipamento contém dois canais de registro. As respostas foram captadas através de eletrodos de prata posicionados nos lóbulos das orelhas (A1 e A2), naso (Nz) e fronte (Fz), mantendo a impedância até 5Kohms.
O critério de normalidade adotado na análise dos potenciais auditivos foi o proposto por Gorga et al.24, cujo protocolo segue os mesmos critérios adotados na testagem realizada no ambulatório de Audiologia do HCUFMG.
Para o registro das EOAs, colocou-se na entrada do conduto auditivo externo (CAE) uma sonda que possui em seu interior um gerador de estímulos. Estes estímulos, ao atingirem a cóclea, produzem um "eco" - as otoemissões - que caminham em sentido inverso, isto é, da orelha interna para a média e daí para a externa, sendo captadas por um microfone situado no CAE. A presença das otoemissões pressupõe a integridade da orelha média e externa6. Foram consideradas presentes as emissões otoacústicas evocadas transientes quando a reprodutibilidade estivesse acima de 70% e a relação entre a amplitude da resposta e o ruído (relação S/R) maior ou igual a 6 dB. As emissões otoacústicas evocadas por produto de distorção foram consideradas presentes quando a relação S/R foi maior ou igual a 6 dB.
As variáveis pesquisadas quanto à perda auditiva foram: tipo (sensorioneural ou condutiva), grau (leve, moderada, grave e profunda), lateralidade e simetria.
Na audiometria comportamental, os padrões de resposta sugestivos de alteração auditiva central foram: resposta exacerbada, aumento da latência de resposta, dificuldade de localização com acuidade normal, ausência de habituação a estímulos repetidos, reflexo cócleo-palpebral ausente com acuidade auditiva normal 25.
Os estímulos foram calibrados psicoacusticamente em dBNA (decibéis referentes ao 0 de população jovem normal obtido psicoacusticamente). Para classificar os graus de perda auditiva foram consideradas as orientações do Bureau International D'Audiophonologie (BIAP) que classifica as perdas em leve (níveis mínimos de resposta entre 21-40 dBNA), moderada (níveis mínimos de resposta entre 41-70 dBNA), grave (níveis mínimos de resposta entre 71-90 dBNA) e profunda (sem resposta aos estímulos empregados com saída máxima de 85 dBNA)6.
As respostas foram consideradas simétricas quando as perdas auditivas eram classificadas no mesmo grau de perda do lado direito e do lado esquerdo. A assimetria foi considerada de 1 grau quando a classificação do grau de perda de um lado era a classificação imediatamente adjacente em grau de severidade de perda que a do outro lado. A assimetria foi considerada de 2 graus quando as classificações dos lados não eram adjacentes em grau de severidade.
Para construção do banco de dados foi utilizado o pacote estatístico Epi Info versão 6.0. Para análise foi utilizado, além do Epi Info, o software StatXact para realização do teste exato de Fisher. Empregou-se o teste t de Student para comparar as médias e o teste exato de Fisher para comparar a distribuição dos sexos e dos fatores de risco. Esse estudo foi aprovado pelo COEP-UFMG (ETIC 157/01) e foram respeitadas as normas para pesquisa em seres humanos, de acordo com a Resolução 196/96 da CONEP.
RESULTADOS
No período de setembro 2003 a outubro 2004, foram triadas em Belo Horizonte (BH) 30.808 crianças (cerca de 97% dos nascidos vivos) e identificadas 20 com toxoplasmose congênita, o que resultou na proporção de 1:1590 infectados por nascidos vivos. Em relação ao período em que foi realizado o diagnóstico nestas 20 crianças, seis (30%) já haviam sido identificadas durante o pré-natal (Programa de Triagem Pré-natal implantado em BH), quatro (20%) foram identificadas no período neonatal por apresentarem manifestações clínicas sugestivas da infecção, e dez (50%) foram identificadas apenas pela triagem neonatal.
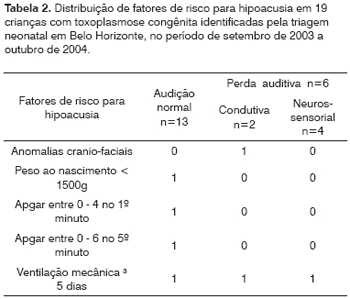
Dentre as 20 crianças identificadas pela triagem neonatal em Belo Horizonte, uma foi excluída da análise por ter evoluído para o óbito no período neonatal. Foram realizadas avaliações auditiva comportamental e Emissões Otoacústicas (EOAE) em 19 crianças e Potencial Auditivo Evocado de Tronco Encefálico - PEATE em 17. Observou-se que 13 (68,4%) crianças apresentaram avaliações normais para a idade e seis apresentaram déficit auditivo, sendo quatro (21,1%) por déficit neurossensorial e duas (10,5%) por déficit condutivo. Não houve diferença em relação ao sexo nos três grupos (p=0,99). Na Tabela 2 estão listados alguns fatores de risco para hipoacusia bem como a freqüência observada. Segundo o teste exato de Fisher, não foi detectada diferença entre os três grupos quanto a nenhum fator de risco. Uma das crianças apresentou, além da toxoplasmose, a concomitância de dois fatores de risco (peso de nascimento menor que 1500 g e ventilação mecânica por um mês), mas sua audição foi avaliada como normal.
Na população estudada não foram observados os seguintes fatores de risco para deficiência auditiva: história familiar, outras infecções intra-uterinas do grupo TORCH, hiperbilirrubinemia acentuada, uso de medicação ototóxica, meningite bacteriana, pais usuários de álcool/drogas, presença de síndromes.
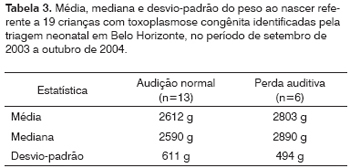
A Tabela 3 apresenta a média, mediana e desvio-padrão do peso ao nascer das 13 crianças com audiometria normal e das seis com déficit auditivo (quatro classificadas como neurossensorial e duas como condutivo). A diferença entre as médias dos pesos de nascimento nos dois grupos não mostrou significância estatística (p=0,51).
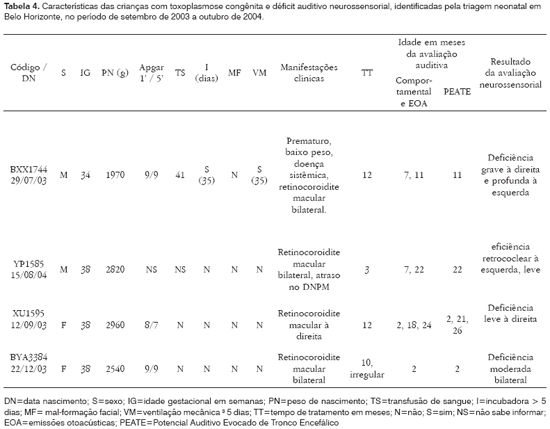
Em relação à presença de sinais ou sintomas no período neonatal, observou-se no grupo sem alteração auditiva que três crianças apresentaram manifestações sistêmicas (hepatoesplenomegalia e/ou petéquias) e, destas, duas apresentaram também hidrocefalia e microftalmia. Entre as crianças com déficit auditivo observou-se que uma apresentou manifestação sistêmica e prematuridade (Tabela 4). Após seguimento de mais de 12 meses, apenas uma criança do primeiro grupo e uma do segundo apresentam atraso no desenvolvimento neuropsicomotor.
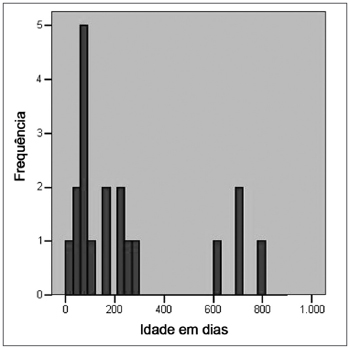
Em relação à idade em que as crianças foram submetidas à primeira avaliação auditiva, observou-se uma mediana de 157 dias, sendo que 75% das crianças realizaram a primeira avaliação até 270 dias. Mas, como pode ser visto na Figura 1, quatro crianças realizaram a primeira avaliação auditiva apenas no final do segundo ano de vida. A última avaliação auditiva foi realizada no final do segundo ano de vida (mediana de 624 dias), verificando-se que 75% das crianças realizaram essa avaliação até os 710 dias de vida.
Figura 1. Idade, em dias, da realização da primeira avaliação auditiva em 19 crianças com toxoplasmose congênita, identificadas pela triagem neonatal.
Entre as crianças com déficit neurossensorial (n=4), a perda foi grave e profunda em uma, moderada em uma e leve em duas crianças; foi bilateral em duas e unilateral em duas; e foi assimétrica em apenas uma das crianças com comprometimento bilateral (Tabela 4). Apenas uma das crianças, a mais comprometida, apresentava outros fatores considerados de risco para o desenvolvimento de hipoacusia - esteve sob ventilação mecânica por cerca de um mês. Essa criança apresentou sinais e sintomas evidentes de toxoplasmose congênita: prematuridade, hepatoesplenomegalia, baixo peso de nascimento (1970g) e retinocoroidite bilateral. As outras três crianças, uma com déficit moderado bilateral e duas com déficit leve unilateral, nasceram assintomáticas e foram identificadas apenas pela triagem neonatal. Duas dessas crianças foram encaminhadas para prótese auditiva e fonoterapia. As crianças com hipoacusia condutiva foram encaminhadas para avaliação otorrinolaringológica. Duas crianças, em que foi possível o tratamento adequado com antiparasitários, continuaram apresentando déficit auditivo, contrastando com achados de outros autores.
Em três crianças, sem déficit auditivo, que realizaram o PEATE nos primeiros três meses de vida e o repetiram após os 18 meses, observou-se déficit auditivo no primeiro exame e resultado normal no segundo, sugerindo maturação neural mais lenta nessas crianças.
Em quatro crianças avaliadas como normais pelo PEATE aos dois anos de idade, observou-se, na primeira avaliação auditiva, a ausência das EOAT e presença de EOAPD, sugerindo que estas sejam mais sensíveis para diagnóstico audiológico.
DISCUSSÃO
Existe um consenso sobre a importância do diagnóstico precoce do déficit auditivo para o melhor desenvolvimento da linguagem, cognição e socialização da criança. A triagem auditiva neonatal, recentemente obrigatória como política pública de saúde, progressivamente atingirá o universo dos recém-nascidos, mas a identificação de fatores de risco para hipoacusia permite o acompanhamento da criança e sua reavaliação no final do primeiro semestre de vida, o que aumenta a sensibilidade da triagem auditiva. Portanto, há necessidade da implementação de estratégias efetivas para identificação dos fatores de risco para essa deficiência. Entre os fatores de risco, a toxoplasmose, infecção prevalente no Brasil, tem sido pouco associada à hipoacusia. A identificação, nesse estudo, de crianças com déficit auditivo neurossensorial (4/19), dentre as triadas com toxoplasmose congênita, traz à tona a discussão sobre o impacto dessa infecção congênita nas deficiências auditivas da infância.
Dentre as 20 crianças identificadas pela triagem neonatal, 15 (75%) apresentavam infecção subclínica e, destas, nove foram identificadas apenas pela triagem neonatal.
Recentemente, estudos epidemiológicos16,21 buscando a associação entre toxoplasmose e hipoacusia observaram um risco maior de déficit auditivo entre as crianças positivas para o T. gondii, mas esses estudos, por não serem prospectivos, têm dificuldade na avaliação dos outros fatores de risco para o referido déficit. No presente estudo foi possível confirmar o diagnóstico de toxoplasmose congênita, afastar outros agentes infecciosos associados a infecções congênitas e, durante o seguimento das crianças, excluir outros fatores de risco associados com o referido déficit (infecções da meninge, ouvido médio e externo). Entre as quatro (21,1%) crianças identificadas com déficit auditivo tipo neurossensorial, uma apresentava outros fatores de risco para o déficit, duas apresentaram déficit leve unilateral com pequena repercussão funcional e uma apresentou déficit bilateral moderado. As três últimas crianças nasceram assintomáticas, foram identificadas apenas pela triagem neonatal e não apresentavam nenhum outro motivo, exceto a toxoplasmose, para explicar os achados, mostrando que essa parasitose, mesmo na ausência de outras manifestações clínicas, deve ser considerada na avaliação de crianças com perda auditiva.
Estudos longitudinais com recém-nascidos acompanhados durante longos períodos apontaram para um alto índice de abstenção das mães aos retornos agendados2. Em quatro casos do presente estudo, as consultas não ocorreram com a regularidade requerida, mas todas as crianças compareceram para realizar pelo menos uma avaliação auditiva, o que pode ser atribuído ao conhecimento, por parte dos responsáveis, de que a criança apresentava um fator de risco para perda auditiva. A demora, observada em quatro crianças, para realizar a primeira avaliação auditiva pode ser atribuída ao trabalho ou doença materna, desinteresse da mãe, dificuldade no transporte da criança para o ambulatório de audiologia, não cooperação da criança com a execução do exame, entre outras. Esforços têm que ser feitos para identificar precocemente as infecções congênitas prevalentes, incluindo a toxoplasmose, facilitando o acesso precoce aos serviços de audiologia.
O tratamento prolongado (um ano) da toxoplasmose congênita tem sido associado, por alguns autores, ao melhor prognóstico das crianças15,20. Entre as quatro crianças do presente estudo, uma recebeu tratamento antiparasitário por apenas três meses (a mãe, adolescente, estava desinteressada do problema do seu filho) e outra foi tratada irregularmente por 10 meses (inconstância no comparecimento ao ambulatório); a criança mais comprometida e outra com perda unilateral leve receberam tratamento durante 12 meses.
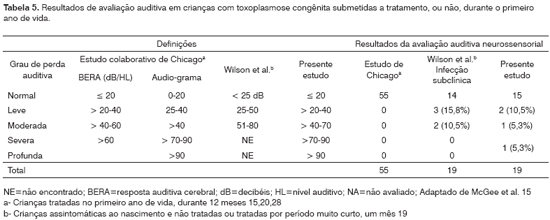
Na Tabela 5 são comparados os resultados de três estudos que abordam avaliação auditiva em crianças com toxoplasmose congênita. O estudo de Chicago15,20 avalia crianças tratadas com as drogas antiparasitárias clássicas durante 12 meses, o estudo de Wilson et al.19 descreve os achados em 19 crianças com infecção subclínica que não receberam tratamento específico ou o receberam por tempo muito curto e o presente estudo, onde dentre as 19 crianças tratadas, três o foram de forma inadequada (pouco tempo ou irregularmente) e, destas, duas apresentaram déficit auditivo.
Os resultados observados nesse estudo são similares aos encontrados por Wilson et al.19 Estudos com casuísticas maiores, submetidas a tratamento por tempo prolongado (12 meses), não identificaram a presença da hipoacusia, concluindo por um melhor prognóstico das crianças tratadas20. No presente estudo, dentre as 16 crianças tratadas adequadamente, por tempo prolongado e regularmente, duas apresentaram déficit auditivo, mas apenas uma apresentou déficit funcional importante. Essa criança nasceu gravemente afetada pela infecção, apresentou outros fatores de risco para hipoacusia além da parasitose (baixo peso de nascimento e uso de ventilação assistida por período prolongado), e desenvolveu seqüelas oculares e auditivas apesar do tratamento. A ocorrência de perda auditiva na ventilação assistida por período de tempo superior a cinco dias pode ser atribuída ao nível de ruído dos aparelhos, duração da ventilação mecânica e patologias pulmonares envolvidas5. Em relação ao peso de nascimento, embora essa criança tenha apresentado baixo peso, considera-se que o risco de hipoacusia seja maior em recém-nascidos com peso inferior a 1500g, embora não possam ser desconsideradas as condições de atenção perinatal5. Portanto, nessa criança, não podemos atribuir a perda auditiva à toxoplasmose, embora o quadro clínico apresentado por ela caracterize o comprometimento grave da doença.
Em relação à intensidade da perda auditiva e seu significado funcional, estudos têm avaliado a importância das perdas auditivas leves unilaterais ou bilaterais para o desenvolvimento das crianças e têm sugerido que essas perdas podem afetar vários domínios como habilidades de linguagem, percepção da fala, habilidades funcionais auditivas, performance acadêmica, desenvolvimento social-emocional, habilidades motoras incluindo locomoção precoce e coordenação26. Em geral, essas perdas têm sido identificadas mais tardiamente, entre 5-6 anos de idade2 e o conhecimento da existência de um fator de risco para o déficit, como a toxoplasmose, pode antecipar o acesso dessas crianças ao serviço de audiologia e, se necessário, à fonoterapia.
Estudo de coorte histórica realizado no Serviço de Infectologia Pediátrica do HCUFMG, avaliando a audiometria (PEATE) em 49 crianças com toxoplasmose congênita, em sua maioria com manifestações precoces da infecção, e seguidas, em média, durante 10,3 anos, mostrou alteração em cinco casos (10,2%) e nenhuma associação entre o tempo de tratamento no primeiro ano de vida e o déficit auditivo27. No presente estudo, o tratamento adequado de duas das crianças com perda auditiva não evitou o déficit, o que difere dos resultados de McGee et al.15 e McLeod et al.20 que relataram normalidade auditiva em crianças tratadas, mesmo quando apresentavam comprometimento neurológico e ocular. O seguimento dessas crianças pode fornecer novos dados para esclarecer essas questões.
CONCLUSÃO
Os resultados observados nesse estudo sugerem que a toxoplasmose congênita, freqüente no Brasil, é um fator de risco para hipoacusia e estudos avaliando o impacto da infecção subclínica nas perdas auditivas deve ser realizado. Diante da possibilidade da implantação de programas de triagem pré-natal ou neonatal para toxoplasmose congênita, o planejamento deve incluir a avaliação auditiva precoce dos casos identificados. A toxoplasmose, principalmente quando assintomática ao nascimento, pode estar incluída entre as causas "desconhecidas" de perda auditiva e todos os esforços devem ser envidados para identificar as crianças em risco e possibilitar o diagnóstico e tratamento precoces, que têm sido associados com prognóstico significativamente melhor20.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Joint Committee on Infant Hearing. Year 2000 position statement: principles and guidelines for early hearing detection and intervention programs. Am J Audiol. 2000;9:9-29.
2. Isaac ML, Manfredi AKS. Diagnóstico precoce da surdez na infância. Medicina (Ribeirão Preto) 2005;38(3/4):235-44.
3. Nobrega Md, Weckx LLM, Juliano Y. Study of the hearing loss in children and adolescents, comparing the periods of 1990-1994 and 1994-2000. Int J Pediatr Otorhinolaryngol 2005;69:829-38.
4. Cecatto SB, Garcia RID, Costa KS, Abdo TRT, Rezende CEB, Rapoport PB. Análise das principais etiologias de deficiência auditiva em Escola Especial "Anne Sullivan". Rev Bras Otorrinolaringol 2003;69(2):235-40.
5. Lima GML, Marba STM, Santos MFC. Hearing screening in a neonatal intensive care unit. J Pediatr (Rio J) 2006;82(2):110-4.
6. Walch C, Anderhuber W, Köle W, Berghold A. Bilateral sensorineural hearing disorders in children: etiology of deafness and evaluation of hearing tests. Int J Pediatr Otorhinolaryngol 2000;53:31-8.
7. Stagno S, Britt W. Cytomegalovirus Infections. In: Remington JS, Klein JO, Wilson CB, Baker CJ, editors. Infectious Diseases of the Fetus and Newborn Infant. 6th ed. Philadelphia: Elsevier Saunders; 2006. p. 739-81.
8. Silva AA, Maudonnet O, Panhoca R. A deficiência auditiva na infância. Retrospectiva de dez anos. ACTA AWHO 1995;14(2):72-5.
9. Cóser PL, Vilanova LCP. Rubéola materno-fetal: avaliação da perda auditiva por audiometria de tronco cerebral. Rev Bras Otorrinolaringol 1996;62(5):366-74.
10. Kadoya R, Ueda K, Miyazaki C, Hidaya Y, Tokugawa K. Incidence of congenital rubella syndrome and influence of the rubella vaccination program for schoolgirls in Japan, 1981-1989. Am J Epidemiol 1998;148(3):263-8.
11. Arvin AM, Whitley RJ, Gutierrez KM. Herpes Simplex Virus Infections. In: Remington JS, Klein JO, Wilson CB, Baker CJ, editors. Infectious Diseases of the Fetus and Newborn Infant. 6th ed. Philadelphia: Elsevier Saunders; 2006. p. 845-65.
12. Matas CG, Sansone AP, Iorio MCM, Succi RCM. Avaliação audiológica em crianças nascidas de mães soropositivas para o vírus da imunodeficiência humana. Rev Bras Otorrinolaringol 2000;66(4):317-24.
13. Wright I. Congenital toxoplasmosis and deafness. An investigation. Pract Otorhinolaryngol (Basel) 1971;33(6):377-87.
14. Kelemen G. Toxoplasmosis and Congenital Deafness. A M A Arch Otolaryngol 1958;68:547-61.
15. McGee T, Wolters C, Stein L, Kraus N, Johnson D, Boyer K, et al. Absence of sensorineural hearing loss in treated infants and children with congenital toxoplasmosis. Otolaryngol Head Neck Surg 1992;106(1):75-80.
16. Muhaimeed HA. Prevalence of sensorineural hearing loss due to toxoplasmosis in Saudi children: a hospital based study. Int J Pediatr Otorhinolaryngol 1996;34:1-8.
17. Remington JS, McLeod R, Thulliez P, Desmonts G. Toxoplasmosis. In: Remington JS, Klein JO, Wilson CB, Baker CJ, editors. Infectious Diseases of the Fetus and Newborn Infant. 6th ed. Philadelphia: Elsevier Saunders; 2006. p. 947-1091.
18. Wilson CB, Desmonts G, Couvreur J, Remington JS. Lymphocyte transformation in diagnosis of congenital Toxoplasma infection. the N Engl J Med 1980;302:785-8.
19. Wilson CB, Remington JS, Stagno S, Reynolds DW. Development of adverse sequelae in children born with subclinical congenital Toxoplasma infection. Pediatrics 1980;66(5):767-74.
20. McLeod R, Boyer K, Karrison T, Kasza K, Swisher C, Roizen N, et al. Outcome of treatment for congenital toxoplasmosis, 1981-2004: the National Collaborative Chicago-Based, Congenital Toxoplasmosis Study. Clin Infect Dis 2006;42(10):1383-94.
21. Potasman I, Davidovitch M, Tal Y, Tal J, Zelnik N, Jaffe M. Congenital toxoplasmosis: a significant cause of neurological morbidity in Israel? Clin Infect Dis 1995;20(2):259-62.
22. Lebech M, Joynson DH, Seitz HM, Thulliez P, Gilbert R, Dutton GN, et al. Classification system and case definitions of Toxoplasma gondii infection in immunocompetent pregnant women and their congenitally infected offspring. European Research Network on Congenital Toxoplasmosis. Eur J Clin Microbiol Infect Dis 1996;15:799-805.
23. McAuley J, Boyer KM, Patel D, Mets M, Swisher C, Roizen N, et al. Early and longitudinal evaluations of treated infants and children and untreated historical patients with congenital toxoplasmosis: the Chicago Collaborative Treatment Trial. Clin Infect Dis 1994;18(1):38-72.
24. Gorga MP, Kaminski JR, Beauchaine KA, Jesteadt W, Neely ST. Auditory brainstem responses from children three months to three years of age: II. Normal patterns of response. J Speech Hear Res 1989;32:281-8.
25. Azevedo MF, Pereira LD, Vilanova LCP, Goulart AL. Avaliação do processamento auditivo central: identificação de crianças em risco para alteração da linguagem e aprendizado durante o primeiro ano de vida. In: Marchesan IQ, Bolaffi C, Gomes ICD, Zorzij L, editors. Tópicos em fonoaudiologia. São Paulo: Lovise; 1995. p. 447-62.
26. Gravel JS, White KR, Johnson JL, Widen JE, Vohr BR, James M, et al. A multisite study to examine the efficacy of the Otoacoustic Emission/Automated Auditory Brainstem Response newborn hearing screening protocol: recommendations for policy, practice and research. Am J Audiol. 2005;14:S217-S28.
27. Carvalho AL. Estudo de 114 casos de toxoplasmose congênita acompanhados no setor de infectologia pediátrica do Departamento de Pediatria, FM-UFMG, no período de 1982-1996. [Dissertação (Mestrado)]. Belo Horizonte: Universidade Federal de Minas Gerais;2001.
28. McAuley J, Boyer KM, Patel D, Mets M, Swisher C, Roizen N, et al. Early and longitudinal evaluations of treated infants and children and untreated historical patients with congenital toxoplasmosis: the Chicago Collaborative Treatment Trial. Clin Infect Dis 1994;18:38-72.
1 Mestre, Professor Assistente do Depto. Pediatria da FM-UFMG, pesquisadora do NUPAD.
2 Mestre, Professora Assistente do Curso de Fonoaudiologia da FM-UFMG.
3 Doutor, Professor Adjunto do Departamento de Pediatria da FM-UFMG.
4 Doutor, Professora Adjunta do Departamento de Estatística da UFMG, pesquisadora do NUPAD.
5 Doutor, Professor Adjunto do Departamento de Parasitologia do ICB-UFMG.
6 Mestre, Professor Assistente do Departamento de Clínica Médica da FM-UFMG, pesquisador do NUPAD. Faculdade de Medicina/NUPAD/Hospital das Clínicas da Universidade Federal de Minas Gerais.
Endereço para correspondência: Gláucia Manzan Queiroz de Andrade - Rua Teodomiro Cruz 150 Bairro Novo São Lucas 30240-530 Belo Horizonte MG.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 4 de outubro de 2006. cod. 3435.
Artigo aceito em 20 de novembro de 2006.