Ano: 2007 Vol. 73 Ed. 5 - Setembro - Outubro - (5º)
Seção: Artigo Original
Páginas: 608 a 614
A prevalência de perdas auditivas em crianças e adolescentes com câncer
The prevalence of hearing loss in children and adolescents with cancer
Autor(es): Aline Medeiros da Silva 1, Maria do Rosário Dias de Oliveira Latorre 2, Lilian Maria Cristofani 3, Vicente Odone Filho 4
Palavras-chave: câncer infantil, ototoxicidade, perda de audição, quimioterapia
Keywords: childhood cancer, ototoxicity, hearing loss, chemotherapy
Resumo:
O tratamento do câncer infantil provoca diversos efeitos colaterais, como a ototoxicidade, que é capaz de lesar estruturas da orelha interna e pode levar à perda auditiva. Objetivo: Estimar a prevalência de perda auditiva em crianças e adolescentes com câncer, utilizando três classificações: American Speech-Language-Hearing Association (ASHA), Pediatric Oncology Group Toxicity (POGT) e Perda Auditiva Bilateral (PAB). Forma de Estudo: Transversal. Material e Método: Analisou-se 94 pacientes atendidos entre 2003 e 2004. Os indivíduos foram submetidos à inspeção visual do meato acústico externo e avaliação audiológica. Para caracterização da amostra utilizou-se a estatística descritiva e para a análise da concordância da perda auditiva nas três classificações foi utilizada a estatística Kappa. Resultados: Houve prevalência de perda auditiva de 42,5% pela ASHA, 40,4% pela POGT e 12,8% pela PAB. A concordância para POGT e PAB, e para PAB e ASHA foi fraca (respectivamente, k=0,36 e k=0,33). A concordância entre ASHA e POGT foi quase perfeita (k=0,96). Conclusões: A perda de audição é um efeito colateral importante nos pacientes com câncer. A monitorização auditiva é fundamental, pois possibilita detecção precoce e revisão do tratamento. Recomenda-se adotar uma classificação que contemple perdas auditivas leves, como proposta pela ASHA.
Abstract:
The treatment of cancer in children has several side effects, including ototoxicity. Inner ear structures may be affected and hearing loss may ensue. Aim: To estimate the prevalence of hearing loss in patients with cancer using the American Speech-Language-Hearing Association (ASHA), the Pediatric Oncology Group Toxicity (POGT), and the Bilateral Hearing Loss (PAB) criteria. Study design: a prospective study. Material and Methods: 94 patients admitted between 2003 and 2004 were analyzed. Visual inspection of the external auditory meatus and an audiologic evaluation were done. Descriptive statistics was used to characterize the sample, and Kappa statistics was used to investigate concordance of hearing loss in the three types of classification. Results: The prevalence of hearing loss was 42.5% using ASHA, 40.4% using POGT, and 12.8% using PAB. The concordance of hearing loss was weak for POGT and PAB (k=0.36) and for PAB and ASHA (k=0.33). The concordance between ASHA and POGT was almost perfect (k=0.96). Conclusions: Hearing loss is an important side effect of the treatment of cancer in children. Periodic audiology monitoring is recommended to detect early hearing loss and to revise the treatment if necessary. Adoption of a classification system that detects mild hearing loss (ASHA) is recommended.
![]()
INTRODUÇÃO
O aumento observado nas taxas de sobrevivência de crianças e adolescentes com tumores malignos, nas últimas duas décadas, é o resultado de tratamentos mais efetivos, incluindo a quimioterapia combinada, a melhora no diagnóstico, nas técnicas cirúrgicas e de radioterapia, no uso combinado dos diferentes recursos terapêuticos, no tratamento de suporte e no aumento da sobrevivência e da qualidade de vida1-3. No entanto, as crianças e os adolescentes portadores de câncer estão expostos aos mais diversos efeitos colaterais, principalmente quando submetidos à quimioterapia, que, apesar de ser uma das formas mais promissoras de combate ao câncer, é conhecida por provocar efeitos indesejáveis, dependendo dos agentes quimioterápicos empregados.
Os efeitos colaterais podem se manifestar mais precocemente ou a longo prazo, dependendo do tipo de tratamento e da idade da criança ao ser exposta ao mesmo. Dentre os muitos efeitos colaterais, pode-se citar a perda de audição4,5.
A ototoxicidade é definida como a reação tóxica que gera lesões nas estruturas da orelha interna, afetando o sistema auditivo e/ou vestibular e que pode levar à perda auditiva6. A ototoxicidade tem assumido um papel importante, especialmente em crianças mais jovens, visto que, geralmente, é considerada irreversível e, portanto, um sério prejuízo a longo prazo7,8.
Uma classificação comumente utilizada para avaliar perdas auditivas em clínicas fonoaudiológicas é a de Davis e Silverman (1970), citados por Russo e Santos (1993)9. Ela é baseada na determinação do grau de perda auditiva a partir da média dos limiares da via aérea nas freqüências de 500, 1000 e 2000 Hz, que são as mais importantes para a compreensão da fala, considerando-se audição normal até 25 dBNA (decibel nível de audição). Porém, esta classificação é a mesma para adultos e crianças, independente da doença e hoje é considerada de importância também a freqüência de 4000 Hz.
Segundo Haggard e Primus (1999)10, as escalas utilizadas para a classificação de perda auditiva não são semelhantes e este fato acaba por dificultar a comparação das prevalências da mesma. Existem divergências sobre qual seria a classificação mais adequada para a perda auditiva, mas o que é consenso, é que é importante adotar uma classificação de perda auditiva diferenciada para crianças. De acordo com Northern e Downs (1989)11, o limiar tonal ideal para uma criança é de 15 dB ou menos em todas as freqüências do audiograma (de 250 a 8000 Hz), diferentemente dos adultos, em que uma média de 20-25 dB é admissível.
Na avaliação da perda auditiva da criança, é importante ressaltar que mesmo pequenas perdas, que não provocariam alterações no adulto, podem interferir na aquisição e desenvolvimento de linguagem nas crianças menores. Em uma perda auditiva, mesmo transitória, situada entre 25 e 35 dBNA, a diminuição da audição não é suficiente para fazer a criança deixar de escutar, porém pode dificultar a discriminação de determinados fonemas11.
Em 1991, a American Speech-Language-Hearing Association - ASHA (Hersh e Johnson, 2003)12 propôs uma classificação de perda auditiva para as crianças. A perda auditiva é determinada segundo os diferentes graus de dificuldade para a comunicação, considerando-se audição normal entre -10 e 15 dBNA, perda auditiva discreta entre 16 e 25 dBNA, perda auditiva leve entre 26 e 40 dBNA, perda auditiva moderada entre 41 e 55 dBNA, perda auditiva moderadamente severa entre 56 e 70 dBNA, perda auditiva severa entre 71 e 90 dBNA e perda auditiva profunda acima de 90 dBNA.
Em 1994, a American Speech-Language-Hearing Association - ASHA propôs uma outra classificação especificamente para pacientes tratados com medicamentos ototóxicos, a Ototoxicity Criteria (ASHA, 1994)13. Esta classificação categoriza as perdas auditivas por meio da comparação dos resultados das avaliações audiológicas anteriores, em A (aumento do limiar em 20 dB ou mais em uma freqüência), B (aumento do limiar em 10 dB ou mais em duas freqüências consecutivas) e C (ausência de resposta em três freqüências consecutivas, as quais eram presentes nas avaliações audiológicas anteriores).
De acordo com Brock et al. (1991)8, a perda auditiva especificamente induzida pela cisplatina tem sido medida por meio de audiogramas pré e pós tratamento. Entretanto, as classificações existentes para as perdas auditivas são inapropriadas para serem aplicadas em crianças com câncer, visto que as classificações mais comuns geralmente determinam o grau de perda auditiva a partir da média dos limiares da via aérea nas freqüências de 500, 1000 e 2000 Hz (como a classificação de Davis e Silverman, 1970). Desta forma, os autores propuseram uma classificação exclusivamente para crianças tratadas com cisplatina ou outras drogas consideradas ototóxicas. Nesta classificação, as perdas auditivas são categorizadas em graus, de acordo com a freqüência que apresentou limiar tonal pior que 40 dBNA: Grau 0 (limiares auditivos menores que 40 dBNA em todas as freqüências), Grau 1 (perdas auditivas maiores ou iguais a 40 dBNA em 8000 Hz), Grau 2 (perdas auditivas maiores ou iguais a 40 dBNA em 4000 Hz e abaixo), Grau 3 (perdas auditivas maiores ou iguais a 40 dBNA em 2000 Hz e abaixo) e Grau 4 (perdas auditivas maiores ou iguais a 40 dBNA em 1000 Hz e nas freqüências menores). A classificação proposta leva em consideração que a perda auditiva maior ou igual a 40 dBNA, em qualquer freqüência, implica na perda de compreensão da fala e, quanto mais afeta as freqüências da fala, mais prejudicial é. Os autores consideram que a partir de 40 dBNA a perda foi, com certeza, devido a um agente externo - no caso, a droga ototóxica - e que em intensidades menores a perda auditiva poderia ocorrer devido a outros agentes.
Em 1999, o Pediatric Oncology Group Toxicity - POGT (Huang et al., 2002)14 desenvolveu uma classificação de perdas auditivas em crianças tratadas com agentes quimioterápicos. Esta classificação também categoriza as perdas em graus: Grau 0 (audição normal), Grau 1 (perdas auditivas entre 20 e 40 dBNA em freqüências maiores que 4000 Hz), Grau 2 (perda auditivas maiores ou iguais a 40 dBNA em freqüências maiores ou iguais a 4000 Hz), Grau 3 (perdas auditivas maiores ou iguais a 40 dBNA em freqüências maiores que 2000 Hz) e Grau 4 (perdas auditivas maiores ou iguais a 40 dBNA em 2000 Hz e abaixo). Esta classificação leva em consideração que a perda auditiva maior ou igual a 20 dBNA nas freqüências maiores que 4000 Hz já implica na perda de compreensão da fala e que, quanto mais afeta as freqüências entre 2000 Hz e abaixo, maior é o grau de dificuldade para a comunicação.
Uma outra classificação foi proposta pelo National Cancer Institute (NCI), a Common Toxicity Criteria version 2.0 (CTC) (1999)15. Esta classificação categoriza as perdas auditivas em graus de 0 a 4 de acordo com os sintomas e os resultados da avaliação audiológica: Grau 0 (audição normal), Grau 1 (perda auditiva leve sem queixas), Grau 2 (queixa de zumbido ou perda auditiva que não requer o uso de aparelho de amplificação sonora individual), Grau 3 (queixa de zumbido ou perda auditiva com necessidade de uso de aparelho de amplificação sonora individual), Grau 4 (perda auditiva severa uni ou bilateralmente). Esta classificação é a subjetiva, visto que é baseada em queixas clínicas e no julgamento da importância ou não do uso de aparelho de amplificação sonora individual, questões de difícil avaliação, principalmente em crianças com pouca idade.
Recentemente foi proposta uma outra classificação pelo National Cancer Institute (NCI), a Common Terminology Criteria for Adverse Events version 3.0 (CTCAEv3) (2003)16. Esta classificação categoriza as perdas auditivas em graus de 1 a 4, por meio da comparação dos resultados das avaliações audiológicas anteriores: Grau 1 (aumento do limiar entre 15 e 25 dB em relação ao exame audiológico inicial em duas ou mais freqüências consecutivas em pelo menos uma orelha), Grau 2 (aumento do limiar entre 25 e 90 dB em duas freqüências consecutivas), Grau 3 (perda limiar maior ou igual a 20 dB bilateralmente nas freqüências da fala, ou maior ou igual a 30 dB unilateralmente) e Grau 4 (perda suficiente para indicação de aparelho de amplificação sonora individual ou mesmo implante coclear).
Embora as classificações propostas por Brock et al. (1991)8 e pelo Pediatric Oncology Group Toxicity (POGT)14 fossem feitas para avaliar a ototoxicidade em situações específicas, todas utilizaram os limiares auditivos de acordo com a intensidade, em diferentes freqüências, e podem ser utilizadas independente do tipo de câncer infantil e tratamento. Já as demais classificações dependem de avaliação prévia ao tratamento. Não se encontrou, na literatura, estudo que comparasse e discutisse a pertinência da aplicação destas classificações. Com isso, os objetivos do presente estudo são determinar a prevalência de perda auditiva entre as crianças e adolescentes portadores de câncer, pelas classificações da American Speech-Language-Hearing Association (ASHA), da Perda Auditiva Bilateral (PAB) e do Pediatric Oncology Group Toxicity (POGT), e verificar a concordância destas três classificações no diagnóstico da perda auditiva.
MATERIAL E MÉTODO
A presente pesquisa foi desenvolvida em um instituto que é um centro de referência nacional no tratamento do câncer pediátrico e recebeu aprovação do Comitê de Ética em Pesquisa da Faculdade de Saúde Pública da USP, protocolo n° 1186 e da Comissão de Ética para Análise de Projetos de Pesquisa - CAPPesq da Diretoria Clínica do Hospital das Clínicas da Faculdade de Medicina da USP, protocolo n° 104/06.
Após levantamento nas fichas de atendimento, verificou-se que foram atendidos 325 casos novos em 2003 e 342 em 2004. Dentre estes, a maior parte (469 crianças = 70,3%) não teve confirmado o diagnóstico de câncer e foi encaminhada para outra unidade específica de atendimento.
Portanto, foram selecionados para esta pesquisa 87 casos novos atendidos em 2003 e 111 casos novos atendidos em 2004, totalizando 198 pacientes. Destes, 44 (22,2%) foram a óbito e 12 (6,1%) foram transferidos para outros centros de tratamento localizados em outras cidades/capitais, restando 142 pacientes. Como a avaliação audiológica pré-tratamento não é feita de rotina neste instituto, estes pacientes não puderam ser incluídos neste estudo.
Primeiramente, foi feito um levantamento no prontuário médico dos pacientes, para preenchimento do formulário e, posteriormente, foram agendados o dia e a hora para a realização do exame audiológico.
Dentre os 142 pacientes, foi possível realizar o exame audiológico de 94 pacientes.
O exame audiológico
Inicialmente foi realizada a anamnese com o propósito de investigar a possibilidade de qualquer sintoma ou queixa auditiva. Posteriormente, foi feita a inspeção visual do meato acústico externo com o uso do otoscópio, com o objetivo de verificar a presença de rolha de cerume ou qualquer outra ocorrência que pudesse impedir a realização dos exames audiológicos. Caso fosse verificada a presença de rolha de cerume, o paciente era encaminhado para o médico otorrinolaringologista e, somente após a conduta médica, o exame era feito.
Em seguida, foi realizada a avaliação dos limiares auditivos utilizando-se procedimentos de resposta condicionada (por meio da audiometria com reforço visual (crianças até 2 anos), audiometria lúdica condicionada (crianças entre 2 e 5 anos) ou audiometria tonal liminar (acima de 5 anos)), com a finalidade de determinar o limiar auditivo. Este exame foi realizado em cabina acústica utilizando o audiômetro Maico MA-41 com fones TDH-39 devidamente calibrados conforme os padrões, nas freqüências de 250 a 8000 Hz e, por via óssea, nas freqüências de 500 a 4000 Hz, sempre que necessário para a confirmação dos achados. Posteriormente foram realizadas a timpanometria e a pesquisa dos reflexos acústicos utilizando o imitanciômetro da marca Danplex ZA-28. Todos estes exames foram realizados por uma única fonoaudióloga (AMS).
Para a definição de perda auditiva foram utilizadas três classificações: American Speech-Language-Hearing Association (ASHA), Perda Auditiva Bilateral (PAB) e Pediatric Oncology Group Toxicity (POGT).
Na análise estatística foi feita a caracterização da amostra por meio de estatística descritiva (média, desvio-padrão, mediana e proporções) e foi analisada a concordância das três classificações no diagnóstico de perda auditiva, por meio da estatística Kappa. Em todas as análises estatísticas adotou-se o nível de significância de 5%.
O programa Epi Info versão 6.04 para DOS foi utilizado para a dupla digitação da base de dados e consistência dos mesmos e o programa SPSS versão 12.0 para Windows foi utilizado para as análises estatísticas.
A avaliação audiológica não envolveu nenhum procedimento invasivo e todos os responsáveis assinaram o termo de consentimento livre e esclarecido. Ao final do exame os resultados da avaliação audiológica foram apresentados para os responsáveis.
RESULTADOS
O sexo masculino foi representado por pouco mais da metade dos sujeitos (52,1%). A cor da pele branca foi a que apresentou maior freqüência (83,0%), seguida da cor parda/mulata (11,7%). A idade ao diagnóstico variou de 0 a 18 anos (média de 6,8 anos; desvio padrão de 4,9 anos; mediana de 5,6 anos), sendo que menos da metade dos pacientes foram diagnosticados antes dos 5 anos (45,7%). A idade atual variou de 1 a 18 anos (média de 8,6 anos; desvio padrão de 4,8 anos; mediana de 7,4 anos) e a faixa etária mais freqüente foi entre 5 e 9 anos (38,3%), seguida pela faixa de 10 anos e mais (36,2%).
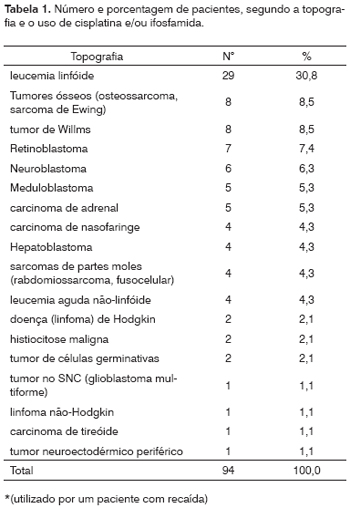
O diagnóstico mais freqüente foi de leucemia linfóide (30,8%), seguido pelo grupo de tumores ósseos (8,5%) e tumor de Willms (8,5%) (Tabela 1). O uso de cisplatina e/ou ifosfamida foi feito por pacientes com diagnóstico de leucemia linfóide, tumores ósseos, neuroblastoma, meduloblastoma, carcinoma de adrenal, carcinoma de nasofaringe, hepatoblastoma, sarcoma de partes moles, linfoma de Hodgkin, tumor de células germinativas-feminino, tumor de células germinativas-masculino e tumor neuroectodérmico periférico. Os pacientes com diagnóstico de tumor de Willms, retinoblastoma, leucemia aguda não-linfóide, histiocitose maligna, tumor no SNC, linfoma não-Hodgkin e carcinoma de tireóide não utilizaram estas drogas.
Dos 94 pacientes, 38 (40,4%) apresentaram sintomas de dor no corpo ao diagnóstico, seguido por febre (34,0%) e aumento de volume de massa corporal (31,9%). O sintoma menos apresentado foi alteração motora (3,2%), citado apenas por três pacientes.
Entre os 94 pacientes, 67 (71,3%) estavam vivos sem tratamento químio ou radioterápico na data da última consulta registrada nos prontuários médicos e 27 (28,7%) estavam vivos em fase de tratamento.
A Tabela 2 descreve o uso de medicamentos nos pacientes. A cisplatina, droga considerada altamente ototóxica, foi administrada em 21 pacientes (22,3%), com dose individual média de 78,09 mg/m² (desvio padrão = 32,69 mg/m²), dose individual máxima de 140 mg/m², dose cumulativa máxima de 1120 mg/m² e média do número de ciclos de 4,24 (desvio padrão = 1,55 ciclos).
A carboplatina, droga análoga à cisplatina, mas considerada como de menor potencial ototóxico, foi administrada em 21 pacientes (22,3%), com dose individual média de 330,75 mg/m² (desvio padrão = 208,21 mg/m²), dose individual máxima de 775 mg/m², dose cumulativa máxima de 4500 mg/m² e média do número de ciclos de 4,14 (desvio padrão = 2,82 ciclos).
A queixa auditiva mais citada foi a otite (22,3%), seguida de otalgia (16,0%), tontura (16,0%), dificuldade de audição (14,9%) e infecção de vias aéreas superiores (13,8%).
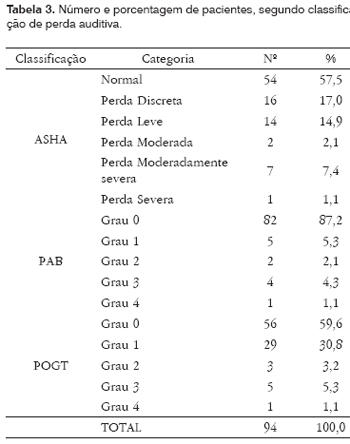
A Tabela 3 mostra a classificação das perdas auditivas de acordo com as três diferentes classificações. Observa-se que, de acordo com a classificação proposta pela ASHA, 54 (57,5%) pacientes apresentaram limiares auditivos dentro da normalidade e 40 (42,5%) apresentaram algum grau de perda auditiva. Já considerando a classificação PAB, 82 (87,2%) pacientes obtiveram limiares auditivos classificados em Grau 0 e 12 (12,8%) pacientes com algum grau de perda auditiva. Por último, considerando a classificação proposta pelo POGT, apenas 56 (59,6%) pacientes apresentaram Grau 0 e 38 (40,4%) apresentaram algum grau de perda auditiva, ou seja, resultado semelhante ao encontrado utilizando-se a classificação proposta pela ASHA.
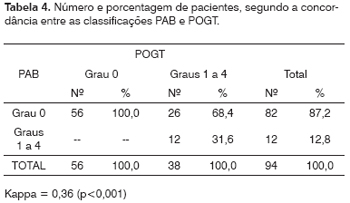
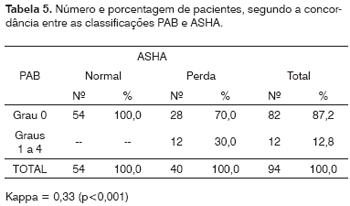
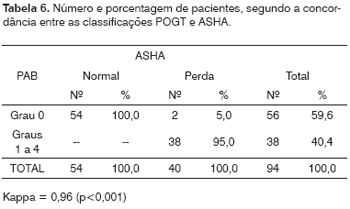
A concordância no diagnóstico de perda auditiva pelas classificações POGT e PAB foi fraca (Kappa = 0,36; p <0,001; Tabela 4), o mesmo ocorrendo para a PAB em relação à ASHA (Kappa = 0,33; p<0,001; Tabela 5). Já a concordância entre as classificações ASHA e POGT foi quase perfeita (Kappa = 0,96; p<0,001; Tabela 6).
DISCUSSÃO
Um dos primeiros aspectos a ser destacado é no que diz respeito à realização da avaliação auditiva. O instituto no qual este estudo foi desenvolvido não possui um setor de fonoaudiologia, nem voltado para a área de terapia de fala e linguagem, nem para a área de audiologia. Esta não é uma particularidade deste instituto, pois no Brasil ainda não existe uma prática comum nos centros de tratamento do câncer infantil para monitoramento da audição voltado a estes pacientes. Com isso, recomenda-se que haja uma preocupação das autoridades na área do câncer para a instalação de serviços de fonoaudiologia que possam fazer o acompanhamento não só das crianças e adolescentes com câncer, mas de outras doenças que podem levar a comprometimentos auditivos.
Na análise de prevalência de perda auditiva utilizando a classificação ASHA, encontrou-se 42,5% dos pacientes avaliados com perda de audição entre discreta e severa. Não se encontrou, na literatura, nenhum estudo que tivesse utilizado a classificação ASHA. É importante destacar que esta classificação é a mais rigorosa entre as classificações adotadas. Os pacientes que apresentaram limiar auditivo, em qualquer freqüência, maior que 15 dBNA foram analisados como portadores de perda auditiva. Esta classificação teve concordância muito grande com a classificação POGT (Kappa=0,96), sendo que a única diferença foi a classificação de dois pacientes como Grau 0 pela POGT, mas que foram considerados como tendo perda discreta em freqüências menores que 4000 Hz pela classificação ASHA.
A grande concordância no diagnóstico de perda auditiva entre as classificações ASHA e POGT deveu-se ao limiar adotado como ponto de corte para determinar a perda de audição (15 dBNA para ASHA e 20 dBNA para POGT).
Quando foi utilizada a classificação POGT para categorizar as perdas auditivas, 40,4% dos pacientes avaliados apresentaram perda auditiva entre os Graus 1 e 4. Entre os estudos que utilizaram esta classificação, o de Marina et al. (2005)17 com 24 pacientes com tumores de células germinativas, tratados com cisplatina, encontrou 75% de pacientes com perda auditiva entre os Graus 2 e 4. No estudo desenvolvido por Ruiz et al. (1989)18, os pesquisadores adotaram o limiar maior ou igual a 20 dBNA para classificar a perda auditiva e 100% dos seus pacientes tratados com cisplatina apresentaram perda de audição.
Na classificação PAB, apenas limiares iguais ou superiores a 40 dBNA são classificados como perda auditiva. Desta forma, a freqüência de pacientes com audição alterada, utilizando esta classificação, é bem menor quando comparada aos outros dois. A concordância da classificação PAB com a classificação ASHA foi fraca (Kappa=0,33), o mesmo acontecendo com a classificação POGT (Kappa=0,36).
Quando foi utilizada a classificação PAB, 12,8% dos pacientes avaliados apresentaram perda auditiva entre os Graus 1 e 4. Como esta classificação só considera perda auditiva a partir de 40 dBNA, as perdas auditivas discretas ou leves pela classificação ASHA são categorizadas como Grau 0 na PAB.
No estudo de Skinner et al. (1990)7 com 22 crianças e adolescentes diagnosticados com tumores sólidos e tratados com cisplatina, 73% apresentaram perda auditiva. Brock et al. (1991)8 encontraram perda de audição em 48% das 29 crianças com diagnósticos diversos, tratadas com cisplatina.
Outros estudos adotaram o limiar maior ou igual a 25 dBNA em qualquer freqüência entre 250 e 8000 Hz como classificação para perda auditiva. A porcentagem de perdas variou entre 43% e 81%2,19-21.
Allen et al. (1998)20 realizaram um estudo retrospectivo com 11 crianças menores de 18 anos que receberam cisplatina durante o tratamento quimioterápico entre 1985 e 1994. Encontraram presença de perda auditiva entre 25 e 90 dBNA em 81% das crianças. Porcentagem semelhante foi encontrada no presente estudo (83%), quando comparada à classificação POGT (a mais próxima para o ponto de corte em 25 dBNA).
Outra forma adotada para analisar e classificar a perda auditiva foi por meio da comparação dos limiares de audibilidade entre a avaliação audiológica antes do início e após o término do tratamento. Estudos que adotaram o aumento do limiar em qualquer freqüência maior ou igual a 10 dBNA quando comparado com a avaliação audiológica anterior, encontraram entre 77% e 88% de perda auditiva nos pacientes avaliados22,23. Já no estudo realizado por Berg et al. (1999)24, a perda auditiva ocorreu em apenas 26% das crianças avaliadas.
Outros estudos não relataram qual foi a classificação adotada para categorizar a perda de audição, e a porcentagem de perdas auditivas variou entre 7% e 42%25-27.
Com isso, verifica-se que a comparação das perdas auditivas em crianças e adolescentes com câncer é muito prejudicada - antes de tudo - pela utilização de critérios mais ou menos rigorosos de avaliação auditiva.
Smits et al. (2006)28 salientam que perdas auditivas, mesmo quando leves, se não forem detectadas a tempo, podem levar a conseqüências a longo prazo. O diagnóstico de perda auditiva nos pacientes tratados contra o câncer é de fundamental importância, pois pode preservar sua capacidade de comunicação e evitar que, uma vez recuperados do câncer, fiquem sem capacidade de retornar à vida normal, em função de seqüelas do tratamento29.
Cabe ressaltar aqui que a adoção de classificações mais rigorosas, como a proposta pela American Speech-Language-Hearing Association - ASHA, para a perda de audição em crianças é fundamental, visto que para uma comunicação plena, a criança deve ter condições de ouvir, identificar e discriminar todos os sons da fala. A redução na audibilidade, mesmo leve, compromete o desenvolvimento destas habilidades, prejudicando a compreensão e, desta forma, a comunicação oral, podendo levar a problemas emocionais, comportamentais e escolares.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Garrè ML, Gandus S, Cesana B, Haupt R, De Bernardi B, Comelli A, et al. Health status of long-term survivors after cancer in childhood. Am J Pediatr Hematol Oncol 1994;16(2):143-52.
2. Ilveskoski I, Saarinen UM, Wiklund T, Perkkiö M, Salmi TT, Lanning M, et al. Ototoxicity in children with malignant brain tumors treated with the "8 in 1" chemotherapy protocol. Med Pediatr Oncol 1996;27:26-31.
3. Mirra AP, Latorre MRDO, Veneziano DB. Incidência, mortalidade e sobrevida do câncer da infância no município de São Paulo. Registro de Câncer de São Paulo; 2004. p.1-3.
4. Camargo B, Lopes LF, Novaes PE. O tratamento multidisciplinar das neoplasias na infância. In: Camargo B, Lopes LF, organizadores. Pediatria oncológica: noções fundamentais para o pediatra. São Paulo: Lemar; 2000. p.215-29.
5. Lopes LF, Camargo B, Bianchi A. Os efeitos tardios do tratamento do câncer infantil. Rev Ass Med Brasil 2000;46(3):277-84.
6. Oliveira JAA. Ototoxicidade. In: Costa SS, Cruz OLM, Oliveira JAA, organizadores. Otorrinolaringologia. Porto Alegre: Artes Médicas Sul; 1994. p. 215-21.
7. Skinner R, Pearson ADJ, Amineddine HA, Mathias DB, Craft AW. Ototoxicity of cisplatinum in children and adolescents. Br J Cancer 1990;61:927-31.
8. Brock PR, Bellman SC, Yeomans EC, Pinkerton CR, Pritchard J. Cisplatin ototoxicity in children: a practical grading system. Med Pediatr Oncol 1991;19:295-300.
9. Russo ICP, Santos TMM. Caracterização audiológica das principais patologias do ouvido. In: Russo ICP, Santos TMM. A Prática da Audiologia Clínica. São Paulo: Cortez; 1993. p.213-53.
10. Haggard RS, Primus MA. Parental perceptions of hearing loss classification in children. Am J Audiol 1999;8:1-10.
11. Northern JL, Downs MP. Audição em crianças. São Paulo: Manole; 1989.
12. Hersh MA, Johnson MA. Anatomy and physiology of hearing, hearing impairment and treatment. In: Hersh MA, Johnson MA, organizadores. Assistive technology for the hearing-impaired, deaf and deafblind. London: Springer; 2003.p.1-39.
13. American Speech-Language-Hearing Association. Guidelines for the audiologic management of individuals receiving cochleotoxic drug therapy. ASHA. 1994;36(12):11-9.
14. Huang E, Teh BS, Strother DR. intensity-modulated radiation therapy for pediatric medulloblastoma: early report on the reduction of ototoxicity. Int J Radiat Oncol Biol Phys 2002;52(3):599-605.
15. Common toxicity criteria version 2.0 - CTC; 1999. DCTD, NCI, NIH, DHHS [Site na internet]. Disponível em: http://ctep.cancer.gov. Acessado em 23 de agosto de 2005.
16. Common terminology criteria for adverse events version 3.0 - CTCAE; 2003. DCTD, NCI, NIH, DHHS [Site na internet]. Disponível em: http://ctep.cancer.gov. Acessado em 12 de dezembro de 2005.
17. Marina N, Chang KW, Malogolowkin M, London WB, Frazier AL, Womer RB et al. Amifostine does not protect against the ototoxicity of high-dose cisplatin combined with etoposide and bleomycin in pediatric germ-cell tumors. Cancer 2005;104(4):841-47.
18. Ruiz L, Gilden J, Jaffe N, Robertson R, Wang YM. Auditory function in pediatric osteosarcoma patients treated with multiple doses of cis-diamminedichloroplatinum (II). Cancer Res 1989;49:742-44.
19. Kretschmar CS, Warren MP, Lavally BL, Dyer S, Tarbell N. Ototoxicity of preradiation cisplatin for children with central nervous system tumors. J Clin Oncol 1990;8(7):1191-98.
20. Allen GC, Tiu C, Koike K, Ritchey K, Kurs-Lasky M, Wax MK. Transient-evoked otoacoustic emissions in children after cisplatin chemotherapy. Otolaryngol Head Neck Surg 1998;1118(5):584-88.
21. Garcia AP, Iório MCM, Petrilli AS. Monitoramento da audição de pacientes expostos à cisplatina. Rev Bras Otorrinolaringol 2003;69(2):215-21.
22. McHaney VA, Thibadoux G, Hayes FA, Green AA. Hearing loss in children receiving cisplatin chemotherapy. J Pediatr 1983;102(2):314-17.
23. Pasic TR, Dobie RA. Cis-platinum ototoxicity in children. Laryngoscope 1991;101:985-91.
24. Berg AL, Spitzer JB, Garvin Junior JH. Ototoxic impact of cisplatin in pediatric oncology patients. Laryngoscope 1999;109:1806-14.
25. Fromm M, Littman P, Raney B, Nelson L, Handler S, Diamond G et al. Late effects after treatment of twenty children with soft tissue sarcomas of the head and neck: experience at a single institution with a review of the literature. Cancer 1986;57:2070-76.
26. Paulino AC, Simon JH, Zhen W, Wen BC. Long-term effects in children treated with radiotherapy for head and neck rhabdomyosarcoma. Int J Radiat Oncol Biol Phys 2000;48(5):1489-95.
27. Skowronska-Gardas A, Pedziwiatr K, Chojnacka M. Evaluation of quality of life in long-term survivors of paediatric brain stem tumors, treated with radiotherapy. Radiother Oncol 2004;70:269-73.
28. Smits C, Swen SJ, Goverts ST, Moll AC, Imhof SM, Meeteren AYNS. Assessment of hearing in very young children receiving carboplatin for retinoblastoma. Eur J Cancer 2006;42:492-500.
29. Pedalini MEB, Toniosso S, Goffi MVS. O papel do audiologista no tratamento do paciente com câncer. In: Barros APB, Arakawa L, Tonini MD, Carvalho VA, organizadoras. Fonoaudiologia em Cancerologia. São Paulo: Fundação Oncocentro de São Paulo; 2000. p.105-9.
1 Mestranda em Saúde Pública, Fonoaudióloga, mestranda do Programa de Pós-Graduação em Saúde Pública da Faculdade de Saúde Pública da USP.
2 Livre-docente pela Faculdade de Saúde Pública da USP, Professora Titular do Departamento de Epidemiologia da Faculdade de Saúde Pública da USP.
3 Doutora em Pediatria pela Faculdade de Medicina da USP, Assistente-doutora do Instituto de Tratamento do Câncer Infantil, ITACI. Do Hospital das Clínicas da Faculdade de Medicina da USP.
4 Livre-docente pela Faculdade de Medicina da USP, Chefe do Instituto de Tratamento do Câncer Infantil, ITACI. Do Hospital das Clínicas da Faculdade de Medicina da USP.
Faculdade de Saúde Pública da Universidade de São Paulo.
Endereço para correspondência: Aline Medeiros da Silva - Avenida Dr. Arnaldo 715 Departamento de Epidemiologia FSP/USP 01246-904 São Paulo SP.
Tel. (0xx11) 3061-7744 (0xx11) 8365-3966 - E-mail: alinems@usp.br
FAPESP - Fundação de Amparo a Pesquisa do Estado de São Paulo.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 26 de junho de 2006. cod.2247
Artigo aceito em 12 de outubro de 2006.