Ano: 2007 Vol. 73 Ed. 3 - Maio - Junho - (3º)
Seção: Artigo Original
Páginas: 299 a 307
Zonas mortas na cóclea em freqüências altas: implicações no processo de adaptação de prótese auditivas
Dead regions in the cochlea at high frequencies: implications for the adaptation to hearing aids
Autor(es): Angela Gordo 1, Maria Cecília Martinelli Iório 2
Palavras-chave: audiometria de fala, auto-avaliação, auxiliares de audição, perda auditiva neurossensorial.
Keywords: speech perception, self-assessment, hearing aids, sensorineural hearing loss.
Resumo:
Em perdas auditivas de grau moderado a severo nas freqüências altas, a lesão coclear pode estar relacionada a "zonas mortas", regiões onde as células ciliadas internas e/ou neurônios adjacentes não são funcionais. Objetivo: Avaliar o reconhecimento de fala em pacientes com e sem zonas mortas na cóclea em freqüências altas. Material e Método: Estudo clínico e experimental de 30 indivíduos adultos, distribuídos em dois grupos: grupo 1 - 15 indivíduos sem zonas mortas, e grupo 2 - 15 com zonas mortas na cóclea. Os pacientes foram submetidos à pesquisa do índice de reconhecimento de fala, limiar de reconhecimento de sentenças, sem e com ruído competitivo. Os testes de fala foram realizados sem prótese, com próteses auditivas amplificando a faixa de freqüências de 100 a 8000 Hz (programa 1) e com amplificação restrita, 100 a 2560 Hz (programa 2). Resultados: O grupo 1 apresentou melhor desempenho utilizando as próteses auditivas no programa 1. Já o grupo 2 obteve melhor desempenho com o programa 2. Conclusões: Pacientes sem zonas mortas na cóclea obtêm maior benefício com a amplificação em freqüências altas. Na presença de zonas mortas em freqüências altas, o melhor desempenho é obtido com a amplificação restrita nestas freqüências.
Abstract:
In patients with moderate to severe high-frequency hearing loss, cochlear damage may include "dead regions" where there are no functional inner hair cells and/or associated neurons. Aim: This study examines speech recognition in sensorineural impaired hearing patients with and without cochlear dead regions at high frequencies. Methods: a clinical and experimental study was made of thirty patients with sensorineural hearing loss that were classified into two groups: group 1 - included 15 subjects with hearing loss and no dead regions; and group 2 - included 15 subjects with dead regions in the cochlea at high frequencies. Patients undertook word recognition score and speech reception threshold tests, with and without background noise. The speech tests were done with and without hearing aids in two situations: program 1 - broadband amplification (bandwidth 8000 Hz); and program 2 - amplification up to 2560 Hz, without high frequency gain. Results: For subjects with no dead regions in the cochlea (group 1) performance improved with program 1. For subjects with dead regions in the cochlea (group 2) performance improved with program 2. Conclusions: Subjects with no dead regions in the cochlea benefited from high-frequency information. Subjects with dead regions in the cochlea benefited from reduced gain at high frequencies.
![]()
INTRODUÇÃO
A deficiência auditiva neurossensorial descendente constitui o tipo e a configuração de perda auditiva mais comum na clínica audiológica, relacionada à dificuldade para compreender a fala em ambientes ruidosos. Embora as próteses auditivas possam aumentar a informação acústica disponível, nem sempre há uma melhora satisfatória no reconhecimento de fala. Alguns pacientes apresentam pouco ou nenhum benefício com a amplificação, especialmente nos casos de perda auditiva descendente, sendo o grau severo nas freqüências altas.
A relação entre a ausência de benefício com o uso de próteses auditivas e a redução funcional ou perda completa das células ciliadas internas e/ou neurônios em certas regiões da cóclea representa um conceito bastante antigo. Porém, nenhum teste clínico era realizado para a identificação de "zonas mortas na cóclea".
Nessas regiões, a informação gerada pela vibração da membrana basilar não é transmitida ao sistema nervoso central, entretanto, um tom com freqüência correspondente à zona morta pode ser detectado, se for suficientemente intenso, via propagação apical ou basal do padrão de vibração, em outras regiões funcionais da cóclea. A amplitude de vibração da membrana basilar em um local distante será menor do que a amplitude na zona morta. Assim, um ruído de banda larga poderia mascarar aquele tom de maneira muito mais efetiva do que o esperado, pois o ruído precisa eliminar apenas a resposta proveniente do local remoto. Se o limiar para detectar um tom na presença de um ruído de banda larga é acentuadamente maior do que o normal, esta alteração indica a falta de células ciliadas internas e/ou neurônios adjacentes com freqüência característica correspondente à freqüência do tom, ou seja, uma zona morta1.
Alguns estudos relacionam a dificuldade imposta pela deficiência auditiva no reconhecimento de fala à necessidade de ouvi-la em níveis intensos de pressão sonora, nos quais mesmo a cóclea normal sofre diminuição de sua capacidade analítica. Conforme aumenta o grau da perda, algumas freqüências não contribuem ou até mesmo reduzem a informação disponível em outras. Assim, menos amplificação deveria ser prescrita para as freqüências em que os limiares auditivos são mais elevados2,5.
A resolução auditiva refere-se à habilidade das estruturas da orelha interna e seus sistemas neurais associados de gerar padrões de atividade neural que reflitam as diferenças espectrais e temporais entre as informações sonoras. O nervo auditivo é organizado, como ocorre com a membrana basilar: as fibras com freqüências características altas vêm de células ciliadas da base da cóclea, enquanto as que possuem freqüências baixas suprem o ápice. As fibras associadas à região basal respondem de maneira sincronizada à apresentação do estímulo. As fibras que se originam do ápice serão ativadas mais tarde (2 a 4ms depois). Aquelas que são ativadas simultaneamente darão maior contribuição ao potencial de ação de todo o nervo. Conseqüentemente, este potencial reflete principalmente a resposta das fibras de alta freqüência3.
Outros autores4 propõem um teste clínico para a identificação de zonas mortas na cóclea, denominado TEN (Threshold Equalizing Noise - ruído de equalização dos limiares), no qual são comparados os limiares auditivos pesquisados sem e com a presença de mascaramento ipsilateral. O nível do ruído TEN, com espectro elaborado para a obtenção de limiares igualmente mascarados em todas as freqüências (de 125 Hz a 15000 Hz) é expresso em ERB (Equivalent Rectangular Bandwidth), referindo-se à largura de banda do filtro auditivo. Ouvintes normais apresentam uma variação pequena (2 dB a 3 dB) entre os limiares mascarados e o nível do ruído. Em indivíduos com perda auditiva neurossensorial, as zonas mortas na cóclea são identificadas quando os limiares mascarados estão no mínimo 10 dB acima dos limiares absolutos e 10 dB acima do nível do ruído. Estes resultados são confirmados através da medida psicofísica das curvas de sintonia. Quando o teste TEN é positivo, há também um deslocamento no pico da curva de sintonia em relação à freqüência do sinal apresentado. Os autores ressaltam que na presença de zonas mortas, poderia ser benéfico fornecer amplificação em uma faixa de freqüências levemente acima da zona morta, porém o mais importante seria fornecer amplificação onde as células ciliadas pudessem aproveitá-la.
A efetividade da audição para a inteligibilidade é afetada pelo nível de pressão sonora do sinal (nível de distorção), grau da perda auditiva, freqüências nas quais ela ocorre e pela habilidade no processamento das informações sonoras5. Conforme aumentam os limiares, a eficiência auditiva diminui, sendo este efeito mais acentuado no caso de perdas em freqüências altas. A implicação prática deste conceito para a adaptação de próteses auditivas é fornecer maior amplificação onde os limiares estão menos comprometidos.
Com base nessas considerações, o objetivo desta pesquisa é verificar o benefício da amplificação de freqüências altas para o reconhecimento de fala em pacientes com deficiência auditiva neurossensorial descendente, associada ou não à presença de zonas mortas na cóclea.
MÉTODOS
Os procedimentos utilizados neste estudo foram descritos para o Comitê de Ética em Pesquisa e aprovados sob o código nº 0235/04. Os participantes assinaram um termo de consentimento livre e esclarecido, com as informações necessárias, antes de se submeterem aos testes. Foram avaliados 30 indivíduos, sendo 14 do sexo feminino e 16 do sexo masculino, com deficiência auditiva neurossensorial, de configuração audiométrica descendente, bilateral e simétrica. A identificação de zona morta na cóclea foi realizada por meio do teste TEN(NA)6, versão 2004. De acordo com os resultados, foram constituídos dois grupos: grupo 1 - 15 indivíduos sem zonas mortas na cóclea e grupo 2 - 15 indivíduos com zonas mortas em freqüências altas.
Apresentamos nas Tabelas 1 e 2 a distribuição da população estudada quanto ao sexo, idade, queixa e sua duração e uso de próteses auditivas (se usuário - há quanto tempo - ou em processo de seleção e adaptação), nos grupos 1 e 2 respectivamente.
O teste TEN foi aplicado por meio de um audiômetro de dois canais, para controlar separadamente o estímulo (tom puro) e o ruído, conectado a um CD Player. Os limiares auditivos nas freqüências de 500, 750, 1000, 1500, 2000, 3000 e 4000 Hz, em cada orelha separadamente, por meio de fones TDH49, foram determinados em intervalos de 2 em 2 dB, inicialmente sem mascaramento e, em seguida, com a presença do ruído ipsilateral TEN, a 70 dB NA/ERB. Caso este nível fosse insuficiente para mascarar o limiar absoluto, aumentamos gradualmente a intensidade até 85 dB NA/ERB (nível máximo de ruído tolerado pelos nossos pacientes). Quando o limiar mascarado foi 10 dB ou mais acima do limiar absoluto e do nível de ruído, consideramos o resultado sugestivo de zona morta para a freqüência testada.
Em seguida, realizamos os testes de reconhecimento de fala, com e sem ruído competitivo, apresentando os estímulos em uma sala acusticamente tratada, no mesmo alto-falante, com o indivíduo posicionado de frente para o alto-falante, a uma distância de 1m, a 0º azimute.
A fim de observar o desempenho segundo as características do sinal amplificado, utilizamos a prótese auditiva retroauricular digital Signia HdO+, da marca Siemens, com oito canais independentes de programação, relacionados a diferentes faixas de freqüências. A adaptação das próteses foi binaural em todos os participantes. Estabelecemos duas programações: programa 1, com amplificação em ampla faixa de freqüências (de 100 Hz a 8000 Hz) e programa 2, evitando o ganho em freqüências altas (a partir de 2560 Hz). A seleção da freqüência de corte para o programa 2, aproximadamente 2000 Hz, foi baseada em pesquisas que relatam benefício para a amplificação em até 1,7 vezes a freqüência limite (aproximadamente uma oitava acima) da zona morta na cóclea7. Apesar de esta medida não ter sido realizada com precisão em nosso estudo, os resultados foram positivos para zonas mortas iniciando entre 1000 e 1500 Hz na maioria dos casos.
O material de fala usado na pesquisa do Índice Percentual de Reconhecimento de Fala (IPRF) foi a lista de 25 monossílabos foneticamente balanceados8, gravados em quatro seqüências diferentes. O IPRF foi avaliado sem e com ruído competitivo (speech noise). Sem prótese auditiva, a intensidade da fala foi a mais confortável referida pelo paciente. Com próteses auditivas, a fala e o ruído foram fixados em 65 dB A. Posteriormente, pesquisamos o Limiar de Reconhecimento de Sentenças no Silêncio (LRSS) e na presença de ruído (LRSR), utilizando cinco listas com 10 sentenças foneticamente balanceadas9. Na pesquisa do LRSS, apresentamos a primeira sentença usando o limiar de reconhecimento de fala obtido com fones na melhor orelha. Quanto ao LRSR, fixamos o ruído em 65 dB A e apresentamos a primeira sentença sempre em uma relação S/R igual a zero. Ambos os testes (IPRF e LRS) foram pesquisados em três condições diferentes: sem prótese, com próteses auditivas no programa 1 e no programa 2, alternando a seqüência dos procedimentos e as listas selecionadas em cada apresentação.
Finalizando, aplicamos o questionário APHAB (Abbreviated Profile of Hearing Aid Benefit)10, para avaliar as dificuldades de comunicação em situações cotidianas. Este questionário é composto por 24 itens relativos a três categorias de comunicação, segundo o ambiente acústico, e uma categoria relativa ao desconforto para sons intensos, a saber: facilidade de comunicação, ambiente reverberante, ruído ambiental e sons aversivos. Em nosso estudo, como nem todos os pacientes eram usuários de próteses auditivas, utilizamos apenas as respostas para a condição sem prótese. Os participantes atribuíram para cada item a opção que melhor representasse a freqüência com que eles experimentavam na situação apresentada: A-sempre (99%); B-quase sempre (87%); C-geralmente (75%); D-(50%); E-às vezes (25%); F-raramente (12%); G-nunca (1%). Os resultados foram quantificados para obtenção da pontuação em cada categoria.
Em nosso estudo, utilizamos testes não-paramétricos de comparação para a análise estatística dos resultados. Devido ao fato de a amostragem ser relativamente pequena, definimos o nível de significância em 0,07 (7%).
RESULTADOS
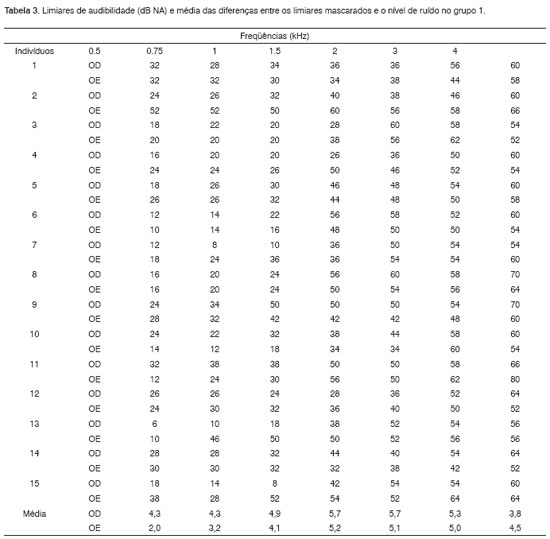
Em todos os pacientes, os limiares mascarados não excederam em 10 dB o nível de ruído utilizado (de 70 a 85 dB NA/ERB), sendo a diferença máxima de 6 dB NA entre eles. De maneira geral, apenas um nível de ruído foi suficiente para a aplicação do teste TEN(NA): 70 dB NA/ERB. Quando o limiar audiométrico era maior do que 60 dB em uma determinada freqüência, utilizamos 10 dB acima deste limiar para estabelecer o nível mínimo de mascaramento.
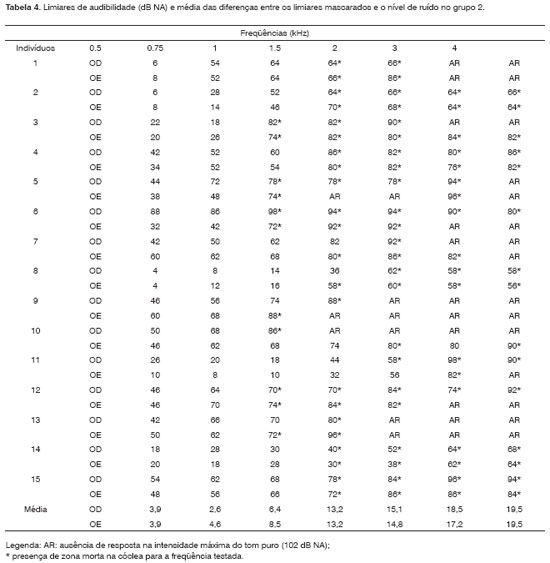
No grupo 2, quando os limiares de audibilidade obtidos sob mascaramento com o teste TEN(NA) excederam em 10 dB ou mais os limiares absolutos e o nível de ruído, consideramos o resultado positivo para zonas mortas na cóclea, observadas em freqüências altas. Devido ao grau da perda auditiva nestas freqüências, utilizamos dois ou três níveis de ruído. Vários pacientes apresentaram mudança de 10 dB ou mais em relação ao limiar absoluto quando o nível de ruído estava abaixo deste limiar, ou seja, com uma intensidade de mascaramento teoricamente insuficiente para alterar o limiar.
m indivíduos sem zonas mortas na cóclea observamos que o IPRF, tanto no silêncio quanto na presença de ruído, apresentou melhora significante com o programa 1 em relação às condições sem prótese e com próteses auditivas no programa 2.
Na presença de zonas mortas na cóclea, verificamos que o IPRF obtido com e sem ruído apresentou melhora significante com os programas 1 e 2 em relação à condição sem prótese e que o programa 2 propiciou melhora significante dos resultados em relação ao programa 1.
O grupo 1 apresentou melhora significativa dos LRSS com o programa 1 em relação às condições sem prótese e com o programa 2. Na presença de ruído (LRSR), podemos dizer que existe uma tendência à diferença entre ambos os programas, pois na análise estatística o p-valor está muito próximo do limite aceitável. Não houve diferença significante entre os resultados obtidos sem prótese e com próteses auditivas no programa 2.
O grupo 2 apresentou melhora significativa dos LRSS e LRSR com o programa 2 em relação às condições sem prótese auditiva e com próteses auditivas no programa 1.
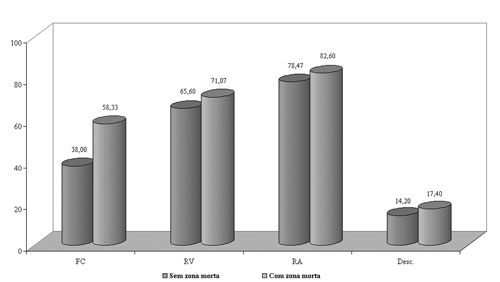
Apenas para o ambiente favorável à comunicação (FC) houve diferença significante entre os grupos, sendo que o grupo 2 apresentou maior dificuldade nesta condição.
DISCUSSÃO
Antes de identificar a presença de zonas mortas na cóclea, o grau da perda auditiva nas freqüências altas e os índices percentuais de reconhecimento de fala já indicavam diferenças importantes entre os pacientes dos grupos 1 e 2. Considerando a configuração audiométrica no grupo 1, descendente, porém sem diferenças maiores que 50 dB entre os limiares obtidos nas sucessivas oitavas de freqüências testadas e a ausência de limiares maiores que 90 dB NA nas freqüências altas (Tabela 3), podemos dizer que o resultado negativo para zonas mortas na cóclea correspondeu ao padrão esperado11. Em relação ao grupo 2, obtivemos resultado positivo para zonas mortas em freqüências altas, a partir de 1500 Hz na maioria dos casos (Tabela 4). Vários pacientes relataram ouvir um som diferente, semelhante a um "chiado", quando a freqüência do tom puro estava associada à zona morta12.
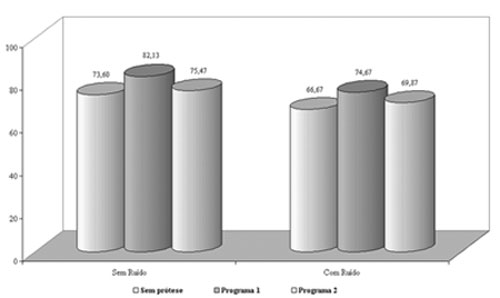
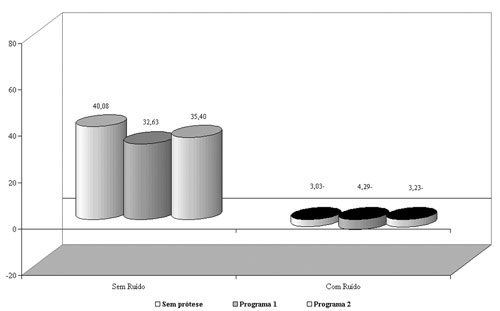
A pesquisa dos índices percentuais de reconhecimento de fala no grupo 1 demonstrou melhora significante com a utilização das próteses auditivas no programa 1 (amplificação sonora em ampla faixa de freqüências, de 100 Hz a 8000 Hz) em relação ao programa 2 (amplificação restrita, de 100 Hz a 2560 Hz), tanto no silêncio quanto na presença de ruído competitivo (Figura 1). Portanto, na ausência de zonas mortas na cóclea, a informação de freqüências altas contribuiu efetivamente para a inteligibilidade da fala5,7,13,14.
Figura 1. Gráfico demonstrativo do índice percentual de reconhecimento de fala (IPRF) com e sem ruído competitivo no grupo 1.
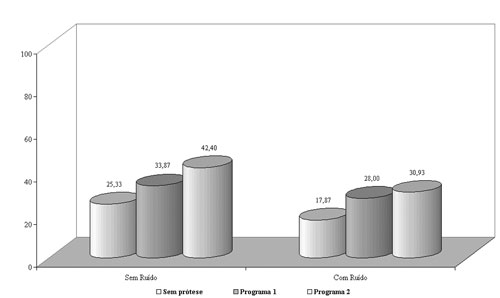
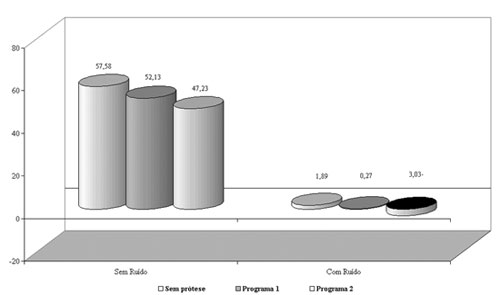
No grupo 2, os índices percentuais de reconhecimento de fala demonstraram melhora significante com a utilização das próteses auditivas nos programas 1 e 2 em relação à condição sem prótese, tanto no silêncio quanto na presença de ruído competitivo (Figura 2), sendo obtido benefício maior com o programa 2. A amplificação sonora mais restrita quanto à faixa de freqüências, ou seja, o ganho menor nas freqüências em que a perda auditiva é mais severa, favoreceu o aproveitamento de informações onde a audibilidade pode ser útil2,5,14,15.
Figura 2. Gráfico demonstrativo do índice percentual de reconhecimento de fala (IPRF) com e sem ruído competitivo no grupo 2.
Explicando a diferença entre o benefício de cada programa para os grupos 1 e 2, podemos supor que os pacientes com zonas mortas na cóclea em freqüências altas estão acostumados à percepção da fala filtrada, porque sua audição funcionaria como um filtro passa-baixa. Os indivíduos sem zonas mortas, que utilizam efetivamente a informação das freqüências altas, são mais afetados pela sua remoção14.
Ao comparar os dois programas utilizados, os pacientes do grupo 2 referiam maior clareza do som e ausência de um "chiado" com o programa 2. Acreditamos que, devido à presença de zonas mortas em freqüências altas, ao deixar de amplificá-las, reduzimos a distorção sonora. A vibração gerada em uma zona morta é detectada por outra região e, portanto, pouca informação útil é transmitida a partir do local comprometido. Além disso, a detecção de sons intensos por regiões com freqüência característica diferente do estímulo, interfere na detecção dos sons correspondentes a estas regiões funcionais6.
Quanto aos limiares de reconhecimento de sentenças no silêncio e no ruído (Figura 3), os indivíduos do grupo 1 apresentaram melhor desempenho com o programa 1 em relação ao programa 2. Na presença de ruído, não houve diferença significante entre o desempenho sem prótese e com próteses auditivas no programa 2, ou seja, nesta condição, o programa 2 praticamente não forneceu benefício. Mais uma vez, estes resultados podem ser associados à utilização das informações de freqüências altas para a inteligibilidade da fala.
Figura 3. gráfico demonstrativo dos limiares de reconhecimento de sentenças no silêncio (LRSS) e na presença de ruído (LRSR) no grupo 1.
Os limiares de reconhecimento de sentenças, no silêncio e no ruído (Figura 4), para o grupo 2 mostraram a obtenção de benefício com os dois programas, sendo o benefício do programa 2 maior que o do programa 1. Quanto à amplificação de freqüências altas em perdas acentuadas nestas freqüências, é necessário considerar a etiologia e o tempo de privação da estimulação auditiva adequada5. Em nosso estudo, dez indivíduos com zonas mortas (66,7% do grupo 2) apresentavam perda auditiva há dez anos ou mais, isto é, um período relativamente longo de privação auditiva, o que pode ter contribuído para a obtenção de resultados melhores com a amplificação em uma faixa reduzida.
Figura 4. Gráfico demonstrativo dos limiares de reconhecimento de sentenças no silêncio (LRSS) e na presença de ruído (LRSR) no grupo 2.
Segundo a aplicação do questionário APHAB (Figura 5), comparando ambos os grupos, observamos que apenas para o ambiente favorável à comunicação houve diferença significante entre eles, sendo que o grupo 2 apresentou maior dificuldade comunicativa. Estes resultados confirmam o desempenho pior do grupo 2 nos testes de fala. O grau da perda auditiva, mais severo, e a presença de zonas mortas na cóclea estão relacionados a esse desempenho.
Figura 5. Gráfico demonstrativo da dificuldade (%) de comunicação nos diferentes ambientes sonoros e desconforto para sons intensos, segundo a aplicação do questionário aphab, nos grupos 1 e 2.
Mais da metade dos pacientes do grupo 2 estava em processo de seleção de próteses auditivas apenas devido à sua participação neste estudo, pois já tinham realizado tentativas anteriores de adaptação sem sucesso. A obtenção de índices percentuais de reconhecimento de fala melhores em pacientes sem zonas mortas na cóclea foi relacionada, em outro estudo16, à maior aceitação para o uso de próteses auditivas (94,1%). Na presença de zonas mortas, o índice de aceitação foi de 21,4%. Durante a realização dos testes, os pacientes do grupo 2 relataram uma melhora da qualidade sonora com o programa 2 e que, desta forma, gostariam de tentar novamente uma adaptação.
Observando a região em que os limiares auditivos estão mais preservados no grupo 2, poderíamos questionar até que ponto a amplificação de sons correspondentes a esta faixa reduzida traria benefícios ao paciente. No entanto, sabemos que, além da perda das informações provenientes das freqüências altas, ocorre também a perda de componentes de fase e sincronização para as freqüências baixas3,17. Por isso, o ganho nestas freqüências talvez seja tão importante. Acreditamos que a estratégia de limitar a amplificação sonora em regiões mais comprometidas e com menor possibilidade de benefício seja a mais adequada para a reabilitação auditiva de pacientes com zonas mortas na cóclea.
CONCLUSÃO
A partir da análise crítica dos resultados, pudemos estabelecer as seguintes conclusões:
1. Na ausência de zonas mortas na cóclea, o melhor desempenho no reconhecimento de fala é obtido com a amplificação em faixa ampla de freqüências;
2. Na presença de zonas mortas na cóclea em freqüências altas, a amplificação sonora em faixa restrita, evitando o ganho nas freqüências altas, promove o melhor desempenho no reconhecimento de fala.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Moore BCJ, Glasberg BR. A model of loudness perception applied to cochlear hearing loss (1997) apud Moore, BCJ, Glasberg, BR. Br J Audiol 1998;32:317-35.
2. Hogan CA, Turner CW. High-frequency audibility:benefits for hearing-impaired listeners. J Acoust Soc Am 1998;104(1):432-41.
3. Bess FH, Humes LE. Estrutura e função do sistema auditivo. In:Bess FH, Humes LE. Fundamentos de Audiologia. Trad. de Marcos AG Domingues. Porto Alegre: Artmed; 1998. p.64-105.
4. Moore BCJ, Huss M, Vickers DA, Glasberg BR, Alcantara JI. A test for the diagnosis of dead regions in the cochlea. Br J Audiol 2000;34:205-24.
5. Ching TYC, Dillon H, Katsch R, Byrne D. Maximizing effective audibility in hearing aid fitting. Ear & Hear 2001;22(3):212-24.
6. Moore BCJ. Dead regions in the cochlea: conceptual foundations, diagnosis, and critical applications. Ear & Hear 2004;2(2):98-116.
7. Vickers DA, Moore BCJ, Baer T. Effects of low-pass filtering on the intelligibility of speech in quiet for people with and without dead regions at high frequencies. J Acoust Soc Am 2001;110(2):1164-75.
8. Pen MG, Mangabeira-Albernaz PL. Lista de monossílabos para discriminação vocal. In: Mangabeira-Albernaz PL, Ganança MM ed. Surdez neurossensorial. São Paulo: Editora Moderna; 1976.p.20.
9. Costa MJ. Desenvolvimento de listas de sentenças em português [tese]. São Paulo:Universidade Federal de São Paulo;1997.
10. Cox RM, Alexander GC. The abbreviated profile of hearing aid benefit. Ear & Hear 1995;16:176-86.
11. Moore BCJ. Dead regions in the cochlea: diagnosis, perceptual consequences and implications for the fitting of hearing aids. Trends in amplif 2001;5:1-34.
12. Moore BCJ, Vickers DA, Plack CJ, Oxenham AJ. Inter-relationship between different psychoacoustic measures assumed to be related to the cochlear active mecanism. J Acoust Soc Am 1999;106(5):2761-78.
13. Baer T, Moore BCJ, Kulk K. Effects of low pass filtering on the intelligibility of speech in noise for people with and without dead regions at high frequencies. J Acoust Soc Am 2002;112(3):1133-44.
14. Vestergaard M. Dead regions in the cochlea:implications for speech recognition and applicability of articulation index theory. Internat J Audiol 2003;42 (5):249-61.
15. Ching TYC, Dillon H, Byrne D. Speech recognition of hearing-impaired listeners:predictions from audibility and the limited role of high-frequency amplification. J Acoust Soc Am 1998;103:1128-40.
16. Eguti EY. Identificação das zonas mortas na cóclea utilizando a técnica de mascaramento com ruído branco [tese]. São Paulo:Universidade Federal de São Paulo;2002.
17. Horwitz AR, Dubno JR, Ahlstrom JB. Recognition of low-pass-filtered consonants in noise with normal and impaired high-frequency hearing. J Acoust Soc Am 2002;111 (1):409-16.
1 Doutora, Fonoaudióloga, Doutora em Ciências dos Distúrbios da Comunicação Humana pela Universidade Federal de São Paulo - Escola Paulista de Medicina.
2 Livre-Docente, Profa. Livre Docente em Ciências dos Distúrbios da Comunicação Humana pela Universidade Federal e São Paulo - EPM e Chefe da Disciplina de Distúrbios da Audição da Universidade Federal de São Paulo - Escola Paulista de Medicina.
Universidade Federal de São Paulo - Escola Paulista de Medicina.
Endereço para correspondência: Angela Gordo - Av. João Ramalho, 505 ap.102 Vila Assunção Santo André 09030-320.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 13 de abril de 2006. cod. 1840.
Artigo aceito em 20 de julho de 2006.