Ano: 2007 Vol. 73 Ed. 2 - Março - Abril - (8º)
Seção: Artigo Original
Páginas: 186 a 192
Comparação histológica entre o osso desmineralizado e polímero de mamona sobre a regeneração óssea
Histological comparison of demineralized bone matrix and the Ricinus communis polymer on bone regeneration
Autor(es): José Rodrigues Laureano Filho 1, Bruno de Lira Castelo Branco 2, Emanuel Sávio Souza Andrade 3, José Ricardo de Albergaria Barbosa 4
Palavras-chave: calota craniana, coelhos, mamona, regeneração óssea.
Keywords: calvaria bones, rabbits, ricinus communis, bone regeneration.
Resumo:
O presente estudo tem por objetivo analisar histologicamente o efeito de uma matriz óssea desmineralizada de origem humana e de uma resina poliuretana derivada do óleo da mamona sobre o processo de reparação óssea. Materiais e Métodos: Foram utilizados 24 coelhos e em cada calvária foram preparadas duas cavidades cirúrgicas, sendo uma do lado direito e a outra do lado esquerdo da sutura parietal. Os animais foram divididos em dois grupos. No grupo I, a cavidade experimental (lado direito) foi preenchida com a matriz óssea desmineralizada de origem humana, enquanto no grupo II a cavidade experimental foi preenchida com a poliuretana derivada do óleo de mamona. As cavidades de controle foram preenchidas apenas com o sangue do animal. Os animais foram sacrificados nos períodos pós-operatórios de 4, 7 e 15 semanas. Resultados: A análise histológica revelou que tanto o grupo controle quanto os grupos I e II apresentaram um aumento na neoformação óssea ao longo do tempo, sendo que esta reparação se deu mais rapidamente no grupo controle, mesmo mostrando diminuição importante na espessura. Conclusões: Ambos os materiais apresentaram-se biocompatíveis, sendo a poliuretana reabsorvida mais tardiamente e considerada de melhor resultado em relação ao outro material empregado.
Abstract:
Aim The aim of the present study is to make a histologic analysis the effects of a human demineralized bone matrix and a polyurethane resin derived from the Ricinus communis, on bone regeneration process. Materials and Methods For this, 24 rabbits were submitted to two surgical calvaria bone defects, one on the right and another on the left side of the parietal suture. The animals were divided in two groups. In group I the experimental defect (right side) was treated with a human demineralized bone matrix, while in group II the experimental cavity was treated with the polyurethane resin derived from Ricinus communis. The control defects were filled with the animal's own blood. The animals were slaughtered after subsequent periods of 04, 07 and 15 weeks. Results The histological analysis revealed that all groups (control and experiment), presented increased bone regeneration with time, but this repair was faster in the control group, even showing important decrease in defect thickness. Conclusion Both materials proved to be biologically compatible, however polyurethane was more slowly resorbed presented considerable better results when compared with demineralized bone matrix.
![]()
INTRODUÇÃO
O osso é um tecido conjuntivo, extremamente duro, mas com grande plasticidade, apresentando um metabolismo altamente complexo, com potencial de reparação envolvendo íons, células, hormônios, proteínas e fatores nutricionais1. Dentre os diversos processos de reparação tecidual, a reparação óssea se apresenta como um dos mais complexos, sendo foco de interesse nas pesquisas na área de Cirurgia e Traumatologia Bucomaxilofacial2.
O tecido ósseo possui uma alta capacidade de reparação espontânea quando lesionado, repondo depois de um breve intervalo de tempo, toda a porção perdida3. No entanto, em alguns casos de defeitos ósseos, às vezes extensos, que não têm a capacidade de se repararem espontaneamente, há a necessidade de se utilizar diversas técnicas cirúrgicas na tentativa de reparação da deficiência óssea4.
A reconstrução destas de lesões amplas em tecidos duros sempre foi um dos grandes desafios para a ciência5, tendo já sidos utilizados para tal, o osso autógeno, homógeno, liofilizado, desmineralizado, como também materiais artificiais ou sintéticos6.
Os enxertos ósseos desmineralizados e liofilizados promovem uma rápida cicatrização nos defeitos ósseos e possuem propriedade de induzir uma considerável formação óssea além de não apresentar qualquer poder antigênico7. O enxerto de osso desmineralizado e liofilizado tem como desvantagem a sua forma e sua origem. O tamanho de suas partículas limita a quantidade de aposição coronal do osso disponível em defeitos horizontais e qualquer pressão leve do tecido pode deslocar o material enxertado8. A dificuldade de obtenção de osso humano viável em quantidade, associado à proibição em vários países da comercialização de órgãos ou tecidos humanos e da possibilidade de transmissão de doenças, sem falar do seu alto custo3.
Em 1984, o grupo de Química Analítica e Tecnologia de Polímeros da Escola de Engenharia de São Carlos desenvolveu uma resina poliuretana de origem vegetal extraída do óleo de mamona9. Os polímeros têm como vantagens a processabilidade e flexibilidade de formulação, excelentes propriedades estruturais, ausência de emissão de irritantes ou vapores tóxicos, além da biocompatibilidade10. Henning et al. (1989)11 observaram, inclusive, a biocalcificação in vivo e in vitro das resinas poliuretanas. Carvalho et al. (1997)12 observaram a osseointegração deste polímero e relataram a reabsorção e a substituição do polímero por tecido ósseo.
Os estudos afirmam que o osso autógeno é o melhor material para a enxertia13, porém vários substitutos do tecido ósseo têm sido propostos para evitar a morbidade do sítio do doador e o aumento do tempo operatório14, procurando criar ou extrair da natureza materiais que promovam o incremento da reparação e neoformação óssea, sendo biocompatíveis, osteocondutores e osteoindutores15. Este estudo, portanto, tem a finalidade de avaliar histologicamente o efeito de uma matriz óssea desmineralizada de origem humana e de uma resina poliuretana derivada do óleo da mamona, sobre o processo de reparação óssea.
MATERIAIS E MÉTODOS
Para isto foi utilizado no presente estudo 24 coelhos albinos da raça New Zealand, fêmeas, com idade variando entre 03 a 06 meses, e peso médio de 2,9kg.
Estes animais foram divididos em dois grupos iguais (Grupo I e Grupo II), de acordo com a implantação do tipo de material, matriz de osso desmineralizado de origem humana - DEMBONETM e resina poliuretana extraída do óleo da mamona - AUG-EX®, respectivamente, e em três períodos de observação. Estes materiais foram adquiridos comercialmente. O DEMBONETM é uma matriz óssea desmineralizada produzida por um banco de ossos (Pacific Coast Tissue Bank) localizado em Los Angeles, EUA, sendo largamente comercializado neste país. O polímero extraído do óleo de mamona, AUG-EX® é produzido pela Poliquil Araraquara Polímeros Químicos Ltda., empresa brasileira que utilizou do desenvolvimento tecnológico do Instituto de Química de São Carlos da Universidade de São Paulo para produzir e comercializar este polímero com características de um substituto ósseo no Brasil.
Os animais foram acondicionados no biotério da Faculdade de Odontologia de Piracicaba - Unicamp. Como os coelhos possuem comportamento comunitário, foram alojados 4 a 5 animais em cada gaiola. As trocas de camas e limpeza das gaiolas, bebedouros e comedouros foram efetuadas diariamente, de acordo com o protocolo de limpeza e desinfecção adotado pelo biotério da Faculdade de Odontologia de Piracicaba - Unicamp. Os animais foram mantidos à base de ração comercial sólida peletizada, com alto teor protéico (20 a 27%), e água ad libitum.
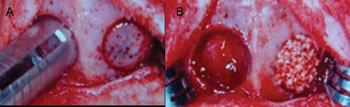
Ambos os grupos foram constituídos de 12 animais distribuídos igualmente em três períodos de observação (4 semanas, 7 semanas e 15 semanas). Para cada animal foram realizadas duas cavidades na calvária. No grupo I, uma das cavidades foi preenchida por matriz de osso desmineralizado de origem humana (lado direito - experimental) e a outra por sangue (lado esquerdo - controle). No grupo II, uma das cavidades foi preenchida por resina poliuretana extraída do óleo da mamona (lado direito - experimental) e a outra por sangue (lado esquerdo - controle) (Figura 1A e 1B) (Tabela 1).
Figura1 - Cirurgia Experimental na Calota Craniana do Coelho - - A Perfuração da cavidade com a trefina. B -Cavidade preenchida com sangue no lado esquerdo e com material testado no lado direito.
Os animais foram sacrificados nos períodos de 4, 7, e 15 semanas de pós-operatório, num total de quatro animais de cada grupo, por período de sacrifício, como mostra a Tabela 2. Após isto, procedeu-se a remoção dos blocos ósseos contendo as cavidades ósseas para confecção de lâminas com o propósito de análise microscópica, utilizando-se a técnica coloração pela Hematoxilina/Eosina (H/E).
Após a coloração e montagem das lâminas, estas foram submetidas a exame por microscopia de luz, cuja finalidade foi observar o reparo da calvária de coelhos. As lâminas foram observadas por um patologista, separadamente, na Faculdade de Odontologia de Pernambuco (FOP/UPE). Os parâmetros pré-estabelecidos eram então anotados e os achados microscópicos foram então analisados qualitativamente. Nesta fase o patologista não conseguia identificar a que grupo as lâminas pertenciam. Isto foi possível porque as lâminas possuíam uma numeração que não identificava nem o grupo, nem o período de sacrifício.
Este estudo foi enviado ao Comitê de Ética em Experimentação Animal do Instituto de Biologia da Universidade de Campinas - CEEA-IB/Unicamp, tendo sido aprovado sob número 183-1, previamente ao início do desenvolvimento deste projeto.
RESULTADOS
Análise Histológica
Período de quatro semanas - Grupo Controle (osso desmineralizado)
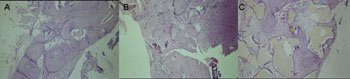
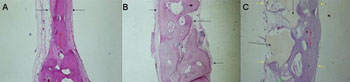
Foi observado predominantemente fechamento parcial do defeito ósseo com interposição de tecido conjuntivo fibroso, osteóide e grande quantidade de osteoblastos. Em um dos indivíduos observou-se também intensa inflamação crônica (Figura 2A).
Período de quatro semanas - Grupo Experimental (osso desmineralizado)
Fechamento parcial do defeito ósseo, com grande quantidade de tecido conjuntivo fibroso e neoformação óssea nas margens (Figura 2B).
Período de quatro semanas - Grupo Controle (polímero de mamona)
Interposição de tecido conjuntivo fibroso com presença de osteóide, osteoblastos, osteócitos, tecido ósseo maduro e neoformação óssea.
Período de quatro semanas - Grupo Experimental (polímero de mamona)
Presença de tecido conjuntivo fibroso com formação de tecido ósseo maduro, osteóide e pavimentação osteoblástica contornando o material de preenchimento (Figura 2C).
Figura 2 - Período de Sacrifício - 04 semanas(H/E - 100X) - A - Grupo Controle B - Grupo Experimental: Dembone C - Grupo Experimental: Polímero de Mamona.
Período de sete semanas - Grupo Controle (osso desmineralizado)
Presença de tecido conjuntivo fibroso com grande quantidade de osteoblastos interposto entre trabéculas de osso maduro e formação de osteóide. Neste grupo foram avaliados três indivíduos pelo fato de durante a avaliação microscópica ter sido constatada interposição de tecido intracraniano no interior do defeito ósseo.
Período de sete semanas - Grupo Controle (polímero de mamona)
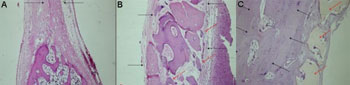
Fechamento de grande parte do defeito por tecido ósseo maduro, observando-se a presença de tecido conjuntivo fibroso, grande quantidade de osteoblastos e uma visível redução na espessura óssea (Figura 3A).
Período de sete semanas - Grupo Experimental (osso desmineralizado)
Fechamento parcial do defeito por grande quantidade de tecido conjuntivo fibroso, observando-se áreas de neoformação óssea a partir das margens do defeito (Figura 3B).
Período de sete semanas - Grupo Experimental (polímero de mamona)
Fechamento quase que total do defeito por tecido ósseo maduro, com recomposição parcial da cortical interna. Pavimentação osteoblástica, osteóide e neoformação óssea em torno do material implantado (Figura 3C).
Figura 3 - Período de Sacrifício - 07 semanas - A - Grupo Controle(H/E - 40X) B - Grupo Experimental: Dembone (H/E - 100X) C - Grupo Experimental: Polímero de Mamona(H/E - 100X).
Período de quinze semanas - Grupo Controle (osso desmineralizado)
Fechamento do defeito por tecido ósseo maduro com redução da espessura entre as corticais e discreta interposição de tecido conjuntivo fibroso. Presença de osteóide e grande quantidade de osteoblastos. Neste grupo foram analisado três indivíduos já que houve problema durante a fase técnica de confecção das lâminas com perda de um dos espécimes (Figura 4A).
Período de quinze semanas - Grupo Experimental (osso desmineralizado)
Fechamento do defeito com tecido ósseo maduro e interposição de tecido conjuntivo fibroso com redução da espessura entre as corticais. Numerosos osteoblastos e intensa deposição de osteóide nas margens do defeito (Figura 4B).
Período de quinze semanas - Grupo Controle (polímero de mamona)
Fechamento completo do defeito por tecido ósseo maduro, com redução da espessura entre as corticais ósseas. Neste grupo foram analisados três indivíduos devido a problemas na fase técnica de confecção das lâminas, havendo perda de um dos espécimes (Figura 4C).
Figura 4 - Período de Sacrifício - 15 semanas(H/E - 40X) - A - Grupo Controle B - Grupo Experimental: Dembone C - Grupo Experimental: Polímero de Mamona.
Período de quinze semanas - Grupo Experimental (polímero de mamona)
Fechamento parcial do defeito com formação de ponte de tecido ósseo maduro, presença de tecido conjuntivo fibroso, neoformação óssea circunjacente ao material empregado, observando-se em um dos espécimes atividade osteoclástica na periferia do material.
DISCUSSÃO
O interesse no estudo de materiais capazes de substituir o tecido ósseo tem aumentado nas profissões que compõem a área de saúde16, principalmente na odontologia, onde o surgimento de tratamentos como os implantes osseointegrados e uma maior conscientização da importância da reconstrução óssea nos pacientes submetidos a procedimentos mutiladores tem levado à necessidade de se repor o tecido ósseo perdido com maior freqüência que anteriormente17.
O enxerto ósseo autógeno ainda é considerado o melhor para a substituição de perdas ósseas, acima do limite crítico necessário à reparação e, apesar de suas vantagens indiscutíveis, tem-se também algumas desvantagens, dentre elas causar maior morbidade e ser um recurso de fonte esgotável, motivando diversas especialidades a procurar substitutos ósseos à altura, que aliem as vantagens, minimizando as desvantagens18. Dispõe-se no mercado de substâncias comercialmente consolidadas e algumas ainda em fase de teste, que têm sido usadas como substitutos ósseos efetivos, com algumas propriedades esperadas, como: biocompatibilidade, osteocondução, osteoindução5.
Dentre os substitutos ósseos derivados do tecido ósseo, optamos por utilizar nesta pesquisa o osso desmineralizado de origem humana por ser um dos mais utilizados na odontologia, por ser homógeno19, e um dos poucos nesta categoria disponíveis comercialmente [5][1]. Além de apresentar bons resultados reconhecidos cientificamente13,20. A discutível propriedade, do osso desmineralizado de origem humana, de promover a osseoindução é mais um dado importante para utilizarmos nesta pesquisa13.
Uma outra categoria dos substitutos ósseos é a composta pelos não-derivados do tecido ósseo, como as cerâmicas (hidroxiapatita, tricálcio-fosfato), vidro bioativo, o sulfato de cálcio, os polímeros, dentre outros. Estes biomateriais são materiais sintéticos desenvolvidos com objetivo de estimular e promover o reparo ósseo, evitando a utilização do enxerto ou mesmo minimizando seu uso9. Nesta categoria destacamos os biopolímeros por apresentar, nos últimos anos, uma grande evolução científica20. Dentre estes está a poliuretana derivada do óleo da mamona [6][2], que foi utilizada nesta pesquisa por ter seu desenvolvimento totalmente no âmbito nacional, de origem vegetal e por estas razões, de baixo custo9. Ainda, por apresentar comprovação científica de biocompatibilidade21 e potencial de osseocondução21-23.
Para testar estes substitutos ósseos optamos por um desenho metodológico de investigação experimental em animal, prospectivo, comparativo e aleatório. Esta opção foi devido ao fato de ser este o modelo mais adequado para a experimentação de substitutos ósseos, antes dos ensaios clínicos9,24.
Os resultados demonstraram que mesmo ao final do maior período para sacrifício, 15 semanas após o preparo da cavidade, a regeneração óssea espontânea foi suficiente para promover a regeneração óssea completa entre as bordas da cavidade controle. Isto não vem a corroborar com os resultados por outros autores quando a cavidade não recebe qualquer tratamento específico, a não ser irrigação e preenchimento com o sangue do próprio animal14,23. Fato um tanto quanto curioso, visto que a cavidade confeccionada apresentava dimensões compatíveis com um defeito crítico. Este tipo de defeito é assim chamado por não permitir regeneração espontânea destas cavidades24. Baseado no ocorrido, podemos sugerir que, talvez, esta dimensão tida como crítica na verdade não é. Desta forma, estudos adicionais que determinem de forma consistente as dimensões de um defeito crítico.
No intervalo de quatro semanas, período inicial de avaliação do nosso trabalho foi possível identificar a presença de partículas do material rodeadas por tecido conjuntivo fibroso no interior da cavidade óssea cirúrgica, tanto no grupo polímero de mamona, quanto no grupo osso desmineralizado, significando pouco tempo hábil para a reparação óssea completa. Neste período inicial de observação o primeiro tecido a se formar foi o tecido conjuntivo fibroso preenchendo o espaço do defeito criado, característica natural desta fase de regeneração24, havendo ainda osteóide e pavimentação osteoblástica em pouca quantidade. Resultados semelhantes são descritos para o polímero de mamona22 e para osso desmineralizado de origem humana3,24.
No período de sete semanas, em ambos os grupos, polímero de mamona e osso desmineralizado, observou-se partículas dos materiais envolvidos por tecido conjuntivo fibroso e osso. Aqui observamos uma neoformação óssea a partir das margens do defeito, porém ainda com grande quantidade de tecido conjuntivo no grupo do osso desmineralizado enquanto que no grupo do polímero houve o fechamento quase que total do defeito por tecido ósseo maduro em torno do material implantado, fato que também foi observado por Garcia (2000)24 em relação ao osso desmineralizado, e por Ueda et al. (1996)22, avaliando o polímero de mamona. Melhor resultado foi observado no grupo do polímero em relação ao osso desmineralizado.
Após quinze semanas, uma formação quase que completa foi observada em todos os grupos, com união das margens nos grupos experimentais e união óssea no grupo controle por afilamento do osso neoformado, afilamento este não visto apenas no grupo do polímero. É que quando houve a reparação do defeito no grupo controle, o organismo não teve a capacidade de manter a mesma espessura óssea que havia na região, apesar de tê-lo reparado completamente. No mesmo estudo, pudemos observar uma grande reabsorção das partículas de osso desmineralizado, mostrando que devido a isto também não foi possível manter a mesma espessura "pré-defeito" da calota craniana, diferentemente do grupo do polímero que apresentou-se como um material de quase nenhuma reabsorção, neste período, estando portanto incorporado ao defeito biocompativelmente, desta forma mantendo uma maior espessura da reparação, já que tornou-se parte integrante da mesma, fazendo inclusive nos sugerir ser um material que possa ser utilizado na reparação de defeitos os quais o contorno ósseo deva ser preservado.
De forma geral, observamos, através da análise histológica, que os materiais testados influenciaram positivamente na neoformação óssea dos defeitos. Em ambos os grupos experimentais, a osteocondução foi a via responsável para a regeneração. Esta neoformação óssea ocorreu, principalmente, a partir da periferia, das bordas do osso preexistente para o centro, diferente de multifocos de ossificação a qual é uma característica que ocorre no processo de osseoindução. O osso desmineralizado apresentou comportamento semelhante ao que encontramos em outros estudos3, 24. Estes resultados mostraram-se diferentes dos encontrados por Mulliken et al. (1981)25, onde 100% das cavidades preenchidas por uma matriz óssea desmineralizada, estavam completamente preenchidas pelo tecido ósseo neoformado após 2 semanas. Contudo, as cavidades ósseas cirúrgicas destes dois experimentos foram realizadas na calvária de ratos e apresentavam apenas 4mm de diâmetro, tamanho este insuficiente, já que com o objetivo determinar o defeito ósseo ideal para o estudo de substituto ósseo Hollinger e Schimitz (1987)23 ressaltaram a necessidade da utilização de um defeito ósseo de tamanho suficiente para que não ocorra regeneração espontânea, devendo, portanto, conforme seu protocolo, as pesquisas serem iniciadas com defeitos com pelo menos 8mm de diâmetro.
Carvalho et al. (1997)12 e Ueda et al. (1996)22 encontraram, em seus estudos com o polímero de mamona, resultados semelhantes ao desta pesquisa, neoformação óssea por osteocondução. Com relação à reabsorção, em nosso trabalho, o polímero de mamona praticamente pouco foi reabsorvido ao final das quinze semanas. Ignácio et al. (1997)9, após produzir defeitos ósseos em rádios de 34 coelhos e substituí-los por bastões de polímero de mamona observaram a substituição quase que completa do polímero por osso, onde no grupo de 16 semanas as duas extremidades ósseas (distal e proximal) praticamente uniram-se na região central. Já Carvalho et al. (1997)12 e Ueda et al. (1996)22 não observaram reabsorção total ou quase que total em seus estudos. Porém, Ueda et al. (1996)22 utilizaram para defeitos ósseos, tíbia de coelho e só avaliaram até 40 dias a reparação. Carvalho et al. (1997)12 fizeram a última análise com 6 semanas do procedimento inicial. Todos com períodos de observação menores do que utilizamos.
Por fim, na regeneração óssea, o uso de substitutos ósseos osteocondutores não é aconselhável no reparo de grandes defeitos. Duguy et al. (2000)26 justificam isto em virtude do crescimento ósseo, neste tipo de material, ser limitado à periferia do implante. Por isto, Lewandrowsky et al. (1999)27,28 já sugeriam a combinação de uma matriz osteocondutora com materiais osteoindutores, como os fatores de crescimento para se obter uma reparação óssea completa.
Além do que, estudos semelhantes a estes devem ser realizados utilizando avaliações adicionais como análise radiográfica, histomorfométrica e imunohistoquímica para que se tenham ferramentas que possibilitem comparações qualitativas e quantitativas entre os materiais pesquisados.
CONCLUSÃO
Dentro do propósito deste estudo, e com base nos resultados obtidos podemos concluir que:
1-Histologicamente, tanto os grupos controle quanto os grupos experimentais (I e II) apresentaram um aumento na neoformação óssea ao longo do tempo, sendo nos grupos controle mais rápidas que nos experimentais.
2-Ambos os materiais testados apresentaram-se como materiais biocompatíveis, sendo a matriz óssea desmineralizada de origem humana reabsorvida bem mais rapidamente que a poliuretana derivada do polímero da mamona, a qual parece ser um material de reabsorção tardia, conforme observado, na análise histológica, nos períodos de 4, 7 e 15 semanas.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Ross MH, Reith EJ, Romrell LJ. Histologia: Texto e Atlas. 2 ed. São Paulo: Panamericana; 1993.
2. Figueiredo AS, Takita LC, Goldenberg, S. Comparação entre a hidroxiapatita porosa de coral e o enxerto ósseo autógeno em coelhos. Acta Cir Bras 1997;12(2): 84-8.
3. Taga R, Cestari TM, Silva TL, Stiipp CM. Reparo de defeito ósseo perene em crânio de cobaia pela aplicação de osseobond. Rev Bras Implant jan/fev 1997;3( 1): 13-20.
4. Restrepo LL, Marzola C, Consolaro A, Costa Pereira AA, Toledo Filho JL, Andreo JC. Avaliação de implantes de osso bovino liofilizado "Osseobondâ" e membrana reabsorvível de osso bovino liofilizado. Rev Bras Implant 1998;(4):8-15.
5. Gonçalves EAL, Guimarães SAC, Garcia RB. Proteína morfogenética óssea: terapêutica molecular no processo de reparo tecidual. Revista Odontol Univ São Paulo jul/set 1998;12(3):22-9.
6. Yamamoto TT, Kawakami M, Sakuda M. Defects of the rat premaxilla as a model of alveolar clefs for testing bone-inductive agents. J Oral Maxillofac Surg Philadelphia Aug 1993;51(8):887-91.
7. Freeman E, Turnbull RS. The value of osseous coagulum as a graft material. J Periodont Res Apr 1973;8(4):229-36.
8. Shigeyama Y, Dérrico JÁ, Stone R, Somerman MJ. Comercially-prepared allograft material has biological activity in vitro. J. Periodontol Chicago Jun., 1995;66(6):478-87.
9. Ignácio H, Mazzer Barbieri CH, Chierici G. Uso da poliuretana derivada do óleo de mamona para preencher defeitos ósseos diafisário segmentares do rádio. Estudo experimental em coelhos. Rev Bras Ortop 1997;32(1):815-9.
10. Ota K. Towards and ideal polyurethane graft for hemodialysis. J Biomater Appl Oct 1989;4(2):141-57.
11. Henning E, John A, Zartnanack F, Lemm W, Bucherl ES, Wick G, Gerlach K. Biostability of polyurethane. Exp Chir Transplant Kunstliche Organe 22:204-7, 1989. Apud Ohara GH, Kojima KE, Rossi JC, Telles M, Soares TVC, Salomão C. Sanda M. Estudo experimental da biocompatibilidade do polímero poliuretano da mamona implantada intra-óssea e intra-articular em coelhos. Acta Ortop Bras 1995;3(2):62-8.
12. Carvalho TL, Araújo CA, Teófilo JM, Brentegani LG. Histologic and histometric evaluation of rat alveolar wound healing around polyurethane resin implants. Int. J. Oral Maxillofac Surg Philadelphia 1997;26(2):149-52.
13. Piattelli A, Scarano M, Corigliano M, Piattelli M. Comparison of bone regeneration with the use of mineralized and demineralized freeze-dried bone allografts: a histological and histochemical study in man. Biomaterials Oxford Jun 1996;17(11):1127-31.
14. Dupoirieux L, Costes V, Jammet P, Souyris F. Experimental study on demineralized bone matrix (DBM) and coral as bone graft substitutes in maxillofacial surgery. Int J Oral Maxillofac Surg Philadelphia Dec 1994;23(6,pt.2):395-98.
15. Frota R. Avaliação Histológica da reparação óssea na calota craniana de ratos utilizando enxerto de beta-tricálcio fosfato. 2003. 91f. Tese (Mestrado em Odontologia) - Faculdade de Odontologia, FOP/UPE, Recife.
16. Ignácio H, Mazzer N, Barbieri CH, Chierici G. Estudos sobre a aplicabilidade médica da poliuretana derivada da mamona. Res Ortop, 1996;2(1):10-5.
17. Buckley M. Bone Substitutes. In: Selected Readings in Oral and Maxillofacial Surgery. University of Texas Southwestern Medical Center at Dallas, 1994;4:67-77.
18. Kamakura S, Sasano Y, Homma H, Suzuki O, Kagayama M, Motegi K. Implantation of octacalcium phosphate (OCP) in rat skull defedts enhances bone repair. J. Dent. Res, 78( 11): 1682-7, nov., 1999.
19. Barbosa EP, Lima JHC. Ossoliofilizado - critérios para escolha com segurança. Rev Bras Implantodont 1996;2:17-8.
20. Garcia Junior IR. Avaliação experimental de três diferentes tipos de implantes: polímero de Mamona, polietileno de alta densidade - Medpor e Matriz óssea bovina, no preenchimento de defeitos ósseos maxilares. Estudo histológico e histométrico em macacos. 2000. 73p. Tese(Doutorado) - Faculdade de Odontologia de Araçatuba - UNESP, Araçatuba(SP).
21. Cavalieri I. Estudo do processo de reparação óssea entre os implantes de polímero de mamona, resina acrílica termicamente ativada e cimento ósseo, em tíbia de coelhos. 2000. 108p. TESE (Mestrado) Faculdade de Odontologia de São José dos Campos - UNESP, São José dos Campos.
22. Ueda JK et al. Implante de resina de poliuretana vegetal na câmara anterior do olho de camundongo. Estudo histológico In: REUNIÃO DA SBPqO, 13, 1996, São Pedro (SP). Anais... São Pedro (SP), 1996): 122-30.
23. Hollinger JO, Schmitz JP. Restoration of bone discontinuities in dogs using a biodegradable implant. J Oral Maxillofac Surg Philadelphia 1987;45(7):594-600.
24. Garcia RR. Comparação de matrizes ósseas desmineralizadas sobre o processo de regeneração óssea. Estudo histológico em calvária de coelhos.1999.126p. Tese (Mestrado) - Faculdade de Odontologia de Piracicaba - Unicamp, Piracicaba (SP), 2000.
25. Mulliken JB, Glowacki J, Kaban LB, Folkman J, Murray JE. Use of demineralized allogenic bone implants for the correction of maxillocraniofacial deformities. Ann Surg 1981;194(3):366-72.
26. Duguy, Petite H, Arnaud E. Biomaterials and osseous regeneration. Ann Chir Plast Esthet 2000;45(3):364-76.
27. Lewandrowski KU, Bondre S, Gresser JD, Silva AE, Wise DL, Trantolo DJ. Augmentation of osteoinduction with a biodegradable poly(propylene glycol-co-fumaric acid) bone graft extender. A histologic and histomorphometric study in rats. Biomed Mater Eng Aug 1999;9(5/6):325-34.
28. Lewandrowski KU, Bondre S, Gresser JD, Tomford WW, Wise DL, Trantolo DJ. Improved osteoconduction of cortical bone grafts by biodegradable foam coating. Biomed Mater Eng Aug 1999;9(5/6):265-75.
1 Doutorado, Professor da Área de Cirurgia e Traumatologia Bucomaxilofacial da Faculdade de Odontologia de Pernambuco da Universidade de Pernambuco - FOP/UPE.
2 Cirurgião-Dentista, Aluno do Curso de Especialização em Cirurgia e Traumatologia Bucomaxilofacial da Faculdade de Odontologia de Pernambuco da Universidade de Pernambuco - FOP/UPE.
3 Doutorado, Professor da disciplina de Patologia Bucal da Faculdade de Odontologia de Pernambuco da Universidade de Pernambuco - FOP/UPE.
4 Doutorado, Professor da área de Cirurgia e Traumatologia Bucomaxilofacial, da Faculdade de Odontologia de Piracicaba da Universidade de Campinas - FOP/UNICAMP.
Faculdade de Odontologia de Pernambuco - FOP/Universidade de Pernambuco - UPE.
Endereço para correspondência: Prof. Jose Rodrigues Laureano Filho - Faculdade de Odontologia de Pernambuco - FOP/UPE Av. Gal. Newton Cavalcanti 1.650 Camaragibe PE 54753-220.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 22 de janeiro de 2006. cod. 1690
Artigo aceito em 8 de janeiro de 2007.