Ano: 2007 Vol. 73 Ed. 1 - Janeiro - Fevereiro - (20º)
Seção: Artigo de Revisão
Páginas: 123 a 127
O papel do Fator de Necrose Tumoral Alfa (TNF-á) no processo de erosão óssea presente no colesteatoma adquirido da orelha média
The role of Tumor Necrosis Factor -Alpha (TNF-á) in bone resorption present in middle ear cholesteatoma
Autor(es): Rodrigo Faller Vitale 1, Fernando de Andrade Quintanilha Ribeiro 2
Palavras-chave: colesteatoma, fator de necrose tumoral, orelha média, reabsorção óssea.
Keywords: cholesteatoma, tumor necrosis factor, ear middle, bone resorption.
Resumo:
O colesteatoma adquirido da orelha média causa erosão óssea, com altas taxas de morbidade e mortalidade. O TNF-á (TNF-á) é uma das principais citocinas envolvidas neste processo. Objetivo: Avaliar o papel do TNF-á na reabsorção óssea e a ação dele no colesteatoma. Material e Métodos: Foi realizado um levantamento e uma revisão crítica da literatura. Resultados: Todos os autores estudados concordam com a importância do TNF-á no processo de reabsorção óssea presente no colesteatoma e com o grau de destruição observado. Diferentes trabalhos demonstraram que o TNF-á é capaz de provocar erosão óssea, através de diferentes vias de ação. Ele pode estimular a diferenciação e a maturação dos osteoclastos ou, ainda, agir na matriz óssea expondo-a à ação dos osteoclastos. Existe a possibilidade de inibir a ação do TNF-á, diminuindo seus efeitos e prevenindo a perda óssea em doenças como a artrite reumatóide. Não existe, entretanto, trabalhos específicos em colesteatoma. Não existe consenso sobre a sua localização. Estas diferenças, provavelmente, ocorrem devido à distribuição dos receptores. Conclusão: O TNF-á, presente no colesteatoma promove a reabsorção óssea, juntamente com outras citocinas (RANKL e IL-1), estando relacionado com a presença de complicações.
Abstract:
Cholesteatoma may cause bone erosion, with high morbidity and mortality rates. Tumor Necrosis Factor -Alpha (TNF-a) is one of the main cytokines involved in this process. Our goal was to evaluate the role of TNF-a in Bone Resorption and its effect on cholesteatoma. Material and Methods: analysis and critical literature review. Results: Different studies have demonstrated that TNF-a is capable of causing bone erosion. It may stimulate the differentiation and maturation of osteoclasts or it may act on the bone matrix, exposing it to the action of the osteoclasts. It is possible to inhibit TNF-a, reducing its effects and prevent bone loss in illnesses such as rheumatoid arthritis,and there has been no specific investigation regarding cholesteatomas. All studies agree on the importance of TNF-a in the bone resorption process present in cholesteatomas, and on the degree of destruction observed; however, there is no consensus as to its location. These differences are probably due to receptor site. Conclusion: TNF-a, present in cholesteatomas, promotes bone resorption, along with other cytokines (RANKL and IL-1) related to complications.
![]()
INTRODUÇÃO
O colesteatoma adquirido da orelha média foi descrito pela primeira vez por Curveilhier, em 1829, sendo caracterizado pela invasão da caixa timpânica por um epitélio escamoso estratificado queratinizado, diferente do epitélio encontrado normalmente na orelha média1.
O colesteatoma pode causar erosão óssea, levando a complicações intratemporais e intracranianas2. Estas complicações possuem alta taxa de morbidade e mortalidade. Por este motivo a importância de estudarmos os mecanismos de erosão óssea do colesteatoma.
Existem diversas teorias para explicar as propriedades destrutivas (erosão) do colesteatoma. Inicialmente foi proposto que a pressão exercida pelo acúmulo de queratina e de outros resíduos seria a responsável pela destruição. Posteriormente, surgiu a teoria bioquímica. Nesta, as enzimas e citocinas liberadas pelo colesteatoma teriam a capacidade de causar lise óssea e de provocar erosão3.
As citocinas são um grupo de proteínas de baixo peso molecular, que atuam na intercomunicação celular4. As citocinas são liberadas em decorrência de diferentes estímulos e interagem com os seus receptores regulando a função celular5. As citocinas estão intimamente relacionadas ao processo inflamatório. O Fator de necrose tumoral alfa (TNF-?), foi descoberto em 1975 por Carswell et al.6, sendo considerada uma das principais citocinas relacionadas aos processos inflamatórios e imunes, agindo em diferentes partes do corpo. Ele é secretado por macrófagos, linfócitos e monócitos, sendo a presença de lipopolissacarídeos (LPS) bacterianos o principal estímulo para que isto ocorra. No caso dos colesteatomas, juntamente com outras citocinas, o TNF-? favorece a destruição e a remodelação óssea 7.
O objetivo deste trabalho é analisar a importância do Fator de Necrose Tumoral Alfa (TNF-?) na reabsorção óssea e, principalmente, sua ação no colesteatoma adquirido da orelha média, por meio de uma revisão e de uma análise crítica da literatura.
REVISÃO DA LITERATURA
Propriedades gerais do TNF-?
O TNF-? pode ser produzido por macrófagos ativados, linfócitos ou monócitos8. O principal estímulo para a sua produção é a presença de lipopolissacarídeos que compõem a membrana das bactérias gram negativas9. Após ser produzido e liberado, o TNF-? irá ligar-se a receptores específicos denominados de receptores de TNF (TNF-R) I e II, para que possa produzir o seu efeito biológico. Os receptores de TNF (principalmente o TNF-RII) podem, ainda, desencadear o gatilho para a apoptose. Entretanto, o mecanismo que determinará qual efeito será dominante ainda não está totalmente esclarecido5. Desta forma, o principal efeito fisiológico do TNF-? é promover a resposta imune e a inflamatória por meio do recrutamento de neutrófilos e monócitos para o local da infecção, além de ativá-los. Para isto, o TNF-? provocará uma série de efeitos no organismo5.
O TNF-?, quando liberado em baixas concentrações, age nas células endoteliais promovendo vasodilatação e estimulando-as a secretarem um grupo de citocinas (denominadas quimioquinas) que tem ação quimiotáxica em relação aos leucócitos, promovendo, desta forma, um processo inflamatório local que possibilita o combate a quadros infecciosos5. No hipotálamo ele age como pirógeno endógeno induzindo febre, enquanto que no fígado vai estimular a produção das proteínas da fase aguda do processo inflamatório e de fibrinogênio5.
O TNF-? promove erosão óssea. Para isto, ele irá agir diretamente na diferenciação e maturação dos osteoclastos, ou indiretamente expondo a matriz óssea10. Entretanto, ele não age sozinho na reabsorção óssea, a interleucina1 (IL-1) e o RANKL (ligandinas para ativação de receptores de NF-?B) também são abundantes nos locais com processo inflamatório associado à erosão óssea. Eles teriam, conjuntamente, a capacidade de promover o recrutamento, a diferenciação e ativação dos osteoclastos11. Desta forma, existe, um sinergismo entre o TNF-? e o RANKL, o que aumenta a ação dos osteoclastos por um mecanismo de cooperação8,12, conjuntamente com a interleucina 1 e 6 (IL-1 e IL-6)13,14.
O TNF-? pode ser inibido por meio do uso de soluções antagonistas, que contém uma porção solúvel que ao ligar-se a seus receptores inibe a sua ação. Assuma et al.12 (1998) observaram diminuição de aproximadamente 60% da perda óssea com o uso destes antagonistas. O uso de anticorpos anti-TNF-? também pode inibir a sua ação15.
Ação do TNF-? no colesteatoma adquirido da orelha média
Os primeiros estudos analisando o papel do TNF-? no colesteatoma foram realizados no início da década de noventa16,17. Desde então, diversos autores passaram a estudar a ação do TNF-? na reabsorção óssea associada ao colesteatoma18.
Yan e Huang11 (1991) estudaram o papel do TNF-? na reabsorção óssea promovida pelo colesteatoma. Estes autores analisaram cinco colesteatomas induzidos em animais de forma experimental e cinco fragmentos coletados em cirurgias. Eles observaram que os colesteatomas humanos e os experimentais apresentavam vários graus de processo inflamatório, com infiltrado mononuclear (linfócitos e macrófagos) e sinais de proliferação vascular. O estudo imunohistoquímico evidenciou a presença de TNF-? no tecido de granulação. Os autores observaram que a adição de TNF-? nas culturas de tecidos ósseos estimulava a formação de células multinucleares (osteoclastos) que produziam uma lacuna na superfície óssea (denominadas de lacunas de Howship). Desta forma, esses autores concluíram que o TNF-? está presente no tecido de granulação adjacente ao colesteatoma e age na reabsorção óssea11.
Marenda e Aufdemorte19 (1995) pesquisaram a presença de TNF-?, além de outras citocinas, em colesteatomas (coletados no ato cirúrgico) e compararam com fragmentos de pele normal do meato acústico externo (MAE). O TNF-? foi encontrado nas camadas supra-basais do colesteatoma e nos macrófagos e fibroblastos porém, não foi encontrado na camada basal, nem no MAE.
Amar et al.20 (1996) estudando a destruição óssea no colesteatoma dosaram a concentração de TNF-? em pacientes submetidos a cirurgia. Além disto, dividiram os colesteatomas em dois grupos: localizados e extensos (baseados no número de ossículos erodidos, na presença de erosão do canal do facial, da exposição da dura máter e do seio sigmóide). A concentração de TNF-? foi significativamente maior nos colesteatoma mais agressivos. Assim, Amar et al.20 (1996) concluíram que as citocinas, em especial o TNF-?, estão envolvidas diretamente na destruição óssea causada pelo colesteatoma, agindo como um fator de crescimento autócrino e, indiretamente, estimulando as lisosimas hidrolidases.
Chung e Yoon21 (1998) também analisaram a erosão óssea presente no colesteatoma. Os autores separaram o tecido subepitelial da porção epitelial do colesteatoma e realizaram culturas destes tecidos. Eles observaram que as células epiteliais só produziam interleucinas (citocinas semelhantes, na função, ao TNF-?) quando estavam associadas ao tecido subepitelial. Desta forma, os autores concluíram que as substâncias derivadas da perimatriz podem estimular a matriz do colesteatoma a produzir IL1 e conseqüentemente promover reabsorção óssea.
Sastry et al.7 (1999) dosaram o nível sérico de TNF-? em vinte pacientes normais (grupo controle) e em vinte pacientes que seriam submetidos à cirurgia por colesteatoma de orelha média. No ato cirúrgico os autores coletaram fragmentos de colesteatoma e observaram o grau de erosão óssea presente. Eles observaram que, nos pacientes submetidos à cirurgia otológica, o nível sérico (prévio) de TNF-? era significativamente maior. Também foram encontradas diferenças no nível sérico de TNF-? dependendo do grau de destruição óssea presente.
Akimoto et al.22 (2000) estudaram o papel do TNF-?, no processo inflamatório, nos colesteatomas congênitos e adquiridos. Eles observaram que os níveis de TNF-? e de IL-1 são mais elevados nos colesteatomas congênitos e nos adquiridos quando comparados à pele do meato acústico externo.
Yong-Soo et al.13 (2001) também procuraram observar a importância do TNF-? no processo inflamatório da orelha média analisando ratos com otite média secretora induzida com a injeção de endotoxinas de Psudomonas aeuroginosas, e observaram a possibilidade de inibir o processo inflamatório. Para isto dividiram os ratos em dois grupos. No primeiro foi injetada solução salina que continha um antagonista do TNF-? (sTNF RI), enquanto no segundo grupo, não. Os autores observaram que a injeção concomitante de sTNF RI inibia o processo inflamatório. Para eles, o uso de seu antagonista poderia ser um importante coadjuvante no tratamento das otites médias secretoras, prevenindo complicações e formação de colesteatoma.
Yetiser et al.23 (2002) compararam os níveis de TNF-? e IL-1 em dezesseis pacientes com otite média crônica sem e vinte e três com colesteatoma. Eles observaram níveis significativamente maior de IL-1 e TNF-? no segundo grupo e concluíram que a destruição óssea presente era mediada por estas citocinas.
Alves e Ribeiro18 (2004) revisaram o papel das citocinas no colesteatoma adquirido da orelha média. Os autores observaram uma discordância na literatura com relação à localização do TNF-? nas camadas do colesteatoma, não havendo um consenso sobre onde ele ficaria localizado. O TNF-?, segundo os autores, agiria como um mediador do processo de destruição óssea.
DISCUSSÃO
As citocinas são proteínas formadas no interior das células e, quando liberadas, interagem com receptores celulares (transmembrânicos) produzindo seu efeito biológico4. Dependendo do local onde agem, podem exercer uma ação autócrina (quando agem na própria célula que a produziu), parácrina (agem em células vizinhas) ou endócrina (agem à distância). Cada citocina possui múltiplas ações (efeito pleiotrópico) podendo agir em sinergismo ou antagonismo, como ocorre no sinergismo entre TNF-? e a interleucina 1 (IL-1), que são as principais citocinas liberadas no processo inflamatório4,5.
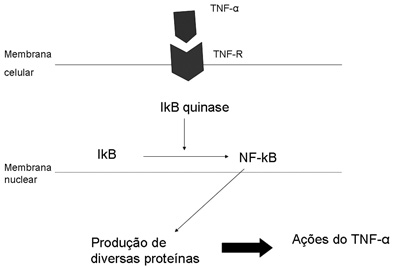
O TNF-? é produzido por macrófagos ativados ou, ainda, por linfócitos e monócitos. Após ligar-se a seus receptores o TNF-? vai estimular a transcrição e a produção da enzima IkB quinase, a qual irá produzir o fator nuclear kB (NF-kB). O NF-kb, quando ativado, irá agir no núcleo da célula, induzindo a produção de diversas proteínas envolvidas nas respostas inflamatória e imunológica responsáveis pelas principais ações biológicas do TNF-?8 (Figura 1).
Figura 1. Ação do TNF-á na célula. Após ligar-se ao seu receptor ele vai estimular a ativação do NF-B, que promoverá a produção e liberação de diversas substâncias envolvidas no processo inflamatório e imune.
A ação do TNF-? no colesteatoma começou a ser estudada no início da década de noventa, quando foi observada sua presença do TNF-? no colesteatoma16,17. Yan e Huang11 (1991) observaram que a adição de sobrenadante (após preparo) de fragmentos de colesteatoma à cultura de tecidos ósseos estimula a formação de células multinucleares e o aparecimento de lacunas em sua superfície. As células multinucleares, na verdade, são os osteoclastos responsáveis pela erosão óssea, que são encontrados nas lacunas formadas (lacunas de Howship). Desta forma, pode-se comprovar que o colesteatoma é capaz de promover reabsorção óssea através da liberação do TNF-?. O bloqueio do TNF-?, por sua vez, diminui a reabsorção óssea8,14,22. Desta forma, todos os autores estudados concordaram que o TNF-a é um dos principais responsáveis pela reabsorção e pela destruição óssea observada em doenças que cursam com um processo inflamatório crônico associado.
O osteoclasto é a principal célula envolvida na reabsorção óssea, sendo originado de monócitos e macrófagos. Ele irá agir diretamente na matriz óssea promovendo a erosão e remodelação óssea. O TNF-?, a IL-6, a IL-1 ? ou ?, a interleucina 11 (IL-11) e o fator estimulador de colônias de macrófagos (M-CSF) são os fatores responsáveis pela diferenciação e regulação da atividade dos osteoclastos. Estes fatores agem, portanto diretamente na reabsorção óssea8,10,12
Outros fatores, entretanto, têm uma ação indireta, agindo sobre os osteoblastos ou células de revestimento do osso, expondo a matriz óssea à ação do osteoclasto. Entre eles temos os hormônios da paratireóide, a prostaglandina, o estrogênio, a IL-11, a IL-1 ? ou ? e o TNF- ?. Este último age nas duas vias10,12.
Além disto, os osteoblastos liberam uma substância (RANKL), que tem a capacidade de estimular a diferenciação dos macrófagos em osteoclastos, existindo um sinergismo entre o TNF-? e o RANKL, os quais, conjuntamente, aumentam a ação dos osteoclastos por um mecanismo de cooperação11. Sendo assim, os autores que estudaram os mecanismos de ação do TNF-? acreditam que ele promove a reabsorção óssea, por meio de duas vias (direta e indireta)8,10,12, além de interagir com outras citocinas (RANKL e IL-1) neste processo11,13.
Todos os autores estudados concordam que o TNF-? está presente nos colesteatomas; não existe consenso, entretanto, quanto à sua localização. A diferença existente entre os autores foi resumida por Alves e Ribeiro18 (2004), em seu trabalho (Tabela 1).
O TNF-? é liberado em todos os processos infecciosos do ouvido médio e não somente no colesteatoma17,23. Entretanto, em outros processos infecciosos crônicos do ouvido não se observa a erosão óssea encontrada no colesteatoma. Chung e Yoon (1998)21 observaram que a interleucina (que estimula a matriz do colesteatoma a produzir erosão óssea) é liberada na perimatriz. Desta forma, quando se separa o tecido epitelial (matriz) do subepitelial (perimatriz) no colesteatoma não se observa as mesmas propriedades destrutivas. A diferença, portanto, pode ser explicada pela presença e distribuição dos receptores de TNF-? no epitélio (matriz) do colesteatoma. Entretanto, ainda não existem trabalhos suficientes, na literatura, que comprovem a localização dos receptores de TNF-? no colesteatoma, nem os fatores que aumentam a sua expressão.
Além dos receptores, a quantidade de TNF-? presente também parece estar relacionadacom a erosão óssea, sendo que vários autores procuraram relacionar os níveis de TNF-? com os achados intra-operatórios7,20,23. Nos colesteatomas que apresentavam um maior grau de destruição óssea as quantidades locais de TNF-? eram maiores7,20,23, sendo que resultados semelhantes foram observados tanto nos colesteatomas adquiridos quanto nos congênitos22. Entretanto, só existe um trabalho comparando colesteatoma congênitos com adquiridos, portanto isto precisa ser mais bem analisado. A concentração plasmática do TNF-?, em pacientes com colesteatoma que tinham variáveis graus de destruição óssea, é proporcionalmente bem maior do que em pacientes normais. Desta forma, pode-se estabelecer uma correlação entre os níveis sistêmicos de TNF-? e o comportamento local dele7. Isto possibilita talvez, no futuro, prever a agressividade do colesteatoma por meio de um exame de sangue, prevendo o grau de destruição óssea associado e, conseqüentemente, a possibilidade da existência de complicações.
Baseados nestes trabalhos, podemos observar que o TNF-? está relacionado e à erosão óssea, determinando também sua gravidade7,20,23. Existe um nível aumentado de TNF-?, tanto local quanto sistêmico, em colesteatomas mais agressivos. Nenhum destes autores, entretanto, estudou porque estes níveis estão aumentados. A diferença pode estar relacionada a diversos outros fatores, como por exemplo o tempo de evolução da doença, a intensidade da infecção local, ou ainda a presença e à distribuição dos receptores do TNF-? na matriz do colesteatoma. Entretanto, não existem, ainda, trabalhos suficientes na literatura para uma análise mais detalhada desta hipótese.
O TNF-? é um dos principais responsáveis pelo processo de reabsorção óssea e, conseqüentemente, pela presença de complicações em diferentes doenças. Por isto, após a descoberta do seu inibidor natural, surgiu a possibilidade de inibir o processo inflamatório observado nestas doenças crônicas, diminuindo a morbidade e mortalidade destes pacientes24-26. O primeiro estudo clínico em larga escala, com o uso destes inibidores em doenças sistêmicas demonstrou a eficácia desta terapia na inibição da reabsorção óssea27. Desde então, vem sendo estudada a inibição da destruição óssea, utilizando o bloqueio da ação do TNF-? com uso antagonistas ou anticorpos anti-TNF.
Na periodontite a injeção de solução contendo um antagonista de fator de necrose tumoral (s NF RI) inibe a formação de osteoclasto, diminuindo o recrutamento de células inflamatórias e reduzindo a perda óssea em 60%12,28. Desta forma, o uso de antagonistas do TNF-? é capaz de reduzir a erosão óssea.
Além do uso de antagonistas, a utilização de anticorpos anti-TNF-? também foi capaz de diminuir e retardar a destruição óssea presente na artrite reumatóide27. Deste modo, pode-se hoje inibir o processo de reabsorção óssea por meio de duas vias diferentes. Porém não existem trabalhos realizados em colesteatoma. Entretanto, embasado nestes dados, no futuro, pode ser possível um tratamento clínico com a inibição do processo inflamatório e com o controle da erosão óssea. Desta forma, poderia diminuir a morbidade e a mortalidade causada pelo colesteatoma.
CONCLUSÃO
O TNF-? está presente no colesteatoma, promovendo a reabsorção óssea por diferentes vias. Ele vai agir na diferenciação e na maturação dos osteoclastos (via direta) e, também, expondo a matriz óssea (via indireta). Entretanto, o TNF-? não é o único fator envolvido na reabsorção óssea, agindo conjuntamente com a interleucina 1 e o RANKL. Além disto, os níveis locais do TNF-? estão relacionados com o grau de erosão óssea presente na doença.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Ribeiro FAQ, Pereira CSB. Otite média crônica colesteatomatosa em: Tratado de otorrinolaringologia. 1ª ed. São Paulo: Editora Roca; 2003, pp.93-102.
2. Lessa HA; Freitas EB; Cruz OLM. Complicações das otites médias em: Tratado de otorrinolaringologia. 1ª ed. São Paulo: Editora Roca; 2003, pp 43-49.
3. Pereira CSB. Análise de estudos da expressão das citoqueratinas no colesteatoma adquirido. São Paulo; 1997 (dissertação - mestrado - Faculdade de Ciências Médicas da Santa Casa de São Paulo).
4. Hamblin AS. Cytokines and cytokine receptors. 2nd ed. New York: Oxford University Press; 1993.
5. Abbas AK, Lichtman AH, Pober JS. Citocinas. In: Imunologia celular e molecular. 2ª ed. Rio de Janeiro: Revinter 1998, pp.253-276.
6. Carswell EA, Old LJ, Kassel RL, Green S, Fiore N, Williamson B. An endotoxin-induced serum factor that causes necrosis of tumor. Proc Natl Acad Sci USA 1975;72:3666.
7. Sastry KVSSR, Sharma SC, Mann SBS, Ganguly NK e Panda NK. Aural cholesteatom: role of tumor necrosis factor-alpha in bone destruction. Am J Otol 1999;20:158-61
8. Bingham CO. The pathogenesis of rheumatoid arthritis: pivotal citokynes involved in bone degradation and inflammation. J Reum 2002;29 supl 65:3-9.
9. Iino K, Toryama M, Ogawa H, Kawakami M. Cholesteatoma debris as an activador of human monocytes. Acta otolaryngol 1990;110:410-15.
10. Kreutzer DL, Yellon RF, Leonard G, Marucha PT, Craven R, Carpenter RJ et al. Characterization of cytokines present in middle ear effusions. Laryngoscope 1991; 101:165-69.
11. Yan SD, Huang CC. The role of tumor necrosis fator-alpha in bone reabsorption of cholesteatoma.Am J otolaryngol 1991;12:83-9.
12. Assuma R, Oates T, Cochram D, Amar S, Graves DT. IL-1 and TNF antagonists inhibit the inflammatory response and bone loss in experimental periodontitis. J Immunol 1998;160(1):403-9.
13. Yong-Soo P, Sang WY, Young CC, Timothy TKJ. Effect of inhibitor of tumor necrosis factor-alpha on experimental otitis media with effusion. Ann Otol Laryngol 2001;110:917-21.
14. Goldring SR. Bone and joint destruction in rheumatoid arthritis: What is really happening? J Rheumatol Suppl 2002; 65:44-8.
15. Goldring SR, Gravallese EM. Pathogenesis of bone erosions in rheumatoid arthritis. Curr Opin Rheumato 2000;12(3):195-9,2.
16. Zhang YH, Heulsmann A, Tondravi MM, Mukherjee A, Abu-Amer Y. Tumor necrosis factor-alpha (TNF) stimulates RANKL-induced osteoclastogenesis via coupling of TNF type 1 receptor and RANK signaling pathways. J Biol Chem 2001;276(1):563-8.
17. Steeve KT, Marc P, Sandrine T, Dominique H, Yannick F. IL-6, RANKL, TNF-alpha/IL-1: interrelations in bone resorption pathophysiology.Cytokine & Grown factor reviews 2004;15:49-60.
18. Alves AL, Ribeiro FAQ. O papel das citocinas no colesteatoma adquirido da orelha média: revisão da literatura. RBORL 2004; 70(6):813-18.
19. Marenda SA; Aufdemorte TB. Localization of cytokines in cholesteatoma tissue. Otolaryngol Head Neck Surg 1995;112(3):359-68.
20. Amar MS; Wishahi HF; Zakhary MM Clinical and biochemical studies of bone destruction in cholesteatoma. Amer J Laryngol Otol 1996;110(6):534-9.
21. Chung JW; Yoon TH Different production of interleukin-1alpha, interleukin-1beta and interleukin-8 from cholesteatomatous and normal epithelium. Acta Otolaryngol 1998:118(3):386-91.
22. Akimoto R, Pawankar R, Yagi T, Baba S. Acquired and congenital cholesteatoma: determination of tumor necrosis factor-alpha, intercellular adhesion molecule-1,interleukin-1-alpha and lymphocyte functional antigen-1 in the inflammatory process. ORL 2000;62:257-65.
23. Yetiser S, Satar B, Aydin N. Expression of epidermal growth factor, tumor necrosis factor-alpha, and interleukin-1alpha in chronic otitis media with or without cholesteatoma. Otol Neurotol 2002;23(5):647-52.
24. Seckinger P, Isaaz S, Dayer JM. Purification and biologic characterization of specific tumor necrosis factor ? inhibitor. J Biolo Chem 1989;264:11966-73.
25. Olsson I, Lantz M, Nilsson E, Peetre C, Thysell H, Grubb A, e cols. Isolation and characterisation of tumor necrosis factor binding protein from urine. Eur J Hematol 1989;42:270-5.
26. Engelmann H, Aderka D, Rubintein M, Rotman D, Wallach D. A tumor necrosis factor-binding protein purified to homogeneity from human urine protects cells from tumor necrosis toxicity. J Biol Chem 1989; 264:11974-80.
27. Elliot MJ, Maini, RN, Feldmann M, Kalden JR, Antoni C, Smolen JS, e cols. Randomised double-blind comparison of chimeric monoclonal antibody to tumor necrosis factor alpha (cA2) versus placebo in rheumatoid arthritis. Lancet 1994;344:1105-10.
28. Lipsky PE, van der Heijde DM, St Clair EW, Furst DE, Breedveld FC, Kalden JR, Smolen JS, Weisman M, Emery P, Feldmann M, Harriman GR, Maini RN. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti-Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med 2000;343(22):1594-602.
1 Preceptor do serviço de residência em otorrinolaringolgoia da Clínica Otorhinus e do Hospital Santa Marcelina.
2 Professor Adjunto do Departamento de Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
Endereço para correspondência: R. Zacarias de Goes 1296 Pq. Colonial 04610-003 São Paulo SP.
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 30 de junho de 2005. cod. 477.
Artigo aceito em 2 de julho de 2006.