Ano: 2006 Vol. 72 Ed. 4 - Julho - Agosto - (14º)
Seção: Artigo Original
Páginas: 528 a 532
Mioepitelioma de glândula salivar menor: uma análise imunohistoquímica de quatro casos
Myoepithelioma of minor salivary gland - An immunohistochemical analysis of four cases
Autor(es): Éricka Janine Dantas da Silveira1, Antonio Luiz Amaral Pereira2, Maria Carmen Fontora3, Lélia Batista de Souza4, Roseana de Almeida Freitas5
Palavras-chave: glândula salivar menor, imuno-histoquímica, mioepitelioma.
Keywords: minor salivary gland, immunohistochemical, myoepithelioma.
Resumo:
Introdução e Metodologia: Realizou-se um estudo imunohistoquímico em 4 casos de mioepiteliomas, visando traçar seu perfil quanto ao grau de diferenciação das células através dos anticorpos alfa-SMA, CK 14 e vimentina, bem como investigar o índice de proliferação celular pelo anti-PCNA, além de comparamos a imunorreatividade com o tecido glandular normal adjacente ao tumor. Resultados: No tecido glandular normal as células mioepiteliais exibiram marcação para alfa-SMA e CK 14, enquanto que nas células ductais somente a presença da CK 14 foi verificada. Em todos os casos foi verificada positividade para CK 14 e vimentina, porém a CK 14 esteve presente somente em células epitelióides e fusiformes, enquanto que a vimentina mostrou-se positiva também nas células plasmocitóides. A alfa-SMA não foi detectada nas células neoplásicas. Imunopositividade para o PCNA foi observada em mais de 75% do componente celular dos tumores analisados, independente do tipo. Conclusões: Concluiu-se que não houve diferença na atividade proliferativa entre os tipos celulares presentes nos mioepiteliomas e, ainda, que os resultados deste estudo sugerem que as células constituintes desta neoplasia realmente representam células da linhagem mioepitelial, mas em diferentes estágios de diferenciação.
Abstract:
Introduction and Methods: We performed an immunohistochemical study in four cases of myopitheliomas with objective to realize a profile in respect of differentiation grade by the monoclonal antibodies CK14, vimentin and alph-SMA, besides to investigate the cell proliferation by anti-PCNA, besides, we compare the immunoreactive with glandular normal tissue. Results: In the glandular normal tissue the myoepithelials cells had shown expression for alpha-SMA and CK 14, while that in the ductals cells, only the presence of CK 14 was verified. All the cases was verified positivy for CK 14 and vimentin, however, CK 14 had been present only in epithelioid and fusiform cells, while that the vimentin revealed positive also in the cytoplasm of the plasmocytoid cells. alpha-SMA was not detected in the neoplasic cells. Immunopositivity for the PCNA was observed in more than 75% of the cellular component of the analyzed tumors, independent of the cellular type. Conclusions: We concluded that it did not have difference in the proliferative activity among the cellular types presents in the myoepitheliomas and, still, the results of this study suggest that the constituent cells of this neoplasia one really represent cells of the mioepitelial ancestry, but in different stages of differentiation.
![]()
INTRODUÇÃO
O mioepitelioma é uma neoplasia benigna rara de glândula salivar, mais comum em glândula parótida1,2, compreendendo menos de 7% dos tumores de glândula salivar, tendo sido descrita pela primeira vez em 19433,4. Tal lesão mostra variado padrão de crescimento morfológico, podendo ser sólido, mixóide ou reticular, com diferenciação mioepitelial, diferindo do adenoma pleomórfico por não exibir componente ductal5.
A morfologia celular deste tumor é variada, com células em um padrão fusiforme, plasmocitóide, epitelióide ou clara6. Alguns estudos têm demonstrado que as células fusiformes exibem diferenciação muscular por serem reativas para a-SMA e vimentina4, enquanto outras pesquisas não evidenciam qualquer diferenciação muscular nas células plasmocitóides4,7. Segundo Jaeger et al. (1997), estas células poderiam não ser de origem mioepitelial tendo perdido ou modificado sua capacidade de expressar marcadores de evidência muscular.
Além dos vários fenótipos que as células dos mioepiteliomas podem exibir, alguns autores relatam que as células fusiformes e claras apresentam atividade proliferativa mais alta, quando comparadas com as células plasmocitóides, assim como, afirmando, ainda, que a produção de material mixóide estaria relacionada com a baixa atividade proliferativa nestes tumores9.
Encontra-se na literatura a utilização de vários marcadores indicadores de atividade proliferativa e de origem histogenética tanto em glândula salivar normal, como nos tumores benignos e malignos de natureza epitelial glandular. Dessa forma, constitui objetivo desta pesquisa analisar, através da imunohistoquímica, os padrões de diferenciação, bem como a atividade proliferativa dos variados tipos celulares presentes em mioepteliomas de glândula salivar.
MATERIAL E MÉTODOS
Foram selecionados 4 casos de mioepiteliomas de glândula salivar menor dos arquivos do Serviço de Anantomia Patológica do Laboratório de Patologia Oral do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte. Dos espécimes incluídos em parafina, foram obtidos cortes de 5mm de espessura, os quais foram submetidos à técnica da hematoxilina e eosina para análise morfológica celular.
Foi realizado um estudo imunohistoquímico pela técnica da estreptavidina-biotina, utilizando-se os anticorpos contra vimentina, a-SMA, CK 14 e PCNA (Antígeno Nuclear de Proliferação Celular). Os clones dos anticorpos utilizados, a recuperação antigênica, a diluição, tempo de incubação e o fabricantes, encontram-se listados no Quadro 1.
Todo o material selecionado encontrava-se fixado em formol e emblocado em parafina, sendo feitos cortes histológicos de 3?m e colocados sobre laminas contendo adesivo à base de 3-aminopropyltriethoxy-silano (Sigma Chemical CO., St. Louis, MO, USA). Os cortes histológicos foram desparafinados em xilol, re-hidratados em seqüência de álcool até a água e lavados em duas águas destiladas por 5 min cada. Foi feito o bloqueio da peroxidase endógena com peróxido de hidrogênio 20vol, lavadas em água e incubadas em TRIS-HCL (Tris-hydroximethil-aminometano), pH 7,4 por 10 min. Os cortes foram encubados com anticorpo monoclonal anti-camundongo, diluído em solução tampão de TRIS-HCL (Quadro 1), para incubação com o complexo Estreptoavidina-Biotina, em diluição de 1:100 por 30 min. Para revelação foi utilizada a solução cromógena de diaminobenzidina a 0,03%, diluída em TRIS-HCL adicionada de 0,6ml de peróxido de hidrogênio 20vol em câmara escura por 3 min e como contracoloração a Hematoxilina de Mayer por 10 min, lavando em água após cada passo. Finalizando o processo fez-se a desidratação em álcool e diafanização em xilol para montagem da lamínula com Permount.
Fragmentos de glândula salivar normal foram usados como controle interno positivo e para fins comparativos.
A análise da imunopositividade foi realizada por dois examinadores em momentos distintos, em um estudo duplo-cego através da microscopia de luz, sendo consideradas positivas todas as células que exibiram coloração morrom no seu citoplasma ou núcleo (PCNA). Dessa forma, foi verificada a ausência ou presença de marcação, atribuindo-se os escores: - (ausência de marcação); + (marcação focal, menos de 10% de células marcadas) e ++ (marcação difusa).
RESULTADOS
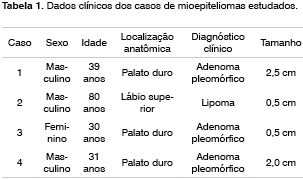
Os dados clínicos dos pacientes encontram-se listados na Tabela 1.
Resultados Morfológicos
Os tumores eram bem circunscritos, sendo freqüentemente observada uma cápsula de tecido conjuntivo fibroso na periferia dos espécimes. Os quatro tumores apresentavam um padrão de crescimento e organização celulares predominantemente sólidos. Os espécimes eram compostos de ninhos de células coesivas e não-coesivas em uma matriz ora hialina, ora mixóide. As células tumorais exibiam morfologia variada, mostrando-se mais freqüentemente com aparência fusiforme, poligonais de citoplasma eosinofílico (epitelióides) e, por vezes, plasmocitóides com núcleo hipercromático. Nenhuma lesão exibiu áreas de necrose, porém metaplasia escamosa e calcificações foram encontradas em um caso.
Resultados Imunohistoquímicos
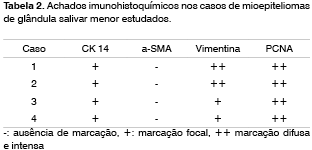
A marcação imuno-histoquímica para os anticorpos analisados pode ser verificada nas Figuras 1 e 2.
Todos os casos exibiram imunopositividade para CK 14 e vimentina. Entretanto, a CK 14 esteve presente somente em células epitelióides e fusiformes, enquanto que a vimentina esteve presente também no citoplasma das células plasmocitóides. A a-SMA não foi detectada nas células neoplásicas, apesar de estar presente em vasos sanguíneos, os quais foram utilizados como controle interno positivo.
Imunopositividade para o PCNA foi observada em mais de 75% do componente celular dos tumores analisados, independentemente do tipo celular e da quantidade de estroma presente.
Adjacente a 2 dos 4 mioepiteliomas analisados foi observada presença de tecido glandular normal constituído predominantemente por ácinos mucosos e ductos. Neste tecido, as células mioepiteliais exibiram marcação para a-SMA e CK 14. Nas células ductais detectou-se imunomarcação para CK 14. A imunorreação para os anticorpos analisados nos mioepiteliomas encontra-se listada na Tabela 2.
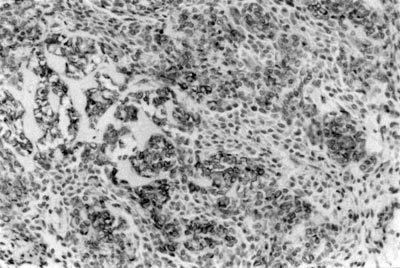
Figura 1. Expressão da CK 14 em células epitelióides e fusiformes em mioepitelioma de glândula salivar menor (SABC, 200x).
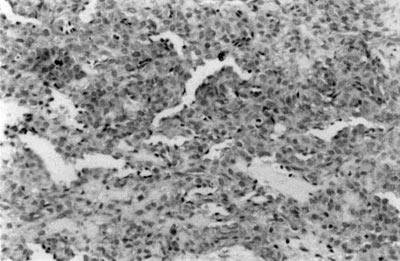
Figura 2. Imunomarcação da vimentina em mioepitelioma de glândula salivar menor (SABC, 200x).
DISCUSSÃO
O mioepitelioma benigno de glândula salivar é uma neoplasia de freqüência rara e natureza mioepitelial, composto de células fusiformes, epitelióides, plasmocitóides e claras10. Para alguns autores, como Simpson et al. (1995) esta neoplasia se constitui em um tipo raro de adenoma pleomórfico. Entretanto, de acordo com Dardick et al. (1995), este difere do adenoma pleomórfico por exibir pouco ou nenhum componente ductal.
Um aspecto de interesse sobre os mioepiteliomas está nas poucas informações sobre seu comportamento biológico, devido a sua baixa freqüência. Alguns autores consideram que o mesmo é mais agressivo do que os adenomas pleomórficos11, enquanto outra pesquisa verificou, através da análise da expressão do PCNA, não haver diferenças na atividade proliferativa entre mioepiteliomas e adenomas pleomórficos9.
Ogawa et al. (1993) relataram que a cinética celular relaciona-se ao comportamento biológico de vários tumores, verificando em sua pesquisa que mioepiteliomas compostos de células fusiformes, epitelióides e claras mostraram maiores proporções de células PCNA positivas em comparação com o tipo plasmocitóide, confirmando a baixa atividade proliferativa nesse tipo, achados estes diferentes da presente pesquisa em virtude do PCNA estar marcado em mais de 75% dos tumores analisados, independente do tipo celular.
As células mioepiteliais, constituintes desta neoplasia, também são componentes de vários outros tumores de glândula salivar. Segundo relatos de Araújo et al. (1994) e Batsakis e El-Naggar (1999) essas células estão envolvidas em vários processos relacionados ao desenvolvimento neoplásico, como diferenciação das células tumorais, síntese de componentes da membrana basal e supressor tumoral maspin, além de inibir invasão e angiogênese. Foi verificado nos estudos de Capuano e Jaeger (2004) que a presença de constituintes da matriz, como da laminina, por exemplo, pode induzir mudanças na morfologia de mioepiteliomas, induzindo a um fenótipo constituído por células plasmocitóides.
Para Jaeger et al. (1997) uma razoável proporção de células fusiformes nos mioepiteliomas indica diferenciação muscular, reagindo positivamente para a a-SMA e vimentina, sendo estas denominadas de "myoepithelial like".
Em relatos de Ellis e Auclair (1996) consta que com exceção das células fusiformes e algumas epitelióides, a natureza das células plasmocitóides dos mioepiteliomas ainda não está esclarecida. Jaeger et al. (1997) relataram ainda que estas células não mostram qualquer evidência de diferenciação muscular. Ogawa et al. (2003) acreditam que estas células se originam de células luminais e não de células mioepiteliais, adicionando ainda que os tumores constituídos de células plasmocitóides poderiam ser classificados em adenomas ou adenocarcinomas plasmocitóides.
Marcadores imunohistoquímicos para células mioepiteliais têm incluído a proteína S-100, GFAP, citoqueratinas e vimentina, além do a-SMA, o qual se encontra associado a células mioepiteliais de glândula salivar normal7. A vimentina foi considerada por Araújo et al. (1994) como sendo um marcador de célula mioepitelial neoplásica. Já nos estudos desenvolvidos por esse grupo em 200114, foi sugerido que esta proteína não é exclusiva de células mioepiteliais neoplásicas, já que pode estar presente também em outros tipos celulares originados do ducto intercalado.
De acordo com Hornick e Futcher (2004), as células miopiteliais neoplásicas freqüentemente perdem a expressão de marcadores de diferenciação muscular, quando então, a imunorreatividade a estes marcadores não é requerida para confirmar a diferenciação mioepitelial. Por esta razão, a fraca expressão de marcadores musculares tem conduzido os autores a considerarem os mioepiteliomas plasmocitóides como mioepiteliomas verdadeiros, apesar de Franquemont e Mills (1993) não acreditarem na natureza mioepitelial deste tipo celular, sugerindo que o subtipo plasmocitóide não seria um tipo de mioepitelioma.
Diante de tantas controvérsias na literatura no tocante à natureza das células dos mioepiteliomas, o presente estudo analisou a diferenciação e natureza dos constituintes celulares de mioepiteliomas de glândula salivar menor, usando marcadores de diferenciação epitelial como a CK 14 e de diferenciação muscular como a-SMA e vimentina.
As citoqueratinas são proteínas dos filamentos intermediários das células epiteliais associadas com a diferenciação e organização do citoesqueleto, sendo expressas em células epiteliais específicas dependendo do seu estágio de diferenciação. Segundo Ogawa et al. (1999) e Ogawa et al. (2000), as células mioepiteliais em glândula salivar expressam CKs 5 e 14, ressaltando-se que estas não servem como marcadores específicos para estas células pois são expressas também por células basais ductais, onde as CKs 18 e 19 também encontram-se presentes.
A CK 14 esteve presente nas células mioepiteliais (não-luminais), tanto de morfologia fusiforme, epitelióide como plasmocitóides dos adenomas pleomórficos estudados por Ogawa et al. (2003), o que discorda dos achados da presente pesquisa na qual a CK 14 só esteve imunomarcada em células fusiformes e epitelióides, discordando também dos estudos de Araújo et al. (2001) onde foi encontrado marcação para CKs 14 e 19 em células plasmocitóides e não nas fusiformes.
Já a vimentina encontrada em todos os tipos celulares neste estudo, também esteve presente em todos os tipos celulares dos mioepiteliomas analisados na pesquisa de Araújo et al. (2001) e, ocasionalmente, nas células não-luminais dos adenomas pelomórficos estudados por Ogawa et al. (2003). Estes últimos autores reforçam a hipótese de que esta proteína não é um marcador exclusivo de célula mioepitelial neoplásica, justificando que a mesma é necessária para migração das células epiteliais em processos patológicos e fisiológicos, estando a vimentina presente, também, durante o desenvolvimento após este processo em alguns segmentos de glândula salivar normal.
A ausência da a-SMA nos casos aqui estudados e a imunorreatividade para vimentina foi detectada também nas pesquisas de Savera et al. (1997) e Ogawa et al. (2003), respectivamente.
Diante desses achados, acreditamos que todos os tipos morfológicos das células constituintes dos mioepiteliomas representam células da linhagem mioepitelial, em estágios bastante variados de sua evolução, discordando das conclusões de Ogawa et al. (2003). As controvérsias existentes na literatura no tocante à expressão de marcadores musculares tanto em células fusiformes e epitelióides como plasmocitóides pode ser justificado pelo fato de tais células poderem exibir estágios distintos de diferenciação, ou estas terem perdido ou modificado sua capacidade de produzir marcadores musculares. Adicionalmente, pode-se sugerir que a fraca diferenciação muscular "in vivo" em algumas células constituintes dos mioepiteliomas poderia ser devido ao processo inibitório mediado pela matriz extracelular.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Das DK, Haji BE, Ahmed MS, Hossain MN. Myoepithelioma of the parotid gland initially diagnosed by fine needle aspiration cytology and immunocytochemistry: a case report. Acta Cytol 2005;49(1):65-70.
2. Lee MW, Nam SY, Choi HJ, Choi JH, Moon KC, Koh JK. Myoepithelioma of parotid gland presenting as infra-auricular subcutaneous mass. J Cutan Pathol 2005;32(3):240-4.
3. Simpson RHW, Jones H, Beasley A. Benign myoepithelioma of the salivary glands: a true entity? Histopathol 1995;27:1-9.
4. Takai Y, Dardick I, Mackay A, Burford-Mason A, Mori M. Diagnostic criteria for neoplastic myoepitelial cells in pleomorphic adenomas and myoepitheliomas. Immunohistochemical detection of muscle-specific actin, cytokeratin 14, vimentin and glial fibrillary protein. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995;79:330-41.
5. Dardick I. Myoepithelioma: definitions and diagnostic criteria. Ultrastruct Pathol 1995;19:335-45.
6. Capuano AC, Jaeger RG. The effect of laminin and its peptide SIKVAV on a human salivary gland myoepithelioma cell line. Oral Oncol 2004;40(1):36-42.
7. Araújo VC, Carvalho YR, Araújo NS. Actin versus vimentin in myoepithelial cells of salivary gland tumors. A comparative study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1994;77(4):387-94.
8. Jaeger RG, de Oliveira PT, Jaeger MM, de Araujo VC. Expression of smooth-muscle in cultured cells from human plasmocytoid myoepithelioma. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1997;84(6):663-667.
9. Ogawa I, Miyauchi M, Takata T, Vuhahula E, Ijuhin N, Nikai H. Proliferative activity if salivary gland pleomorphic adenomas and myoepitheliomas as evaluated by the proliferating cell nuclear antigen (PCNA) labeling index (LI). J Oral Pathol Med 1993;22(10):447-50.
10. Ellis GL, Auclair PL. Tumors of the salivary glands. Atlas of tumor pathology, 3rd series, fascicle 17. Washington, DC: Armed Forces Institute of Pathology; 1996.
11. Seifert G, Sobin LH. Histological typing of salivary gland tumors. Word Health Organization International Classification of tumors. 2nd ed. Springer Verlag. Berlin Heidelberg New York; 1998.
12. Batsakis JG., El-Naggar AK. Myoepithelium in salivary and mammary neoplasms is host-friendly. Adv Anat Pathol 1999;6:218-26.
13. Ogawa Y, Kishino M, Atsumi Y, Kimoto M, Fukuda Y, Ishida T et al. Plasmacytoid cells in salivary-gland pleomorphic adenomas: evidence of luminal cell differentiation. Virc Arch 2003;443(5):625-34.
14. Araujo VC, de Sousa SO, Carvalho YR, de Araujo NS. Application of immunohistochemistry to the diagnosis of salivary gland tumors. Appl Immunohistochem Mol Morphol 2001;8(3):195-202.
15. Hornick JL, Fletcher CDM. Cutaneous myoepithelioma: A clinicopathologic and immunohistichemical study of 14 cases. Human Pathol 2004;35(1):14-24.
16. Franquemont DW, Mills G. Plasmocytoid monomorphic adenoma of salivary glands. Absence of myogenous differentiation and comparison to spindle cell myoepithelioma. AM J Surg Pathol 1993;17:146-53.
17. Ogawa Y, Yamauchi S, Ohnishi A, Ito R, Ijuhin N. Immunohistochemistry of myoepithelial cells during development of the rat salivary glands. Anat Embryol 1999;200(2):215-28.
18. Ogawa Y, Toyosawa S, Ishida T, Ijuhin N. Keratin 14 immunoreactive cells in pleomorphic adenomas and adenoid cystic carcinomas of salivary glands. Virch Arch 2000;437(1):58-68.
19. Savera AT, Gown AM, Zarbo RJ. Immunolocation of three novel smooth muscle-specific proteins in salivary gland pleomorphic adenoma: assessment of the morphogenetic role of myoepithelium. Mod Pathol 1997;10:1093-100.
1 Mestre em Patologia Oral/UFRN, Doutoranda em Patologia oral/UFRN.
2 Doutorando do Programa de Pós-Graduação em Patologia Oral do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte.
3 Doutorando do Programa de Pós-Graduação em Patologia Oral do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte.
4 Professora Doutora do Programa de Pós-Graduação em Patologia Oral/UFRN, Professora Adjunta de Patologia Oral da UFRN.
5 Professora Doutora do Programa de Pós-Graduação em Patologia Oral/UFRN, Professora Adjunta de Patologia Oral da UFRN.
Universidade Federal do Rio Grande do Norte.
Endereço para correspondência: Roseana de Almeida Freitas - Universidade Federal do Rio Grande do Norte Departamento de Odontologia Programa de Pós-Graduação em Patologia Oral - Av. Senador Salgado Filho 1787 Lagoa Nova 59056-000 Natal RN.
Tel/Fax: (0xx84) 3215-4138 - E-mail: roseana@dod.ufrn.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 7 de dezembro de 2005.
Artigo aceito em 10 de maio de 2006.