Ano: 2006 Vol. 72 Ed. 2 - Março - Abril - (9º)
Seção: Artigo Original
Páginas: 210 a 216
Efeitos da inalação passiva da fumaça de cigarro sobre as pregas vocais de ratos
Effects of passive smoke inhalation on the vocal cords of rats
Autor(es): Josilene Luciene Duarte1, Flavio Augusto Cardoso de Faria2, Danielle Santi Ceolin3, Tania Mary Cestari4, Gerson Francisco de Assis5
Palavras-chave: pregas vocais, ratos, fumaça, tabaco
Keywords: vocal fold; rats; smoke; tobacco.
Resumo:
Poucos estudos demonstram as reações patológicas devidas à inalação de fumaça pelas vias aéreas de ratos. Objetivo: Estudar e analisar os possíveis efeitos histopatologicos produzidos pela inalação crônica de fumaça de cigarro nas pregas vocais de ratos. Desenho de Estudo: Experimental. Material e Método: 36 ratos masculinos (Rattus norvergicus Wistar), de 60 dias de idade, foram mantidos em gaiolas e expostos à inalação da fumaça produzida por 10 cigarros, 3 vezes ao dia, 7 dias por semana, para períodos de 25, 50 e 75 dias, e os controles respectivos. Os animais foram sacrificados e as suas laringes dissecadas e submetidas a análise histológica com coloração de Hematoxilina e Eosina e analisados através de microscopia simples. Resultados: Os ratos expostos ao cigarro exibiram menor (p <0,05) massa corporal que o grupo controle. Havia hiperplasia e metaplasia escamosa na extremidade livre da prega vocal e hiperplasia escamosa na porção mediana da prega vocal em todos os 3 períodos de estudo. Além disso, o grupo de 50 dias revelou metaplasia com queratinização nesta área. Não foram observadas alterações morfológicas em outras áreas da laringe e reação inflamatória da lâmina propria. Conclusão: Foi concluído que a inalação passiva de fumaça de cigarro rende mudanças morfológicas importantes no epitélio da prega vocal que podem, eventualmente, progredir para neoplasia.
Abstract:
Few studies have demonstrated the pathologic reactions yielded by smoke inhalation on the airway in rats. Aim: The aim of this study was to analyze the possible histopathological effects produced by chronic cigarette smoke inhalation on the vocal folds of rats. Study design: Experimental. Material and Method: 36 male rats (Rattus norvergicus Wistar strain), aged 60 days, were kept in cages and exposed to inhalation of the smoke produced by 10 cigarettes lit 3 times a day, 7 days a week, for periods of 25, 50 and 75 days, and their respective controls. Thereafter the animals were killed and their larynxes were dissected and submitted to histological processing for achievement of histological sections, which were stained with Hematoxylin and Eosin and analyzed by light microscopy. Results: The rats exposed to smoke displayed smaller (p< 0,05) body mass than the control group. There was hyperplasia and squamous metaplasia in the free edge of the vocal fold and squamous hyperplasia on the middle portion of the vocal fold in all 3 study periods. Moreover, the 50-day group revealed keratinizing metaplasia in this area. Morphological alterations in other areas of the larynx and inflammatory reaction of the lamina propria were also not observed. Conclusion: It was concluded that the passive inhalation of cigarette smoke yields important morphological changes in the vocal fold epithelium, which may progress to neoplasia.
![]()
INTRODUÇÃO
Apesar dos avanços médicos na compreensão nos mecanismos de agressão produzidos por fumaça de tabaco no gênero humano, o cigarro é ainda a causa isolada mais importante de morte precoce nos Estados Unidos e o maior fator de ocorrência de várias doenças (Sherman, 1991)1. No ano 2030, fumar pode ser a principal causa isolada de mortalidade e pode vir a causar 10 milhões de mortes anualmente (Menezes et al. 2002)2. Assim, campanhas contra o fumo são a prioridade atual de instituições internacionais como a Organização Mundial de Saúde (OMS 1997)3. Neste começo de século, não só periódicos especializados, mas também a imprensa falada e escrita tem focalizado este assunto com freqüência.
De acordo com a União Internacional Contra Câncer (IUAC), aproximadamente 95% dos casos de câncer de laringe são relacionados a fumar, e a probabilidade é aumentada quando associado a álcool (Franceschi et al. 2000; Levi, 1999)4,5. Este tipo de câncer é diagnosticado facilmente e altamente curável enquanto na fase inicial, e a rouquidão persistente é o primeiro sintoma.
Mais de 400 substâncias químicas são isolados da fumaça de cigarro das quais, 250 são geradas pelo tabaco processado, enquanto as substâncias remanescentes representam adição de pesticidas, componentes orgânicos e metálicos (Dube e Green, 1982)6. São achados radicais livres relativamente estáveis na fase de partículas que podem reduzir a molécula de oxigênio a superóxido e, ocasionalmente, pode produzir peróxido de hidrogênio e radicais hidroxílicos (Churg e Pryor, 1985; Nakayoma et al., 1984)7,8. Componentes radioativos também estão presentes tanto no tabaco quanto na fumaça de cigarro, inclusive chumbo (210 Pb) e polônio (210 Po), que contribuem ao potencial carcinogênico do tabaco (Block e Bretthaaver, 1968; Cruze, 1984)9,10. Também podem ser achadas várias outras substâncias tóxicas, como monóxido de carbono.
Entre os danos sofridos fumando, seu potencial carcinogênico é seguramente um dos aspectos mais importantes. A fumaça de cigarro contém agentes que podem contribuir para completar a transformação carcinogênese, seja iniciando, promovendo e apressando os agentes agressores (Serviço de Saúde Pública dos Estados Unidos, 1982)11.
As manifestações histopatológicas que a maioria dos autores relatam nas vias respiratórias de fumantes são a hiperplasia secretória e hipertrofia. Estas alterações podem ser interpretadas como uma resposta adaptativa da área respiratória quando submetida a uma agressão crônica. Então, a presença de uma camada mais grossa de muco proveria uma envoltura protetora para a passagem de irritantes para o interior do epitélio respiratório (Cendon, 1997)12.
A fumaça de cigarro é considerada indutora de tumores de laringe em hamsters (Homburger, 1975)13 e pelo menos um estudo demonstrou um aumento de 1% a 9% na incidência de tumores pulmonares adenomatosos (Dalbey et al. 1980)14. Porém, este tipo de tumor é diferente do carcinoma escamoso observado predominantemente em fumantes humanos.
Poucos foi feito para observar as reações patológicas induzidas por inalação de fumaça de cigarro em ratos em suas vias aéreas inteiras, incluindo a laringe. Em um estudo administrado por Haussmann et al. (1998)15, a laringe foi considerada como o órgão mais sensível para mudanças histopatológicas após a exposição à fumaça de cigarro. Foram achados metaplasia escamosa difusa do epitélio pseudoestratificado e hiperplasia escamosa na base da epiglote, dependendo da dose.
Embora alguns estudos apresentem dados morfológicos na laringe de animais como um modelo experimental de exposição ao fumo, mais estudos são exigidos para caracterizar melhor estas alterações.
Este estudo tem como objetivo fazer uma análise morfológica subjetiva do possível efeito histopatológico na área da laringe de ratos submetida à inalação crônica de fumaça de cigarro, especialmente nas pregas vocais, por meio de microscopia simples.
MATERIAL E MÉTODO
Trinta e seis ratos machos (Rattus norvergicus Wistar) de aproximadamente 60 dias de vida e massa corporal ao redor de 180 gramas do laboratório animal de FOB/USP foram incluídos neste estudo. Foram mantidos grupos de seis animais em gaiolas limpas a cada dois dias sob condições semelhantes de luz e temperatura, e recebendo comida e água "ad libitum."
Três grupos de seis animais foram expostos diariamente a inalação de fumaça produzida por dez cigarros acesos de manhã, à tarde e à noite, somando trinta cigarros/dia, durante a semana inteira (Cendon et al. 1997)12. Os animais de cada grupo foram sacrificados 25, 50 e 75 dias depois da exposição, respectivamente. Os animais controle foram sacrificados no mesmo período para cada grupo de estudo.
O sistema de inalação empregado incluiu uma caixa de madeira que media 28x38x48cm que foram divididos em dois compartimentos iguais por uma tela de aço. Um compartimento foi empregado para colocação dos animais e o outro, para os cigarros. Uma bomba de respiração modelo 16/24, C.F.Palmer (Londres), foi adaptada à caixa de madeira e emitiu um fluxo de ar de 450ml/minuto, enquanto os cigarros foram mantidos acesos durante pelo menos dez minutos. Orifícios pequenos para drenagem de ar foram feitos no compartimento dos animais, permitindo que a fumaça escapasse.
A marca de cigarro selecionada foi Derby, Kingsize, devido a sua posição de liderança nas vendas de cigarros, provavelmente por causa de seu baixo custo e conteúdo de alcatrão alto (alcatrão - 12mg; nicotina - 0.9mg; monóxido de carbono - 12mg).
Depois da exposição os animais foram anestesiados e suas massas corporais medidas em uma balança de precisão e suas laringes removidas e imersas em fosfato de formalina tamponada a 10% durante 24 horas à temperatura ambiente. A anestesia foi alcançada por 0.1ml de Dopalen (cloridrato de ketamina) + 0.1ml de Anasedan (cloridrato de xylazina) + 0.1ml de sulfato de atropina. Depois do período de fixação, as laringes foram submetidas a processo histológico com desidratação em etanol, diafanização em xylol e embutidas em resina, para a realização de seções transversais. Antes deste procedimento, os espécimes foram mantidos em um agente de demineralizante (EDTA) durante 10 dias, porque um estudo de piloto tinha demonstrado mineralização da porção ventral da cartilagem tiróide. Depois disso, foram obtidas 5µm seções grossas semiconsecutivas e coloração com Hematoxilina e Eosina (H.E.) e analisadas através de microscopia simples, com comparação entre os grupos de estudo e controle, os aspectos morfológicos diferenciais, principalmente do epitélio e tecido conjuntivo (lâmina própria) da mucosa laríngea, especialmente das pregas vocais.
RESULTADOS
Massa Corporal
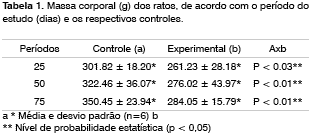
A análise estatística dos resultados no Quadro 1 demonstra que os animais no grupo de estudo apresentavam massa corporal 14%, 15% e 19% (p <0.05) abaixo dos controles respectivos nos grupos de 25, 50 e 75 dias de seguimento, respectivamente.
Descrição Morfológica
Controle
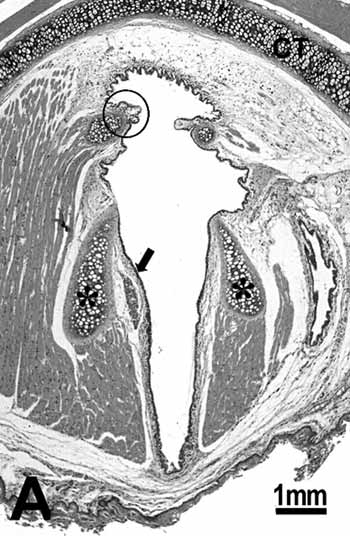
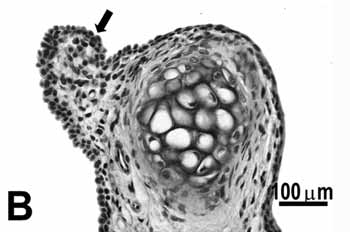
As seções histológicas dos animais no grupo controle demonstraram que a região glótica do rato é formada por três tipos de epitélio. O epitélio da porção ventral é pseudoestratificado ciliado e a lâmina própria exibe um tecido conjuntivo frouxo composto de poucas fibras colágenas e elásticas, enquanto os fibroblastos, mastócitos e macrófagos são as células mais evidentes. Um epitélio de colunar estratificado pequeno é observado perto da extremidade livre das pregas vocais (Figura 1B), e a lâmina própria revela um tecido conjuntivo mais denso seguido por pericôndrio. A porção mediana das pregas vocais (Figura 1C), perto da cartilagem aritenóide, é constituído por um epitélio escamoso estratificado que está mais fino na porção superior da cartilagem e mais espesso na porção mediana; a lâmina própria nesta área é formada por um tecido conjuntivo frouxo composto de poucas fibras de colágeno, fibras elásticas, fibroblastos, vasos sanguíneos e alguns macrofagócito. A porção dorsal da glote exibe um epitélio estratificado que pode ser prismático ou escamoso dependendo da área examinada, e o tecido conjuntivo na lâmina própria é mais denso. Mais anteriormente, esta área apresentou cartilagens da lâmina tiróide e da aritenóide, fibras de músculo estriado esquelético, feixes nervosos e glândulas seromucosas (Figura 1A).
Grupo de estudo - 25 dias
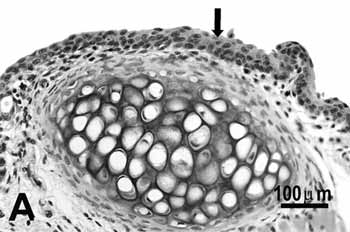
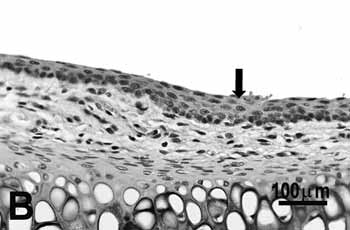
O tipo de epitélio e a lâmina própria eram semelhantes ao grupo controle de 25 dias em quase todas áreas da laringe examinadas. Porém, os animais expostos à fumaça de cigarro revelaram metaplasia associada à hiperplasia moderada na extremidade livre das pregas vocais, i.e. o epitélio mudou de cuboidal para escamoso (Figura 2A) e apresentou um aumento moderado na porção mediana das pregas vocais, perto da cartilagem aritenóide (Figura 2B). Nenhum vaso congestionado ou aumento nas células inflamatórias pode ser achado no tecido conjuntivo destes animais.
Grupo de estudo - 50 dias
Nenhuma mudança foi observada no epitélio ou lâmina própria em ambas às regiões ventrais e dorsais da laringe nos animais deste grupo. A extremidade livre das pregas vocais apresentou o mesmo tipo de metaplasia escamosa observada nos animais no grupo de estudo de 25 dias (Figura 2C). Porém, a mudança mais notável foi a presença de hiperplasia escamosa na porção mediana das pregas vocais (também observada no grupo de estudo de 25 dias) e metaplasia com queratinização nesta área do epitélio (Figura 2D).
Foram observados vasos sanguíneos congestionados ao longo do lâmina própria da laringe, contudo sem presença de um infiltrado inflamatório.
Grupo de estudo - 75 dias
Semelhantemente aos animais nos grupos de 25 e 50 dias, nenhuma mudança foi observada sobre o tipo de epitélio ou alterações na lâmina própria das áreas ventrais e dorsais. A hiperplasia da extremidade livre da prega vocal foi semelhante à observada nos grupos de estudo de 25 e 50 dias. Outros resultados incluíram hiperplasia moderada e metaplasia do epitélio na porção superior da cartilagem aritenóide (Figura 2E) e porção mediana das pregas vocais (Figura 2F). Foram observados metaplasia com queratinização e vasos sanguíneos congestionados no grupo de estudo de 50 dias. Contudo, eles não puderam ser achados no grupo de estudo de 75 dias.
Figura 1a.
Figura 1b.
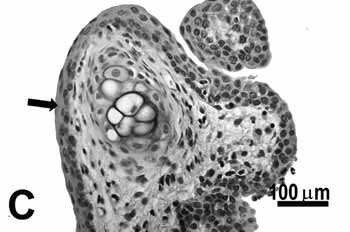
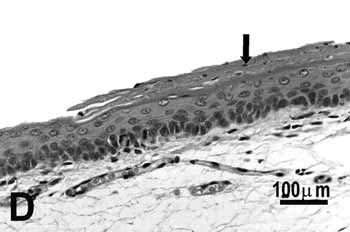
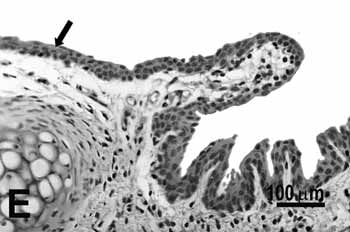
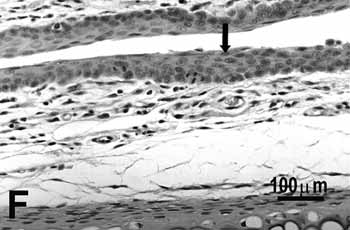
Figura 1. Grupo controle: A: vista geral da laringe demonstrando as cartilagens tireóide (CT) e a aritenóide (asterisco), músculos, tecido conjuntivo, glândula seromucosa, borda livre da prega vocal (círculo) e porção média da prega vocal (seta); B: epitélio cuboidal (seta) da borda livre da prega vocal; C: epitélio escamoso estratificado (seta) da porção média da prega vocal. H.E.
Figura 2a.
Figura 2b.
Figura 2c.
Figura 2d.
Figura 2e.
Figura 2f.
Figura 2. Pregas vocais de ratos submetidos à inalação passiva da fumaça de cigarro. A: metaplasia escamosa (seta) da borda livre do grupo de 25 dias; B: discreta hiperplasia (seta) da porção média do grupo de 25 dias; C: metaplasia e hiperplasia (seta) da borda livre do grupo de 50; D: metaplasia queratinizada e hiperplasia (seta) da porção média do grupo de 50 dias; E: metaplasia e hiperplasia da borda livre (seta) do grupo de 75 dias; F: hiperplasia da porção média do grupo de 75 dias. H.E.
DISCUSSÃO
O cigarro é atualmente um dos agentes mais prejudiciais que afetam o gênero humano levando à habituação física e psicológica. A eliminação do hábito de fumar requer tratamentos para eliminação da dependência física e psicológica em nicotina. Além disso, algumas das 400 substâncias achadas nos cigarros são suspeitas de causar alterações genéticas. Uma de tais substâncias é o alcatrão, considerado um agente altamente carcinogênico e responsável pela incidência mais alta de cânceres de pulmão, boca, laringe, esôfago, estômago, próstata, bexiga e cólon, entre outros (Dube e Green, 1982,; Coelho, 2001)6,16.
São contabilizadas cerca de 30% dos casos de morte por câncer devido ao fumo, distribuindo-se em: 90% das mortes por câncer do pulmão; 97% das mortes por câncer de laringe; 25% das mortes por doença cardíaca; 85% das mortes por bronquites e enfisema; 25% das mortes por acidente vascular cerebral e 50% dos casos de câncer de pele. Isto acontece devido ao envelhecimento precoce de todas as células no organismo por causa da provisão sangüínea de oxigênio reduzida (5% menos) e aumento conseqüente em radicais livres (Coelho, 2001)16.
O presente estudo expôs os animais à fumaça de dez cigarros (três vezes por dia) e conferiu seus efeitos, principalmente na laringe. A laringe de rato foi empregada amplamente como um modelo experimental para fala, porque sua forma é semelhante à da laringe humana, permitindo algumas comparações de seus comportamentos vocais. De acordo com Kurita et al. (1983)17, há diferenças na porção membranosa e nas densidades das pregas vocais de humanos e ratos. Porém, a lâmina própria de ambos é dividida em três porções, isto é, uma camada de superfície com componentes fibrosos escassos, uma camada intermediária com mais componentes e uma camada profunda com mais colágeno e fibras elásticas. A divisão entre a superfície e a porção intermediária não é muito óbvia, contudo a transição da intermediária para a camada profunda é bastante clara.
Algumas investigações (Lee et al. 1992; Haussmann et al. 1998)18,15 informam que os fumantes ganham menos massa de corpo que os não-fumantes. Contudo, estudos que efetivamente demonstram esta diferença entre os não-fumantes e fumantes passivos são difíceis de encontrar. No presente estudo, os animais expostos à fumaça de cigarro apresentaram uma massa de corpo ligeiramente menor que o grupo controle e esta diferença aumentou com os períodos de estudo, variando de 14% a 19%. Lee et al. (1992) avaliou ratos expostos à fumaça de cigarro por seis horas ao dia para um período de 14 dias em condições semelhante ao nosso estudo e não observou diferenças significantes na massa corporal. Em 1998, Haussmann et al. confeccionaram um estudo semelhante ao de Lee et al. (1992) e observou uma diferença estatisticamente significante na massa corporal após 59 dias de exposição. Os autores avançam mencionado que, depois do período final, todos os ratos ganharam massa corporal na mesma taxa, indicando reversão dos efeitos causados pela inalação passiva de fumaça de cigarro.
Outro aspecto amplamente discutido entre investigadores que estudam a laringe de ratos é a distribuição de seu epitélio uma vez que há vários tipos de epitélio de acordo com a localização da glote. Foram observados três tipos diferentes de epitélio em seções transversais da laringe onde a prega vocal está situada, sendo escamoso estratificado na porção mediana da prega vocal e aspecto dorsal da laringe, epitélio colunar pseudoestratificado no dorso e na extremidade livre da prega vocal e epitélio colunar pseudoestratificado ciliado na porção ventral da laringe. Em 1977, Smith19 investigou a prega vocal de ratos, e notou a presença de epitélio de squamous estratificado e epitélio colunar pseudo-estratificado não ciliado, sendo este último mais freqüentemente observado e também achado no aspecto dorsal da prega vocal. Walker et al. (1978)20 observou diferentes transições entre vários tipos de epitélio. O epitélio colunar pseudo-estratificado não-ciliado foi observado na área perto da cartilagem tiróide, inclusive na extremidade livre da prega vocal, mudando para epitélio escamoso estratificado na porção mediana que está mais fino neste local e mais espesso na região dorsal. Em um estudo recente, Marcelino et al. (2000)21 acharam dois tipos de epitélio na laringe, escamoso estratificado na área perto da cartilagem tiróide e pregas vocais e epitélio pseudo-estratificado ciliado nas outras regiões.
São exigidos consensos para classificar o tipo de epitélio achado em cada área da laringe, já que as regiões são bastante pequenas e permitem transições múltiplas entre elas. As classificações diferentes descritas pelos autores podem ser devidas as variações nas espessuras das seções histológicas ou até mesmo devido ao posicionamento da laringe ao serem emblocadas, como as pregas vocais de ratos são organizadas diagonalmente na laringe estas deveriam ser emblocadas em uma posição semelhante.
As mudanças histopatológicas observadas foram a hiperplasia e metaplasia da prega vocal. Supõe-se que o foco inicial de alteração metaplásica seja o epitélio colunar observado na borda livre da prega vocal, desde que pudesse ser observado 25 dias depois da exposição ao fumo em todos os ratos analisados e também nos outros períodos; somente foi encontrada metaplasia na região mediana depois de 50 dias. A hiperplasia foi observada nos três períodos de estudo e de uma maneira crescente.
Metaplasia escamosa foi observada na borda livre e metaplasia com queratinização foi achada na porção mediana. A metaplasia escamosa foi associada a uma suscetibilidade ao desenvolvimento de carcinoma "in situ" e carcinoma escamoso invasivo (Trump et al. 1984; Spencer e Couldery, 1985)22,23. Deveria ser enfatizado que a hiperplasia aumentou durante os três períodos de estudo, como também a metaplasia escamosa; a metaplasia com queratinização foi observada somente no grupo de 50 dias e não pôde ser achada no grupo de 75 dias. Isto poderia ser explicado pela suposição de que o epitélio poderia ter se estabilizado para alcançar proteção.
O tipo de alteração observado foi semelhante aos informados em estudos prévios. Em 1979, Meade et al.24 acharam metaplasia escamosa na laringe de ratos seis semanas depois de exposição à fumaça de cigarro. Contudo, os autores informam que isto pode acontecer mais cedo na presença de deficiência vitamina A. Haussmann et al. (1998)15, em um estudo semelhante ao presente, porém com utilização de três concentrações diferentes de monóxido de carbono (6, 13 e 28 ppm), observaram que a hiperplasia e metaplasia escamosa na borda livre da prega vocal não era dose-dependente, considerando, entretanto, que hiperplasia do epitélio na porção mediana era.
A transição do epitélio escamoso para respiratório na laringe é o local mais sensível ao aparecimento de alterações celulares como degeneração, metaplasia escamosa ou hiperplasia, quando agredida por inalação de xenobióticos (Gopinath et al. 1987; Lewis, 1981)25,26. As áreas de hiperplasia e metaplasia achadas no presente estudo foram mais visíveis na porção mediana e borda livre da prega vocal, seguido pela traquéia, e a análise morfológica revelou que a área imediatamente abaixo delas exibia epitélio respiratório.
A laringe humana é constituída por um epitélio colunar pseudo-estratificado ciliado, com epitélio escamoso estratificado na prega vocal. Como a meta primária deste estudo era conferir a possível modificação histopatológica afetando as pregas vocais de ratos depois de exposição à fumaça de cigarro, esta investigação pode ser considerada como uma advertência à sociedade, uma vez que o epitélio de ambas é do mesmo tipo, podendo as alterações patológicas também serem as mesmas.
CONCLUSÃO
De acordo com os resultados alcançados, pode-se concluir que a inalação passiva de fumaça de cigarro provoca alterações morfológicas na laringe de animais, especialmente nas pregas vocais, levando ao risco de ocorrência de neoplasia.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Sherman CB. Health Effects of Cigarette Smoking. In: Samet JM, Coultas DBWB. Clinics in Chest Medicine Smoking cessation. Philadelphia: Saunders Company; 1991. p. 643-58.
2. Menezes AMB, Horta BL, Oliveira ALB, Faufmann RAC, Duquia R, Diniz A et al. Risco de câncer de pulmão, laringe e esôfago atribuível ao fumo. Revista de Saúde Pública 2002; 36(2): 129-34.
3. World and Health Organization. Tobacco or Health: a global status report. Geneva; 1997.
4. Franceschi S, Bidoli E, Herrero R, Munoz N. Comparison of cancers of the oral cavity and pharynx worldwide: etiological clues. Oral Oncol 2000; 35(1): 106- 15.
5. Levi F. Cancer Prevencion: Epidemiology and Perspectives. Eur J Cancer 1999; 35(7): 1046-58.
6. Dube M, Green C R. Methods of collection of smoke for analytical purposes. Recent Adv Tobaco Sci 1982; 8: 42-102.
7. Churg DF, Pryor WA. Free radical chemistry of cigarette smoke and its toxicological implications. Environ Health Perspect 1985; 64: 111-26.
8. Nakayoma T, Kodama M, Nagota C. Generation of hydrogen peroxide and superoxide anion radical from cigarette smoke. Gann 1984; 75: 95-8.
9. Block SC, Bretthaaver EW. Polonium 210 in tobacco. Radiol Health Data Rep 1968; 9: 145-52.
10. Cross FT. Radioactivity in cigarette smoke issue. Health Phys 1984; 46: 205-8.
11. Public Health Service, Department of Health and Human Services (US). The health consequences of smoking: Cancer. (DHHS (PHS) 82-50179). Washington DC; 1982. 322p.
12. Cendon SP. Pulmonary emphysema induced by passive smoking: in experimental study in rats. Braz J Med Biol Res 1997; 30(10): 1241-7.
13. Homburger F, Bernfeld P. Preferred animal model in tobacco inhalation studies. J Natl Cancer Inst 1985; 75(2): 393.
14. Dalbey WE, Nettesheim P, Griesemer R, Catom JE, Guerin MR. Chronic inhalation of cigarette smoke by F344 rats. J Natl Cancer Inst 1980; 64(2): 383-90.
15. Haussmann H, Anskeit E, Becker D, Kuhl P, Stinn W, Teredesai A et al. Comparison of fresh and room-aged cigarette sidestream smoke in a subchronic inhalation study on rats. Toxicol Scienc1998; 41: 100-16.
16. Coelho R. Anti-Fumo. Copyright 2001 [Site na Internet]. Disponível na internet http: //www.antifumobr.hpg.ig.com.br Acessado em 30 de março de 2003.
17. Kurita S, Nagata K, Hirano M A. Comparative study of the layer structure of vocal fold. In: Vocal fold physiology. San Diego: College-Hill; 1983. p. 3-21.
18. Lee CK, Browm BG, Reed BA, Rahn CA, Coggins CRE, Doolittle DJ, Hayes AW. Fourteen-day inhalation study in rats, using aged and diluted sidestream smoke from a reference cigarette: II. DNA adducts and alveolar macrophage cytogenesis. Fundam Appl Toxicol 1992; 19: 141-6.
19. Smith G. Structure of the normal rat larynx. Laboratory Animals 1977; 11: 223-8
20. Walker D, Wilton LV, Binns R. Inhalation toxicity studies on cigarette smoke (VII) 6-week comparative experiments using modified flue-cured cigarettes: histopathology of the conducting airways. Toxicol 1978; 10: 241-59.
21. Marcelino FC, Faria FAC, Oliveira DT. Efeito da inalação de carbonato de cálcio nas pregas vocais de ratos. Pró Fono: Revista Atual Científica 2002; 14(1): 31-8.
22. Trump BF, Mc Dowell EM, Harris SC. Chemical carcinogenesis in the tracheobronchial epithelium. Environ Health Perspect 1984; 55: 77-84.
23. Spencer MG, Couldery AD. Nasal tooth. J Laryngol Otol 1985; 99(11): 1117-50.
24. Meade PD, Yamashiro S, Harada T, Barsur PK. Influence of vitamin A on the laryngeal response of hamsters exposed to cigarette smoke. Prog Exp Tumor Res 1979; 24: 320-9.
25. Gopinath C, Prentice DE, Lewis DJ. The respiratory system. In: Atlas of Experimental Toxicologic Pathology Current Histopathology. GA Gresham (ed). Norwell, MA: MTP Press; 1987. v.13. p.22-42.
26. Lewis DJ. Morphological assessment of pathological changes within the rat larynx. Toxicol Pathol 1991; 19: 352-7.
1 Fonoaudióloga com especialização em Audiologia (Fonoaudióloga).
2 Professor Doutor (Professor Doutor do Departamento de Ciências Biológicas (disciplina de Fisiologia) da Faculdade de Odontologia de Bauru - USP).
3 Bióloga (Técnica de laboratório do Departamento de ciências Biológicas (disciplina de Histologia) da Faculdade de Odontologia de Bauru - USP).
4 Bióloga - Doutoranda em Biologia Oral pela Faculdade de Odontologia de Bauru - USP (técnica de laboratório do Departamento de ciências Biológicas (disciplina de Histologia) da Faculdade de Odontologia de Bauru - USP).
5 Professor Livre Docente (Professor Livre Docente do Departamento de ciências Biológicas (disciplina de Histologia) da Faculdade de Odontologia de Bauru - USP).
Bauru Dental School - USP.
Endereço para correspondência: Prof. Dr. Gerson Francisco de Assis - Departamento de Ciências Biológicas (Histologia) - Alameda Doutor Octávio Pinheiro Brisolla 9-75 Vila Universitária Bauru São Paulo Brasil 17012-901
Tel (0xx14) 3235-8298 - E-mail: gfassis@fob.usp.br
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 11 de março de 2005.
Artigo aceito em em 28 de março de 2005.