Ano: 2006 Vol. 72 Ed. 2 - Março - Abril - (1º)
Seção: Artigo Original
Páginas: 151 a 157
Hidropsia endolinfática experimental sob ação de inibidor da óxido nítrico sintase tipo II: avaliação com emissões otoacústicas e eletrococleografia
Experimental endolymphatic hydrops under action of a type II nitric oxide synthase inhibitor: otoacoustic emissions evaluation and electrocochleography
Autor(es): Claudio Marcio Yudi Ikino1, Roseli Saraiva Moreira Bittar2, Karina Midori Sato3, Newton Macuco Capella4
Palavras-chave: hidropsia endolinfática, óxido nítrico, inibidor enzimático, audiometria de resposta evocada, cobaias.
Keywords: endolymphatic hydrops, nitric oxide, enzimatic inhibitors, audiometry evoked response, guinea pigs.
Resumo:
No modelo experimental de hidropsia endolinfática há redução na amplitude das emissões otoacústicas produtos de distorção (EOAPD) e elevação nos limiares eletrofisiológicos na eletrococleografia. Estudos mostraram que há expressão da óxido nítrico sintase tipo II (ONS II) na cóclea com hidropsia, sugerindo a participação do óxido nítrico (ON) na patogênese desta doença. O objetivo deste trabalho foi avaliar a ação de um inibidor da ONS II nas EOAPD e eletrococleografia em cobaias com hidropisia endolinfática experimental. Material e Métodos: Foram estudadas 16 cobaias nas quais se induziu hidropsia endolinfática experimental por obliteração do ducto e saco endolinfático na orelha direita durante 16 semanas, divididas em dois grupos: oito cobaias recebendo um inibidor da ONS II, a aminoguanidina, por via oral e um grupo de oito cobaias como controle. Comparamos as amplitudes das EOAPD nas médias geométricas de freqüências de 1062, 2187, 4375 e 7000Hz, os limiares eletrofisiológicos nas freqüências de 1000, 2000, 4000 e 6000Hz e a relação entre os potenciais de somação e de ação (PS/PA) entre os grupos. Resultados: Não houve diferença significante nas EOAPD e na relação PS/PA entre os grupos. O grupo que recebeu a aminoguanidina apresentou menor elevação nos limiares eletrofisiológicos nas freqüências de 2000 (p<0,05) e 6000 Hz (p<0,05) na 12ª semana e nas freqüências de 1000 (p<0,05), 2000 (p<0,001), 4000 (p<0,001) e 6000Hz (p<0,001) na 16ª semana. Conclusões: O inibidor da ONS II reduziu a elevação dos limiares eletrofisiológicos na eletrococleografia na hidropsia endolinfática experimental.
Abstract:
In experimental endolymphatic hydrops distortion-products otoacoustic emission (dpoae) amplitudes decrease and there is elevation on electrocochleographic thresholds. Some authors found type ii nitric oxide synthase (nos ii) expression in hydropic cochleas and they suggest nitric oxide (no) may be involved in endolymphatic hydrops pathogenesis. The aim of this study was to evaluate the action of a nos ii inhibitor on dpoae and electrocochleography in experimental endolymphatic hydrops. Material and methods: endolymphatic hydrops was induced in 16 guinea pigs by obliterating the endolymphatic duct and sac in the right ear. They were divided in two groups: eigth guinea pigs under the action of aminoguanidine, a nos ii inhibitor and eigth control guinea pigs. We compared dpoae amplitudes at geometric means of frequencies 1062, 2187, 4375 and 7000 hz, compound action potential threshold at 1000, 2000, 4000 and 6000 hz and summating potential to action potential (sp/ap) ratio between the groups during the postoperative observation period of 16 weeks. Results: there were no significant changes in the dpoae amplitudes and in the sp/ap ratio. The group that received aminoguanidine had a lower degree of threshold increase at 2000 (p<0.05) And 6000 hz (p<0.05) In 12th postoperative week and at 1000 (p<0.05), 2000 (P<0.001), 4000 (P<0.001) And 6000 hz (p<0.001) At 16th postoperative week. Conclusions: nos ii inhibitor decreased the electrocochleography threshold elevation on experimental endolymphatic hydrops.
![]()
INTRODUÇÃO
A descoberta de mecanismos bioquímicos e moleculares envolvidos na fisiologia coclear tem revolucionado conceitos e aberto novas fronteiras para pesquisa neste tema tão complexo e fascinante. Dentro deste contexto encontra-se o óxido nítrico (ON), participante de inúmeros processos fisiológicos e fisiopatológicos em diversos tecidos, que na orelha interna atua na neurotransmissão e apresenta ação reguladora sobre o tônus vascular e sobre a homeostase da endolinfa1,2.
O ON é sintetizado a partir do aminoácido L-arginina por uma família de enzimas citoplasmáticas denominadas óxido nítrico sintases (ONS). Estas enzimas se apresentam como três isoformas distintas: tipo I ou neuronal (ONS I), tipo II ou induzida (ONS II) e tipo III ou endotelial (ONS III). A ONS I e III são constitutivas, cálcio-dependentes e produzem ON em pequena quantidade3. A ONS II tem sua produção induzida por estímulos como citocinas, isquemia, interferon ou lipopolissacáride, é cálcio independente, não é expressa habitualmente na cóclea e produz ON em maior quantidade, cerca de 100 a 1000 vezes mais que a produzida pela ONS I e III2,4,5-7.
Quando produzido em maior quantidade e continuamente, o ON possui, além da ação fisiológica, ação neurotóxica e citotóxica, produção essa catalisada pela ONS II2,7-10. Estudos onde são utilizados doadores de ON, ou seja, substâncias exógenas que liberam ON quando metabolizadas, mostram que o ON causa lesão e perda de células ciliadas. Além das lesões estruturais, há alterações dos limiares eletrofisiológicos, do potencial endococlear, da amplitude do potencial de ação do nervo auditivo e da amplitude do microfonismo coclear2,11.
Em pesquisa realizada em cobaias com hidropsia endolinfática experimental secundária ao bloqueio do ducto e saco endolinfático, a ONS II foi detectada nas células ganglionares, nas células de suporte, no ligamento espiral e na estria vascular. A partir de então se inferiu que as células lesadas pelo aumento da pressão hidrostática liberariam citocinas pró-inflamatórias, estimulando assim a síntese da ONS II e a produção excessiva de ON8. As alterações morfológicas e eletrofisiológicas atribuídas ao ON que ocorrem na cóclea apresentam semelhanças às alterações cocleares que surgem no modelo animal de hidropsia endolinfática descritas em estudos prévios, sugerindo uma possível relação entre ambas12.
Em relação à evolução da audição na hidropsia endolinfática experimental, observamos que ocorre deterioração progressiva dos níveis auditivos, inicialmente nas freqüências graves, seguindo-se nas agudas e finalmente nas médias, à semelhança da evolução clínica na Doença de Menière13-15. Há redução na amplitude das emissões otoacústicas produtos de distorção (EOAPD) que ocorrem precocemente já nas primeiras semanas após a indução experimental de hidropsia endolinfática, antes mesmo do aumento dos limiares detectado pelo potencial auditivo composto16-18.
Assim temos que no modelo experimental de hidropsia endolinfática em cobaias ocorre lesões na cóclea, há aumento progressivo no limiar eletrofisiológico e redução na amplitude das EOAPD, alterações estas inter-relacionadas. Nesse mesmo modelo animal observou-se a expressão da ONS II na cóclea, isoforma esta não encontrada normalmente na orelha interna. Logo, é possível que o ON sintetizado sob ação da ONS II tenha participação na origem das alterações histopatológicas cocleares, de potencial auditivo composto e de EOAPD observadas nesses animais de experimentação e o uso de um inibidor da ONS II teria a potencialidade de modificar a evolução de tais alterações.
O objetivo deste estudo foi avaliar a ação de um inibidor da óxido nítrico sintase tipo II, a aminoguanidina, nas emissões otoacústicas produtos de distorção e na eletrococleografia em cobaias com hidropsia endolinfática experimental por obliteração do ducto e saco endolinfático.
MATERIAL E MÉTODOS
O projeto de pesquisa seguiu os princípios éticos de experimentação em animais do Colégio Brasileiro de Experimentação Animal e foi aprovado pela Comissão de Ética no Uso de Animais da UFSC sob os números 261/CEUA e 23080.035333/2003-63/UFSC e pela Comissão de Ética para Análise de Projetos de Pesquisa do Hospital das Clínicas da FMUSP sob o número 588/04.
O estudo, experimental, caso-controle, foi realizado em 16 cobaias albinas (Cavia porcellus), de pêlo curto, adultas, de ambos os sexos, peso inicial de 350 a 400 g, com Teste de Preyer positivo e otoscopia normal. Todos os animais foram submetidos à cirurgia para indução de hidropsia endolinfática experimental na orelha direita, com obliteração do ducto e saco endolinfático por abordagem extradural via fossa posterior19, sob anestesia por via intramuscular utilizando uma solução de Xylazina (5 mg/kg) e Quetamina (50 mg/kg)20.
Os animais foram divididos aleatoriamente em dois grupos:
a) Grupo I (Estudo): composto por oito animais, que receberam o inibidor seletivo da ONS II, o bicarbonato de aminoguanidina 98,5% (Sigma-Aldrich, Steinheim, Alemanha), por via oral na água do bebedouro, diluído na concentração de 1%, em volume compatível com a dosagem de 100 mg de aminoguanidina/ kg de peso/ dia21, diariamente do 3º dia à 16ª semana pós-operatória ad libitum.
b) Grupo II (Controle): composto por oito animais, que receberam apenas água no bebedouro.
Foram realizados os exames de EOAPD e eletrococleografia na orelha direita das 16 cobaias sob anestesia no pré-operatório e nas 1ª, 4ª, 8ª, 12ª e 16ª semanas pós-operatórias. Cada animal realizou a medida das EOAPD seguida da eletrococleografia sempre na orelha direita. A seleção da cobaia para os exames foi aleatória e o examinador era cego para o grupo ao qual o animal pertencia quando da realização da eletrococleografia.
As medidas das amplitudes das EOAPD foram realizadas em sala com tratamento acústico, utilizando-se o aparelho GSI 60 DPOAE da WelshAllyn, com estímulos na intensidade de 70 dB NPS e relação entre as freqüências primárias 1 (f1) e 2 (f2) de 1,2 nas seguintes médias geométricas das freqüências: 1062, 2187, 4375 e 7000Hz. Ao final do experimento calculou-se a média e desvio-padrão das amplitudes dos produtos de distorção de cada média geométrica das freqüências, para cada instante avaliado e para cada grupo.
A eletrococleografia foi realizada em sala com tratamento acústico, utilizando-se o aparelho MK 22 da Amplaid, com o eletrodo ativo transtimpânico na orelha direita, eletrodo referência subcutâneo na região occipital mediana e eletrodo de massa subcutâneo na região frontal mediana. Os estímulos acústicos foram fornecidos por fone do tipo concha modelo TDH 498 posicionado a 5 cm do pavilhão auricular direito. Mediram-se os limiares eletrofisiológicos do potencial de ação nas freqüências de 1000, 2000, 4000 e 6000Hz com uso de estímulo do tipo "logon" de polaridade alternada a partir de 120 dB NPS com decréscimos de 10 dB NPS e a relação PS/PA com uso de estímulo tipo clique a 120 dB NPS de polaridade alternada. Ao final do experimento calculou-se a média e desvio-padrão dos limiares eletrofisiológicos de cada freqüência, para cada instante avaliado e para cada grupo. Calculou-se ainda a média e desvio-padrão da relação entre os potenciais de somação e de ação (PS/PA) para cada instante nos dois grupos.
Para comparação dos resultados entre o grupo de estudo e o grupo controle e a evolução dos mesmos ao longo do período estudado utilizamos a Análise de Variância de duplo fator para medidas repetidas, com complementação pelo Teste t de Bonferroni. O software utilizado foi o GraphPad Prism 4 for Windows, versão 4.02. Adotou-se o nível de significância (p) de 5% (p<0,05), conforme os padrões utilizados em estudos biológicos.
RESULTADOS
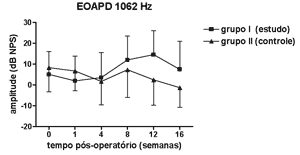
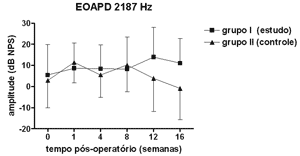
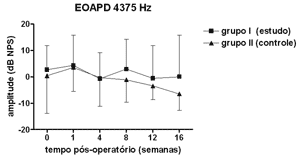
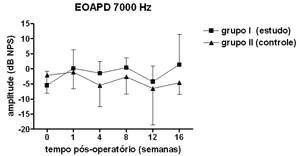
Não se observou diferença estatisticamente significante nas medidas de amplitude das EOAPD nas freqüências testadas ao longo do período de estudo e entre os grupos de estudo e controle (Figuras 1 a 4).
Houve elevação estatisticamente significante na Análise de Variância de duplo fator dos limiares eletrofisiológicos à eletrococleografia nas freqüências de 1000Hz (p<0,001; F=19,37), 2000Hz (p<0,001; F=21,21), 4000Hz (p<0,001; F=11,70) e 6000Hz (p<0,001; F=13,36) nos grupos de estudo e controle ao longo do período estudado, indicando o desenvolvimento de perda auditiva e sucesso na indução da hidropsia endolinfática.
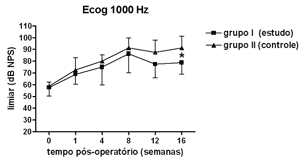
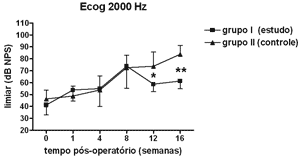
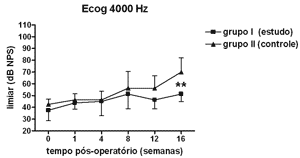
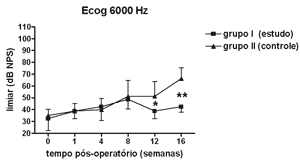
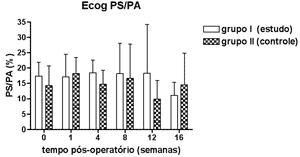
Nas Figuras 5 a 8 apresentamos as medidas dos limiares eletrofisiológicos, comparando os valores entre os grupos de estudo e controle ao longo do período de estudo. Na Figura 9 apresentamos o comportamento da relação PS/PA nos grupos de estudo e controle onde não houve diferença estatisticamente significante entre os mesmos e em seus valores ao longo do tempo.
Figura 1. EOAPD: medidas das amplitudes nos grupos de estudo e controle em média ± desvio-padrão na média geométrica de freqüências de 1062Hz.
Figura 2. EOAPD: medidas das amplitudes nos grupos de estudo e controle em média ± desvio-padrão na média geométrica de freqüências de 2187Hz.
Figura 3. EOAPD: medidas das amplitudes nos grupos de estudo e controle em média ± desvio-padrão na média geométrica de freqüências de 4375Hz.
Figura 4. EOAPD: medidas das amplitudes nos grupos de estudo e controle em média ± desvio-padrão na média geométrica de freqüências de 7000Hz.
Figura 5. Eletrococleografia: medidas dos limiares eletrofisiológicos em média ± desvio-padrão nos grupos de estudo e controle na freqüência de 1000Hz. * p<0,05 (t=2,520) entre os valores dos grupos de estudo e controle no Teste t de Bonferroni.
Figura 6. Eletrococleografia: medidas dos limiares eletrofisiológicos em média ± desvio-padrão nos grupos de estudo e controle na freqüência de 2000Hz. * p<0,05 (t=3,024); ** p <0,001 (t=4,535) entre os valores dos grupos de estudo e controle no Teste t de Bonferroni.
Figura 7. Eletrococleografia: medidas dos limiares eletrofisiológicos em média ± desvio-padrão nos grupos de estudo e controle na freqüência de 4000 Hz. ** p <0,001 (t=3,779) entre os valores dos grupos de estudo e controle no Teste t de Bonferroni.
Figura 8. Eletrococleografia: medidas dos limiares eletrofisiológicos em média ± desvio-padrão nos grupos de estudo e controle na freqüência de 6000 Hz. * p<0,05 (t=2,520); ** p <0,001 (t=4,787) entre os valores dos grupos de estudo e controle no Teste t de Bonferroni.
Figura 9. Eletrococleografia: medida da relação PS/PA em média ± desvio-padrão nos grupos de estudo e controle.
DISCUSSÃO
As medidas de amplitude das EOAPD não apresentaram variação ao longo do estudo seja no grupo de estudo ou no controle. O tamanho de nossa amostra associado à grande variabilidade individual deve ter contribuído para isso. Em alguns estudos a amplitude das EOAPD no modelo experimental de hidropsia endolinfática apresenta redução já a partir da 1ª semana pós-operatória16,18 enquanto outros, assim como em nosso experimento, mostram resultados variáveis, inclusive com aumento da amplitude após período de redução, porém sem atingir os valores de pré-operatório17,22. Além disso, a intensidade das freqüências primárias utilizada varia conforme os autores, dificultando a comparação dos resultados. Por outro lado, as alterações de amplitude quando detectadas precedem as alterações de limiar eletrofisiológico16,17 e assim pode haver outros mecanismos em sua origem, não tendo a ONS II um papel importante. Okubo et al. (1997)18 mostraram que a amplitude das EOAPD em 4000 e 6000Hz apresentaram redução após 1 a 2 semanas de pós-operatório, que retornaram aos valores do pré-operatório com o uso de um diurético osmótico, a isossorbida, sugerindo a participação da pressão e volume da endolinfa nas alterações das EOAPD. Neste mesmo estudo o potencial endococlear também apresentou redução nos seus valores na 1ª semana de pós-operatório, mas com o uso da isossorbida evoluiu com maior redução nas suas medidas não mostrando relação aparente com as alterações das EOAPD18.
Observamos aumento progressivo dos limiares eletrofisiológicos no grupo controle em todas as freqüências ao longo do período de estudo, inicialmente na freqüência de 1000 Hz já a partir da 1ª semana pós-operatória e nas demais freqüências a partir da 8ª semana. Nossos achados se assemelham aos de outros autores, confirmando a excelência da cobaia como modelo experimental da hidropsia endolinfática13,16,23-25. Os limiares foram mais elevados desde a medida pré-operatória provavelmente por termos fornecido o estímulo acústico por fone de ouvido a 5 cm do pavilhão auricular enquanto que outros utilizaram a distância de 1cm22,24,26 ou acoplaram o fone ao meato auditivo externo13. Mesmo assim o padrão e grau de perda auditiva observados foram semelhantes. Com relação aos valores de pré-operatório nossos resultados concordaram com os de Andrews et al. (2000)26. Procuramos posicionar o fone de ouvido o mais próximo possível do pavilhão, porém o tamanho do eletrodo transtimpânico utilizado não permitiu distância menor.
No grupo de estudo houve elevação nos limiares eletrofisiológicos nas freqüências de 1000 e 2000Hz nas primeiras 4 semanas de pós-operatório, atingindo as demais freqüências na 8ª semana, em padrão semelhante ao grupo controle, porém a partir da 12ª semana a progressão da perda auditiva foi menor no grupo de estudo, sendo significante em 2000 e 6000 Hz e incluindo as medidas em 1000 e 4000 Hz na 16ª semana. Logo o uso da aminoguanidina por via oral foi capaz de reduzir o grau de perda auditiva na hidropsia endolinfática em cobaias de forma significante a partir da 12ª semana pós-operatória, mas não impediu seu desenvolvimento.
A aminoguanidina é um inibidor seletivo da ONS II27. Seu uso por via intraperitoneal na dose de 100 mg/kg/dia reduziu as lesões tissulares e a elevação dos limiares eletrofisiológicos em cobaias cujas cócleas foram submetidas à isquemia transitória por clampeamento da artéria labiríntica, comprovando que a aminoguanidina atinge os tecidos cocleares21. Estudos utilizando o bicarbonato de aminoguanidina por via oral, em doses variando de 80 a 200 mg/kg/dia, mostram que a droga é absorvida pelo trato gastrointestinal e que atua inibindo a ação da ONS II uma vez que reduz as lesões produzidas em modelos de doença em que se havia comprovado o aumento de sua expressão, reduzindo ainda a excreção urinária de nitritos e nitratos indicando assim menor produção de ON28. Apesar de não termos dosado metabólitos da produção de ON, acreditamos que em nosso estudo a aminoguanidina tenha inibido a ONS II e, como obtivemos uma redução na elevação dos limiares eletrofisiológicos, sugerimos que o ON catalisado por esta enzima contribua na patogênese da hidropsia endolinfática. Michel et al. (2000)8 e Watanabe et al. (2001)10 demonstraram que há expressão da ONS II na cóclea de cobaias com hidropsia, sugerindo sua participação no desenvolvimento da doença. Ao utilizarmos um inibidor desta enzima fomos capazes de modificar a evolução da perda auditiva, o que reforçou esta proposição. Entretanto, para fins de comparação, não encontramos na literatura consultada o uso de inibidor da ONS II, seja por via oral ou parenteral, em modelo experimental de hidropsia endolinfática.
Embora tenhamos observado um menor grau de perda auditiva no grupo de estudo, houve elevação dos limiares eletrofisiológicos, logo a aminoguanidina não impediu o desenvolvimento da hidropsia endolinfática. O fato de termos iniciado a aminoguanidina a partir do 3º dia de pós-operatório pode ter contribuído para este fato, já que assim permitimos que a ONS II produzisse ON nos dois primeiros dias. Nossa opção por iniciar a aminoguanidina a partir daquela data deveu-se ao risco de infecção local, uma vez que a cirurgia para indução da hidropsia endolinfática envolveu a exposição da dura-máter, osso occipital e orelha interna. Uma vez que a ONS II participa dos mecanismos celulares inespecíficos de inflamação e defesa4 optamos por aguardar 2 dias, permitindo a cicatrização inicial da ferida cirúrgica. Não sabemos ao certo a partir de quando a ONS II é sintetizada, já que Michel et al. (2000)8 demonstraram a presença desta enzima em cobaias com 3 semanas de indução de hidropsia por bloqueio do ducto e saco endolinfático enquanto que Watanabe et al. (2001)10 demonstraram a expressão de ONS II com 1 dia de pós-operatório. Neste último modelo, os autores utilizaram injeção de antígeno no saco endolinfático para indução da hidropsia e não sabemos se a expressão de ONS II ocorre no mesmo instante nestes dois modelos distintos de indução. Em cobaias onde se produz lesão coclear seja por LPS ou por gentamicina a ONS II é responsável pela síntese de ON após 48 horas da inoculação destes agressores29. Outra possibilidade é a utilização da aminoguanidina por via oral na dose máxima de 100 mg/kg/dia que pode não ter atingido nível suficiente para inibição total da ONS II. O uso por via oral mostrou-se efetivo em estudos de outros modelos de doença em doses que variaram entre 80 e 200 mg/kg/dia e na dose de 100 mg/kg/dia, por nós adotada, em cobaias submetidas à isquemia coclear, porém por via intraperitoneal21,28. Não sabemos se esta dosagem foi suficiente na hidropsia endolinfática já que não encontramos outros experimentos que a utilizaram neste modelo de doença. Não fez parte de nossa metodologia o controle da ingesta da droga, que pode ter sido variável, bem como a manutenção de seus níveis séricos, mas observamos que a maioria dos animais durante todo o período de estudo ingeriram todo ou quase todo o conteúdo do bebedouro ao longo das 24 horas. Por fim há a possibilidade de a patogênese da hidropsia endolinfática ser multifatorial. Desta forma a aminoguanidina não impediria o desenvolvimento da hidropsia e sim modificaria sua evolução, como observamos em nosso experimento de forma significante a partir da 12ª semana.
A obstrução mecânica do saco e ducto endolinfático19,30 em cobaias promove o surgimento de hidropsia endolinfática com distensão do espaço endolinfático a partir do 1º dia. Nesse modelo há aumento da pressão da endolinfa em relação à perilinfa após a 2ª semana26 que pode levar a perda de audição induzida pela ação mecânica ou pela lesão celular. O uso de diuréticos como o glicerol25 é capaz de reduzir a elevação dos limiares eletrofisiológicos, mas também não impede o surgimento da doença, sugerindo que o aumento da pressão endolinfática participa, mas não é o único fator envolvido. Para reforçar este aspecto, estudos que promoveram aumento na pressão endolinfática através de um cateter posicionado no ducto endolinfático, avaliando o fator pressão endolinfática isoladamente, causaram perda de audição inicialmente nas freqüências agudas, atingindo mais tarde as freqüências graves. Já na hidropsia por bloqueio do ducto e saco endolinfático a perda em freqüências graves é a primeira a surgir24. Estas alterações descritas podem ser responsáveis ou concomitantes à expressão da ONS II, com a produção de ON que causaria lesão de células ciliadas e de células marginais da estria vascular e hiperativação da via ON/GMPc com conseqüente disfunção da microcirculação coclear e maior liberação de glutamato. Este último por sua vez bloquearia a transmissão neural via receptores N-metil-D-aspartato2,7,8,10,29. A utilização da aminoguanidina provavelmente foi capaz de reduzir essas lesões.
Não encontramos diferença na relação PS/PA no grupo controle assim como outros autores14,23 que também utilizaram o eletrodo ativo na região da base da cóclea. A aminoguanidina não modificou esse achado.
Os mecanismos responsáveis pela origem das alterações auditivas na hidropsia endolinfática experimental são diversos e ainda não completamente compreendidos. O ON surge como mais um elemento envolvido na gênese da doença e novos estudos para esclarecer seu real papel, bem como a interação dos demais fatores apresentados na literatura, são necessários. Um melhor conhecimento na fisiopatologia da hidropsia endolinfática é a base para o desenvolvimento de novas abordagens terapêuticas para a Doença de Menière.
CONCLUSÕES
Concluímos que o inibidor da ONS II, a aminoguanidina, promoveu menor elevação dos limiares eletrofisiológicos nas cobaias estudadas, não modificou a relação PS/PA medida ao nível da base da cóclea e também não modificou a amplitude das EOAPD ao longo das 16 semanas de estudo.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Gosepath K, Heinrich UR, Ecke U, Maurer J, Amedee R, Mann WJ. Possible roles of nitric oxide in the physiology and pathophysiology of the guinea pig cochlea. Eur Arch Otorhinolaryngol 2000;257:418-24.
2. Takumida M, Anniko M, Popa R, Zhang DM. Lipopolysaccharide-induced expression of inducible nitric oxide synthase in the guinea pig organ of Corti. Hear Res 2000a;140(1-2):91-8.
3. Alderton WK, Cooper CE, Knowles RG. Nitric oxide synthases: structure, function and inhibition. Biochem J 2001;357:593-615.
4. Moncada S, Higgs A. The L-arginine-nitric oxide pathway. N Engl J Med 1993;329:2002-12.
5. Franz P, Hauser-Kronberger C, Böck P, Quint C, Baumgartner WD. Localization of nitric oxide synthase I and III in the cochlea. Arch Otolaryngol (Stockh) 1996;116:726-31.
6. Shi X, Dai C, Nuttall AL. Altered expression of inducible nitric oxide synthase (iNOS) in the cochlea. Hear Res 2003;177:43-52.
7. Shen J, Harada N, Yamashita T. Nitric oxide inhibits adenosine 5'-triphosphate-induced Ca2+ response in inner hair cells of the guinea pig cochlea. Neuroscience Letters 2003;337:135-8.
8. Michel O, Hess A, Su J, Bloch W, Stennert E, Addicks K. Expression of inducible nitric oxide synthase (iNOS/ NOS II) in the hydropic cochlea of guinea pigs. Hear Res 2000;143:23-8.
9. Ruan RS, Leong SK, Yeoh KH. Effects of nitric oxide on normal and ischemic cochlea of the guinea pig. Exp Neurology 2001;169:200-7.
10. Watanabe K, Tomiyama S, Jinnouchi K, Pawankar R, Yagi T. Expression of inducible nitric oxide synthase in the cochlea following immune response in the endolymphatic sac of guinea pigs. ORL 2001;63(3):155-9.
11. Ruan RS, Leong SK, Yeoh KH. Ototoxicity of sodium nitroprusside. Hear Res 1997;114:169-78.
12. Aran J, Rarey KE, Hawkins Jr JE. Functional and morphological changes in experimental endolymphatic hydrops. Acta Otolaryngol (Stockh) 1984;97:547-57.
13. Morizono T, Cohen J, Sikora MA. Measurement of action potential thresholds in experimental endolymphatic hydrops. Ann Otol Rhinol Laryngol 1985;94:191-4.
14. Kusakari J, Kobayashi T, Arakawa E, Rokugo M, Ohyama K. Time-related changes in cochlear potentials in guinea pigs with experimentally induced endolymphatic hydrops. Acta Otolaryngol (Stockh) 1987;Suppl 435:27-32.
15. Horner KC. Auditory and vestibular function in experimental hydrops. Otolaryngol Head Neck Surg 1995;112:84-9.
16. Okubo H, Akizuki H, Kawashima N, Morita Y, Ito Z, Ase Y et al. Distortion-product otoacoustic emissions in experimentally induced hydropic ears. Acta Otolaryngol (Stockh) 1995;519:97-101.
17. Magliulo G, Cianfrone G, Musacchio A, Vingolo GM, Petti R, Cristofari P. Distortion-product otoacoustic emissions and glycerol on the guinea pig hydropic ear. J Otolaryngol 1997;26(3):188-93.
18. Okubo H, Tachihara N, Satoh S, Hara A, Kusakari J. Effect of isosorbide on distortion-product otoacoustic emissions and endocochlear DC potential in experimentally induced hydropic ears. Acta Otolaryngol (Stockh) 1997;suppl 528:59-62.
19. Andrews JC, Böhmer A. The surgical approach to the endolymphatic sac and the cochlear aqueduct in the guinea pig. Am J Otolaryngol 1989;10:61-6.
20. Fantoni DT, Cortopassi SRG. Técnicas anestésicas em animais de laboratório. In: Lucca R, Alexandre S, editores. Manual para técnicos em bioterismo. 2ª ed. São Paulo, Brasil: EDUSP; 1996. p. 157-64.
21. Tsuji S, Tabuchi K, Hara A, Kusakari J. Long-term observations on the reversibility of cochlear dysfunction after transient ischemia. Hear Res 2002;166:72-81.
22. Horner KC. Comparision of compound action potential audiograms with distortion product otoacoustic emissions in experimentally induced hydrops. Eur Arch Otorhinolaryngol 1991;248:302-7.
23. van Deelen GW, Ruding PRJW, Veldman RJE, Huizing EH, Smoorenburg GF. Electrocochleographic study of experimentally induced endolymphatic hydrops. Arch Otorhinolaryngol 1987;244:167-73.
24. Horner KC, Cazals Y. Contribution of increased endolymphatic pressure to hearing loss in experimental hydrops. Ann Otol Rhinol Laryngol 1991;100:496-502.
25. Magliulo G, Vingolo GM, Petti R, Cristofari P. Experimental endolymphatic hydrops and glycerol electrophysiologic study. Ann Otol Rhinol Laryngol 1993;102:596-9.
26. Andrews JC, Böhmer A, Hoffman L, Strelioff D. Auditory threshold and inner ear pressure: measurements in experimental endolymphatic hydrops. Am J Otol 2000;21:652-6.
27. Misko TP, Moore WM, Kasten TP, Nickols GA, Corbett JA, Tilton RG et al. Selective inhibition of the inducible nitric oxide synthase by aminoguanidine. Eur J Pharmacol 1993;233:119-25.
28. Lubarsky SL, Ahokas RA, Friedman SA, Sibai BM. The effect of chronic nitric oxide synthesis inhibition on blood pressure and angiotensin II responsiveness in the pregnant rat. Am J Obstet Gynecol 1997;176:1069-76.
29. Takumida M, Anniko M, Popa R, Zhang DM. Pharmacological models for inner ear therapy with emphasis on nitric oxide. Acta Otolaryngol 2001;121:16-20.
30. Kimura RS. Experimental blockage of the endolymphatic duct and sac and its effect on the inner ear of the guinea pig. A study on endolymphatic hydrops. Ann Otol Rhinol Laryngol 1967;76:664-87.
Trabalho premiado no IV Congresso Triológico de 2005
1 Doutor em Ciências pela Faculdade de Medicina da USP, Médico do Serviço de Otorrinolaringologia do Hospital Universitário da UFSC.
2 Doutor em Medicina, Assistente Doutor do Setor de Otoneurologia da Divisão de Clínica Otorrinolaringológica do HCFMUSP.
3 Aluna do Curso de Medicina da UFSC.
4 Doutor em Medicina, Professor Adjunto do Departamento de Cirurgia da UFSC.
Trabalho realizado na Disciplina de Otorrinolaringologia da FMUSP e no Laboratório de Técnica Operatória e Cirurgia Experimental do Hospital Universitário da UFSC. Premiado em 2º lugar como "Melhor Trabalho de Estudo Experimental" no 37º Congresso Brasileiro de Otorrinolaringologia e Cirurgia Cérvico-Facial, 16/11 a 20/11/2004, Fortaleza. Trabalho originado de Tese de Doutorado apresentada ao Departamento de Oftalmologia e Otorrinolaringologia da FMUSP para obtenção do título de Doutor em Ciências.
Endereço para correspondência: Cláudio M. Y. Ikino - Av. Jorn. Rubens de Arruda Ramos 2560 Centro Florianópolis SC 88015-700.
Fax: (0xx48) 224-1111- E-mail: claudioikino@hotmail.com
Este artigo foi submetido no SGP (Sistema de Gestão de Publicações) da RBORL em 9 de março de 2006.
Artigo aceito em 9 de março de 2006.