Ano: 2005 Vol. 71 Ed. 4 - Julho - Agosto - (9º)
Seção: Artigo Original
Páginas: 459 a 463
Efeito da mitomicina C na secreção de fator estimulador de granulócitos macrófagos e interleucina-5 em cultura de estroma de pólipos nasais eosinofílicos
Effect of mitomycin C on the secretion of granulocyte macrophages colonies stimulating factor and interleukin-5 in eosinophilic nasal polyps stromal culture
Autor(es): Paulo Fernando Tormin Borges Crosara , Anilton César Vasconcelos , Roberto Eustáquio Santos Guimarães , Helena Maria Gonçalves Becker , Celso Gonçalves Becker , Sandra Letícia Reis Crosara , Evaldo Nascimento
Palavras-chave: polipose, nasal, eosinófilo, GM-CSF, IL-5, mitomicina C.
Keywords: polyposis, nasal, eosinophil, GM-CSF, IL-5, mitomycin C.
Resumo:
O estudo de fatores teciduais, como a concentração de fator estimulador de colônias de macrófagos (GM-CSF) e interleucina 5 (IL-5), aponta para os mecanismos envolvidos na manutenção da eosinofilia em pólipos nasossinusais eosinofílicos. A mitomicina C (MMC) tem sido utilizada com bons resultados em otorrinolaringologia. Objetivo: Este estudo teve como objetivo avaliar a ação da Mitomicina C sobre a secreção de GM-CSF e IL-5 em pólipos eosinofílicos. Forma de estudo: caso-controle. Material e Método: O estudo foi comparativo experimental autopareado, com amostras de pólipos biopsiados de pacientes portadores de polipose nasossinusal eosinofílica. Os fragmentos semeados como grupo experimental receberam mitomicina C por 5 minutos na dosagem de 400microg/ml e então lavadas em meio RPMI. Nos tempos zero, 12 e 24 horas, o sobrenadante foi retirado para determinação dos níveis de GM-CSF em 22 pacientes e IL-5, em 19 pacientes, utilizando o método de ELISA. Resultado: Diminuição de secreção de GM-CSF nos grupos tratados com mitomicina C no tempo 24h (p<= 0,05); no grupo tratado houve expressão significativa de GM-CSF entre zero e 12 horas (p=0,013) demonstrando a viabilidade da cultura igualmente ao grupo não tratado; tendência à queda dos níveis de IL-5 no grupo tratado em 24h. Conclusão: O estudo demonstrou que a mitomicina C foi capaz de inibir a síntese de GM-CSF em culturas de pólipos nasais eosinofílicos e com provável ação sobre a secreção de IL-5, necessitando de estudos complementares.
Abstract:
The research involving tissue factors, such as granulocyte macrophage colonies stimulating factor (GM-CSF) and interleukin 5 (IL-5), leads to the mechanisms involved in the maintenance of eosinophilia, which is essential for the pathogenesis on eosinophilic nasal polyps. Mitomycin C has been successfully used in otolaryngology. Aim: The objective of this study was to evaluate the effect of mitomycin C in secretion of GM-CSF and IL-5 on eosinophilic nasal polyps. Study design: case-control. Material and Method: This is a comparative and auto-matched experimental study, performed with fragments of polyps which had been obtained from biopsy of patients with eosinophilic nasosinusal polyposis. The fragments of the experimental group were treated with mitomycin C (400 microg/ml) for 5 minutes and then washed in RPMI substrate. At time zero, 12 and 24 hours, the surface material was taken to determination of its GM-CSF levels in 22 patients and of IL-5 levels in 19 patients, by ELISA method. Results: Reduction in GM-CSF expression on the experimental group at time 24 h (p<= 0.05). The treated group presented significant GM-CSF expression between zero time and 12 h time (p=0.013) showing the culture viability such as in the non-treated group. Tendency to decreasing IL-5 levels on the treated groups at 24 hours. Conclusion: This study showed that mitomycin C was efficient in inhibiting GM-CSF synthesis with reduction of IL-5 secretion, but this fact needs complementary studies.
![]()
INTRODUÇÃO
A polipose nasossinusal - PNS - decorre de um processo inflamatório crônico da mucosa nasossinusal, com diferentes estágios de comprometimento das cavidades nasossinusais. A PNS eosinofílica representa 80 a 90% das PNS, associa-se com hiper-reatividade nasal e/ou brônquica e responde bem à corticoterapia. Engloba pacientes com diferentes fatores etiológicos e evoluções clínicas em relação às vias aéreas superiores e inferiores. A PNS eosinofílica é encontrada na rinite eosinofílica não-alérgica (NARES), na síndrome de Fernand-Widal, na atopia, na sinusite fúngica alérgica e na síndrome de Churg Strauss. A PNS acomete, principalmente, indivíduos adultos com prevalência entre 1 a 4% da população e freqüência aumentada mediante concomitância de asma brônquica não-alérgica, atingindo pico em torno dos 40 anos de idade.1,2
Os tratamentos de escolha para essa afecção são: uso de corticosteróides, que atuariam na redução do processo inflamatório determinado pelos eosinófilos, e o tratamento cirúrgico. A indicação cirúrgica é reservada aos casos que demonstram importante obstrução das cavidades nasais ou àqueles associados a infecções recorrentes da mucosa nasossinusal. Apesar dos relevantes avanços em pesquisa básica, pouco se progrediu em termos terapêuticos. É elevado o índice de recidiva, mesmo após procedimento cirúrgico.
O estudo do GM-CSF e da IL-5 justifica-se por se tratarem de citocinas extremamente importantes na diferenciação, migração, captação, ativação e sobrevida dos eosinófilos. São produzidas pelos eosinófilos em elevadas quantidades nos sítios inflamatórios, resultando num ciclo de estimulação auto-sustentável. Tais citocinas associadas aos eosinófilos adquirem, portanto, papel fundamental na fisiopatologia das PNS eosinofílicas.2-6
O uso da MMC adquire grande importância por se tratar de droga antineoblástica e antibiótica que atua como agente alquilante, inibindo o DNA, a síntese protéica e, sabidamente, os fibroblastos em culturas de células. A MMC já foi usada experimentalmente na prevenção de estenoses em antrostomias maxilares, na cirurgia de glaucoma e pterígio, nas miringotomias e estenoses laríngeas.7-10
O objetivo deste estudo foi avaliar a ação da Mitomicina C sobre a síntese de fator estimulador de colônias de granulócitos macrófagos (GM-CSF) e interleucina 5 (IL-5).
MATERIAL E MÉTODO
A população estudada foi constituída por pacientes portadores de PNS extensa, com faixa etária entre 16 e 79 anos, encaminhados pelo Sistema Único de Saúde - SUS - para realização de tratamento cirúrgico no Hospital São Geraldo, anexo do Hospital das Clínicas da Universidade Federal de Minas Gerais - HC-UFMG.
Foram selecionados 22 pacientes portadores de PNS eosinofílica, com porcentagem de eosinófilos igual ou superior a 40%11, no período de janeiro a junho de 2003. Pacientes portadores de poliposes não-eosinofílicas como fibrose cística, síndrome de Kartagener, pólipo antro-coanal ou PNS eosinofílica em vigência de infecção foram excluídos deste estudo.
Os pacientes selecionados foram submetidos ao exame otorrinolaringológico completo, com especial atenção ao segmento nasal. As fossas nasais foram exploradas via rinoscopia anterior e fibronasolaringoscopia.
Foi realizado estudo comparativo experimental autopareado com 22 amostras de pólipos eosinófilos. O grupo de estudo foi composto por culturas de fragmentos dos pólipos tratados com MMC e avaliados em zero, 12 e 24 horas para cada paciente. O grupo controle foi composto por culturas de fragmentos dos pólipos não-tratados com MMC e avaliados nos mesmos tempos/hora.
Foram realizadas biópsias dos pólipos nasais tanto para caracterização da eosinofilia como para cultura. Os fragmentos obtidos para avaliação de eosinofilia foram imediatamente fixados em formol a 10% e encaminhados para exame histopatológico com coloração pela hematoxilina-eosina (HE). Considerou-se eosinofílico o achado de pelo menos 40% de eosinófilos dentre as células inflamatórias e/ou a presença de pelo menos quatro eosinófilos por quatro campos microscópicos de grande aumento.11
As biópsias dos pólipos nasais obtidas para cultura foram realizadas no próprio ambulatório de Otorrinolaringologia do HC-UFMG. Os fragmentos retirados foram imediatamente acondicionados em meio de cultura à temperatura ambiente. Os fragmentos foram seccionados em seis porções de 3 mm3 e semeados numa placa de seis orifícios contendo 0,5ml de meio RPMI. Destes seis compartimentos, três formaram o grupo experimental e três o grupo controle. No grupo experimental aplicou-se MMC por cinco minutos, na dosagem de 400 µg/ml.9 Após a aplicação da droga, as culturas foram lavadas no meio RPMI. Para o grupo controle, não tratado com MMC, realizou-se a mesma manipulação somente com meio RPMI. Os fragmentos e meio de cultura contidos nos dois primeiros compartimentos, controle e experimento, foram imediatamente congelados para posterior emprego do método Enzime Linked Immunosorbent Assay (ELISA). Os outros dois pares de amostras, cada qual contendo controle e experimento, foram incubadas por 12 e 24 horas, respectivamente, em estufa a 37° C e 0.5% de CO2 até o momento da coleta e congelamento.
O meio de cultura utilizado foi RPMI 1640, comercializado por Gibco UK, contendo 5% de soro humano AB, 2 m M de mercaptoethanol, 1 mM L-glutamina, 2mM piruvato de sódio, 10m gr/ml de estreptomicina, 100U/ml de penicilina e 5mg/ml de fungisona.12
À zero, 12 e 24 horas, as culturas foram conservadas à temperatura de 80°C negativos até o momento da análise. Após descongelamento à temperatura ambiente, as culturas foram centrifugadas a 3° centígrados durante 10 minutos a 15.000 rpm.12 Os sobrenadantes foram então submetidos ao método ELISA para determinação dos níveis de GM-CSF e IL5. Kits R&D Systems: Duoset® Human GM-CSF / Catálogo: DY215; Duoset® Human IL-5 Catálogo: DY205.12 Dos pacientes biopsiados, 22 foram submetidos à análise para quantificação de GM-CSF e 19 para IL-5.
O método utilizado para análise estatística foi o teste t pareado para comparar os grupos em cada um dos tempos considerados, segundo Snedecor et Cochran (1977).13 Foi considerado nível de significância de 5% e utilizado o pacote estatístico Minitab, versão 13, na análise estatística dos dados.
O trabalho foi previamente aprovado pelo Comitê de Ética em Pesquisa da UFMG.
RESULTADOS
Dos 22 experimentos avaliados para determinação dos níveis de GM-CSF, em três não foi obtido tamanho suficiente para cultura na hora 24, sendo 19 experimentos avaliados nesse tempo.
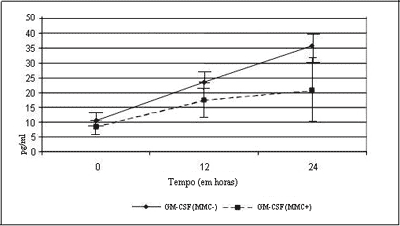
A Figura 1 demonstra o comportamento da expressão do GM-CSF nas culturas. Pode ser observado que, no tempo zero, as culturas, com ou sem MMC, não apresentaram diferença estatística entre o dois grupos (p= 0,362). No tempo de hora 12, o comportamento da curva revela que o grupo que recebeu MMC apresentou níveis mais baixos para GM-CSF em relação ao grupo controle, porém sem diferença estatisticamente significativa (p= 0,570). No tempo de hora 24, a curva mostra diferença estatisticamente significativa entre os dois grupos (p £ 0,05).
Avaliando-se separadamente a expressão de GM-CSF nos dois experimentos, observou-se que no grupo sem MMC, entre hora zero e hora 12, não houve diferença estatisticamente significativa (p= 0,087). Entre hora zero e hora 24, houve diferença significativa (p= 0,048). Não houve diferença significativa entre hora 12 e hora 24 (p= 0,409), mesmo que na hora 24 tenha ocorrido aumento nos níveis de GM-CSF.
Analisando-se, da mesma forma, o grupo com aplicação de MMC, temos um comportamento semelhante, com diferenças estatisticamente significativas para zero e 12 horas (p= 0,013) e limítrofe entre zero e 24 horas (p= 0,068), não sendo observadas diferenças significativas nas comparações entre 12 e 24 horas (p= 0, 606), ainda que os níveis de GM-CSF tenham sido maiores em 24 horas.
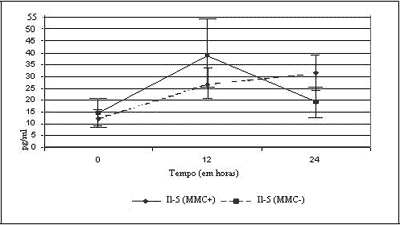
A Figura 2 mostra as curvas de expressão de IL-5 nas culturas estudadas. Dos 19 experimentos, dois não obtiveram tamanho suficiente para cultura na hora 24, sendo somente 17 experimentos avaliados nesse tempo.
Quando comparados em tempo hora zero, observa-se que não houve diferença estatisticamente significativa entre os grupos (p= 0,362). A curva mostra maior expressão de IL-5 no grupo tratado com MMC, mas essa diferença não foi significativa em 12 horas (p= 0,281), com nítida queda dos níveis de IL-5 a partir deste tempo. Por outro lado, as culturas controle, não tratadas com MMC, mantiveram-se em crescente expressão de IL-5, não se observando, entretanto, diferença significativa entre os dois grupos no tempo de 24 horas (p= 0,105).
Ao se analisar os dois grupos separadamente, observou-se que, nas culturas sem MMC, houve diferença estatisticamente significativa na expressão de IL-5 entre zero e 12 horas (p= 0,046), bem como entre zero e 24 horas (p= 0,027). Entre 12 e 24 horas não houve diferença significativa (p= 0,671). Nas culturas tratadas com MMC, não se encontrou diferença significativa entre zero e 12 horas (p= 0,114), zero e 24 horas (p= 0,635), bem como entre 12 e 24 horas (p= 0,112).
DISCUSSÃO
O estudo da fisiologia dos eosinófilos demonstrou que essas células desempenham papel essencial na resposta inflamatória alérgica e antiparasitária, apresentando grande capacidade de interação com outras células através de receptores específicos. São extremamente versáteis e produzem uma gama de substâncias capazes de provocar lesão tecidual e outras que podem ampliar e perpetuar a resposta inflamatória.14
Os eosinófilos têm meia-vida sérica de, aproximadamente, 18 horas, mas podem permanecer por semanas nos tecidos, na dependência de estímulos ambientais.15 Os pequenos grânulos eosinofílicos são responsáveis pelo acúmulo de substâncias tóxicas, tais como proteínas básicas maiores (MBP), proteínas catiônicas eosinofílicas (ECP) e peroxidases eosinofílicas (EPO). Estas últimas estão envolvidas na citotoxicidade contra parasitas e tecidos, como ocorre na asma brônquica, urticária e PNS eosinofílica.16
Cara, Negrão-Corrêa e Teixeira (2000)14 fizeram uma excelente revisão sobre a fisiologia dos eosinófilos. Segundo os autores, os eosinófilos expressam receptores para várias moléculas como: imunoglobulinas (IgG, IgE, IgA), complemento (C1q, C3b/C4b, iC3b, C5a), quimiocinas (eotaxina, eotaxina-2, RANTES, MCP-3, MCP-4), citocinas (IL-3, IL-5 e GM-CSF), mediadores lipídicos (PAF, LTB4 ) e, finalmente, esteróides (estrogênio e glucocorticóides). Através desses receptores os eosinófilos podem interagir com o meio ambiente. Além desses receptores, existem também os antígenos determinantes de agrupamento (ADA), entre os quais citam-se: as moléculas de adesão celular (MACs) CD11/CD18, VLA-4,(?4?1), ?4?7 e CD62L (L-selectina).
Na última década, os eosinófilos têm sido relacionados a doenças inflamatórias eosinofílicas, não havendo diferença significativa entre os processos patológicos da eosinofilia nas PNS, na asma intrínseca ou extrínseca. Em vários trabalhos, os eosinófilos são considerados as principais células envolvidas na gênese dessas doenças.5,6 Desta forma, foram considerados válidos, neste estudo, quaisquer tipos de PNS eosinofílica, não sendo feita distinção entre os casos estudados. Kramer et al. (2000)17 sugeriram que os mecanismos envolvidos na gênese das poliposes eosinofílicas, de origem alérgica ou não, são semelhantes.
Clutterbuck, Hirst e Sanderson (1989)18, utilizando IL-5, IL-3 e GM-CSF recombinantes em culturas de medula óssea humana, verificaram que a IL5 estimula especificamente a diferenciação dos eosinófilos, sem influenciar outras linhagens como eosinófilos/basófilos ou eosinófilos/eritrócitos. A IL-3 e o GM-CSF, em alta concentração, tanto estimulavam colônias de eosinófilos como de neutrófilos e colônias mistas de eosinófilos e granulócitos macrófagos. Atuando conjuntamente, IL-5, IL-3 e GM-CSF apresentavam um efeito aditivo e não sinérgico, mesmo com baixas concentrações de IL3 e GM-CSF.
Segundo Sanderson (1992)19, a IL-5 é importante e específica na diferenciação dos eosinófilos. Nesse mesmo trabalho o autor manipulou geneticamente camundongos, conseguindo uma linhagem com aumento na produção de IL-5 e o achado de hiper-eosinofilia. A experiência contrária foi desenvolvida por Foster et al. (1996)20 e Kopf et al. (1996)21, na qual linhagens de camundongos com baixos níveis de IL5 resultaram em hipo-eosinofilia, mesmo após estimulação com alérgenos. Sabe-se que, sozinha ou em sinergismo com a IL-5, a eotaxina é capaz de liberar eosinófilos da medula óssea para a corrente sanguínea.22
Lacy e Moqbel (1997)23 concluíram que a importância da síntese de GM-CSF pelos eosinófilos reside nas suas ações autócrina e parácrina, capazes de ativar e prolongar a sobrevida dos próprios eosinófilos in vivo.
A MMC é um agente antiblástico alquilante descoberto por Hata et al. (1956)24 e age na inibição da síntese de DNA.25 Ela foi capaz de induzir apoptose em células de tumores gástricos.26 Kim et al. (1999)27 observaram que a MMC (0,4 mg/ml por cinco minutos) induziu, in vitro, a apoptose de fibroblastos humanos da cápsula de Tenon.
O teste de ELISA tem mostrado elevadas sensibilidade e especificidade em vários trabalhos envolvendo PNS eosinofílica com pesquisa de IL-5 e GM-CSF.2-4,17
Os resultados obtidos neste ensaio demonstraram que os níveis de GM-CSF foram significativamente mais baixos para as culturas tratadas com MMC em 24 horas, (p£ 0,05). Provavelmente, pelo tamanho da amostra envolvida (n=22), não foi possível detectar diferença significativa em 12 horas, mas devido ao maior acúmulo de citocinas em 24 horas, foi encontrada diferença estatisticamente significativa com 19 pacientes, (p £ 0,05). Esse acúmulo crescente, sinal da viabilidade das culturas teciduais, foi demonstrado pela diferença estatisticamente significativa entre hora zero e 12 (p= 0,013) e limítrofe entre hora zero e 24 (p= 0,068) para as culturas tratadas com MMC.
No grupo não tratado com MMC ocorreu o mesmo padrão de acúmulo, com diferença significativa hora zero e 24 (p= 0,048). Não foi possível detectar uma diferença estatisticamente significativa entre hora 12 e 24 nos dois grupos (p= 0,606 - com MMC) e (p= 0,409 - sem MMC) provavelmente pelo tamanho da amostra envolvida (n= 19), não suficientemente expressivo para detecção estatística nestes tempos. Esses resultados são condizentes com o a literatura, que demonstra redução na expressão de GM-CSF mediante uso de corticosteróides na PNS eosinofílica.28-30
Os resultados da ação da MMC na síntese de IL-5 não encontraram diferença significativa entre os dois grupos, com ou sem tratamento de MMC, nos tempos zero, 12 e 24 horas. Os valores de p foram: p= 0,362, p= 0,281 e p= 0,105, respectivamente.
Ao observarmos a curva de secreção de IL-5 somente no grupo tratado com MMC, nota-se maior produção inicial da citocina em 12 horas e uma queda abrupta em 24 horas. Nesse mesmo grupo, devido à grande variação dos resultados, com grande desvio-padrão, não se observou diferença entre os tempos hora zero e 12 (p= 0,114), hora zero e 24 (p= 0,635) e hora 12 e 24 (p= 0,112). Na Figura 2, observa-se que os níveis de secreção de IL-5 caem rapidamente entre 12 e 24 horas, o que sugere uma ação da droga neste grupo.
Com relação à IL-5 não foi observada a ação da MMC conforme esperado nos objetivos, mesmo com tendência à redução dos níveis desta citocina (Figura 2). Entretanto, como não houve controle prévio do tamanho das amostras não se pode concluir que a MMC não tenha ação sobre a secreção de IL-5, sendo necessário estudo adicional.
O grupo não tratado com MMC mostrou-se mais homogêneo, com resultados semelhante aos encontrados na pesquisa do GM-CSF. Houve diferenças estatisticamente significativas entre zero e 12 horas (p= 0,046) e entre zero e 24 horas (p= 0,027). Não houve diferença significativa entre 12 e 24 horas (p= 0,671), provavelmente devido à falta de nutrientes na cultura. Observou-se que as culturas permaneceram viáveis, com produção crescente de IL-5.
Figura 1. Curvas de expressão de GM-CSF, com e sem aplicação de MMC
Figura 2. Curvas de expressão de IL-5, com e sem aplicação de MMC
CONCLUSÕES
Os dados do presente estudo demonstraram que a mitomicina C foi capaz de inibir significativamente a síntese de GM-CSF. Os dados obtidos em relação à expressão de IL-5 indicam forte tendência à redução dessa citocina induzida pela mitomicina C.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Becker HMG, Guimarães RES, Nascimento E, Becker CG, Gonçalves DU, Crosara PFTB. Perfil das citocinas e tipificação de hla em pacientes com polipose nasossinusal eosinofílica tolerantes e intolerantes a aspirina. Rev Bras Oto 2003; 69 (3): 296-302.
2. Voegels RL. Study of interleukins 1, 3, 4, 5 before and after surgery of patients with nasal polyposis. Otolaryngology Head And Neck Surgery 2003; 129 (2): P214.
3. Mullol J, Xaubet A, Gaya A, Roca-Ferrer J, Lopez E, Fernandez JC, Fernandez MD, Picado C. Cytokine gene expression and release from epithelial cells. A comparison study between healthy nasal mucosa and nasal polyps. Clin Exp Allergy 1995; 25 (7): 607-15.
4. Xaubet A, Mullol J, Lopez E, Roca-Ferrer J, Rozman M, Carrion T, Fabra JM, Picado C. Comparison of the role of nasal polyp and normal nasal mucosal epithelial cells on in vitro eosinophil survival. Mediation by GM-CSF and inhibition by dexamethasone. Clin Exp Allergy 1994; 24 (4): 307-17.
5. Jankowiski R. Eosinophils in the Pathophysiology of Nasal Polyposis. Acta Otolaryngol (Stockh) 1996; 116:160-63.
6. Kotsimbos ATK, Hamid Q. IL-5 and IL-5 receptor in asthma. Mem Inst Oswaldo Cruz 1997; 92 Suppl. (2)75-91.
7. Ingrams DR, Volk MS, Biesman BS, Pankratov MM. Sinus Surgery: Does Mitomycin C Reduce Stenosis. Laryngoscope 1998: 108.
8. Cardillo JÁ, Alves MR, Ambbrosio LE, Poteiro MB, Jose NK. Single intraoperative application versus postoperative mitomycin C eye drops in pterygium surgery. Ophtalmology 1995; 102 (12): 1949-52.
9. Khaw PT, Doyle JW, Sherwood MB, Grierson H, Shultz G, Megorray S. Prolonged localized tissue effects from 5 minutes exposures fluoracil and mitomycin C. Arch Ophtalmol 1994; 72: 155-61.
10. Becker CG, Silva AL, Guimarães RES, Becker HM, Barra IM, Oliveira WD. Tratamento cirúrgico da otite media com efusão: tubo de ventilação versus aplicação tópica de mitomicina C. Rev Bras Otorrinolaringol jul/ago 2003; 69 (4): 513-9.
11. Ingels K, Durdurez JP, Cuvelier C, Cauwenberge PV. Nasal biopsy is superior to nasal smear for finding eosinophils in nonallergic rhinits. Allergy 1997; 52(3): 338-41.
12. Teram LM, Park HS, Djukanovic R, Roberts K, Holgate S. Cultured nasal polyps from nonatopic and atopic patients release RANTES spontaneously and after stimulation with phytohemagglutinin. J Allergy Clin Immunol Oct. 1997; 100 (4): 499-504.
13. Snedercor GW, Cochran WG. Statistical Methods. AMES: Iowa State University Press; 1977.
14. Cara DC, Negrão-Correa D, Teixeira MM. Mechanism underlying eosinophil trafficking and their relevance in vivo. Histol Histophatol 2000; 15: 899-919.
15. Rothemberg ME, Owen WFJr, Silberstein DS, Soberman RJ, Austen KF, Stevens RL. Eosinophils cocultured with endothelial cells have increased survival and functional properties. Science 1987; 237: 645-7.
16. Tai P, Spry CJF, Peterson C, Venge P, Olsson I. Monoclonal antibodies distinguish forms of eosinophil cationic protein. Nature 1984; 309: 182-4.
17. Kramer MF, Ostertag P, Pfrogner E, Rasp G. Nasal interleukin-5, immunoglobulin E, eosinophilic cationic protein, and soluble intercelular adhesion molecule-1 in chronic sinusitis, allergic rhinitis, and nasal polyposis. Laryngoscope 2000; 110(6): 1056-62.
18. Clutterbuck EJ, Hirst EMA, Sandersom CJ. Human Interleukin-5 (IL-5) Regulates the production of eosinophils in human bone marrow cultures, Comparison and Interaction with Il-1, IL-6 and GM-CSF. Blood 1989; 73: 1504-12.
19. Sanderson CJ. Interleukin-5, eosinophils and disease. Blood 1992; 79: 3101-9.
20. Kopf M, Brombacher F, Hodgkin P, Ramsay AJ, Milbourne EA, Dai WJ, Ovington KS, Bhen CA, Kholeer G, Young IG, Matthaei KI. IL-5 deficient mice have a developmental defect in CD5+ B-1 cells and lack eosinophilia but have a normal antibody and citotoxic T cell responses. Immunity 1996; 4: 15-24.
21. Foster PS, Hogan SP, Ramsay AJ, Matthaci KY, Young IG. Interleukin-5 deficiency abolish eosinophilia, airways hyperreactivity and lung damage in a mouse asthma model. J Exp Med 1996; 183: 195-201.
22. Collins PD, Marleau S, Griffiths-Johnson DA, Jose PJ, Williams PJ. Cooperation between interleukin-5 and the cemokine eotaxin to induce eosinophil accumulation in vivo. J Exp Med 1995; 182: 1169-74.
23. Lacy P, Moqbel R. Eokines, Syntesis, Storage and Release from human Eosinophils. Mem Inst Oswaldo Cruz 1997; (92 Suppl) (2): 125-33.
24. Hata T, Sano Y, Sugawara R, Matsumae A, Kanamorei K, Shima T, Hoshi T. Mitomicin a new antibiotic from Streptomyces. J Antibiot Ser 1956; a-9: 141-6.
25. Szybalski W, Lyer VN. Cross-linking of DNA by enzymatically or chemically activated mitomicins and porfiromycins bifunctionaly alkilating antibioics. Fed Proc 1964; 23: 946-57.
26. Schwartz GK, Haimovtz-Friedman A, Dhupar SK, Ehleiter D, Maslak P, Lau L, Laganzo FJr, Kelsen DP, Fucks Z, Alpino AP. Potentiation of apoptosis by treatment with protein kinase-c specific inhibitor safingol in mitomycin c treated gastric cancer cells. J Nat Cancer Inst 1995; 87: 1394-99.
27. Kim JW, Kim SK, Song IH, Kim IT. Mitomycin C-induced apoptosis in cultured human Tenon's capsule fibroblasts. Korean J Ophthalmol Jun. 1999; 13 (1): 7-15.
28. Bjornson BN, Harvey JM, Rose L. Differential effects of hydrocortisone on eosinophil and neutrophil proliferention. J Clin Invest 1985; 76:924-9.
29. Liles C, Dale DC, Klebanoff SJ. Glucocorticoids inhibits apoptosis of human neutrophils. Blood 1995; 86 (8): 3181-8.
30. Meagher LC, Cousin JM, Seckl JR, Haslett C. Opposing effects of glucocorticoids on the rate of apoptosis in neutrophilic and eosinophilic granulocytes. J Imunnol 1996; 156: 4422-8.
Professor Substituto.
Professor Adjunto do Departamento de Patologia Geral da Universidade Federal de Minas Gerais.
Professor Livre-Docente do Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de Minas Gerais.
Doutor pelo Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de Minas Gerais.
Doutor pelo Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de Minas Gerais.
Residente do Núcleo de Otorrino-BH.
Professor Adjunto do Departamento de Parasitologia da Universidade Federal de Minas Gerais.
CAPES.
Trabalho realizado no Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia da Universidade Federal de Minas Gerais. Laboratório de Imunologia: Professor Evaldo Nascimento.
Endereço para correspondência: Dr. Paulo Fernando Tormin Borges Crosara - Rua Bernardo Guimarães 2053 ap. 1602 Lourdes Belo Horizonte MG 30140-082.
Tel/Fax: (0xx31) 3281-4604 - E-mail: paulocrosara@hc.ufmg.br
Artigo submetido em 11/4/2005 e aprovado em 31/5/2005.