Ano: 2005 Vol. 71 Ed. 3 - Maio - Junho - (13º)
Seção: Artigo Original
Páginas: 346 a 354
Avaliação da sialometria e biópsia de glândula salivar menor na classificação de pacientes com Síndrome de Sjögren
Evaluation of sialometry and minor salivary gland biopsy in classification of Sjögren's Syndrome patients
Autor(es): Bianca Maria Liquidato1, Ivo Bussoloti Filho2
Palavras-chave: Síndrome de Sjögren, xerostomia, glândulas salivares, saliva, diagnóstico.
Keywords: Sjögren's syndrome, xerostomia, salivary glands, saliva, diagnosis.
Resumo:
A Síndrome de Sjögren é afecção auto-imune das glândulas exócrinas, que envolve particularmente as glândulas salivares e lacrimais. Não existe exame de certeza para diagnóstico. Objetivo: Avaliação da importância do papel da biópsia de glândula salivar menor e da sialometria, isoladamente ou associadas, como métodos utilizados para a classificação da Síndrome de Sjögren. Forma de estudo: Coorte transversal. Casuística e Método: Todos os 72 pacientes com queixa de boca seca, de janeiro de 1997 a setembro de 2003, foram submetidos à investigação diagnóstica e classificação com base nos critérios estabelecidos. A sialometria não-estimulada foi realizada com a técnica do swab. Os exames histopatológicos foram avaliados quanto à presença de focos inflamatórios. Resultados: A sialometria não-estimulada e a biópsia de glândula salivar menor apresentaram sensibilidades diferentes para Síndrome de Sjögren primária e Síndrome de Sjögren secundária. A sialadenite focal com maior número de focos foi característica da Síndrome de Sjögren primária. Compararam-se biópsia e sialometria e observou-se que a especificidade e o valor preditivo positivo da biópsia foram maiores. Entre biópsia e biópsia associada à sialometria, a biópsia teve maior sensibilidade e maior valor preditivo negativo. A especificidade da biópsia associada à sialometria foi maior. Entre sialometria e biópsia associada à sialometria, a biópsia associada à sialometria apresentou maior valor preditivo positivo e maior especificidade. A sensibilidade da sialometria foi maior. Conclusões: Os testes sialometria e biópsia apresentaram desempenhos diferentes nos pacientes com Síndrome de Sjögren primária e secundária; a positividade dos dois critérios em conjunto aumenta muito a especificidade para Síndrome de Sjögren (95%).
Abstract:
Sjögren's Syndrome is an autoimmune disease of the exocrine glands, mainly salivary and lachrymal glands. There is no gold standard test for diagnosis. Aim: evaluation of the importance of minor salivary gland biopsy and sialometry, isolated or associated, as methods for classification of Sjögren's Syndrome. Study design: Transversal cohort. Patients and Method: Seventy-two patients that reported dry mouth from January 1997 to September 2003 were investigated and classified, based on the established criteria. Non-stimulated sialometry was performed by the swab technique. Histopathology exams were evaluated for the presence of inflammatory focus. Results: Non-stimulated sialometry and minor salivary gland biopsy presented different sensitivities for primary Sjögren's Syndrome and for secondary Sjögren's Syndrome. Focal sialadenitis with higher focus score was characteristic of primary Sjögren's Syndrome. Biopsy and sialometry were compared and it was observed that specificity and positive predictive value of biopsy were higher. Comparing biopsy and biopsy associated with sialometry, it was observed that biopsy had higher sensitivity and negative predictive value. Specificity of biopsy associated with sialometry was higher. Comparing sialometry and biopsy associated with sialometry, it was observed that biopsy associated with sialometry presented higher positive predictive value and higher specificity. Sialometry's sensitivity was higher. Conclusions: Sialometry and biopsy tests presented different performances in primary Sjögren's Syndrome and secondary Sjögren's Syndrome; the positivity of the association of both tests increases the specificity for Sjögren's Syndrome (95%).
![]()
INTRODUÇÃO
A Síndrome de Sjögren é uma afecção auto-imune das glândulas exócrinas, que envolve particularmente as glândulas salivares e lacrimais. Seu espectro clínico é muito amplo, podendo restringir-se apenas a uma diminuição do lacrimejamento e xerostomia, ou mesmo cursar com acometimento articular, pulmonar e renal. A Síndrome de Sjögren primária ocorre isoladamente, enquanto a Síndrome de Sjögren secundária se manifesta concomitante a outra doença auto-imune, principalmente lúpus e artrite reumatóide.1
A Síndrome de Sjögren acomete principalmente o sexo feminino, com uma prevalência de 9 mulheres para um homem, e a idade de estabelecimento dos sintomas é em torno dos 40 a 45 anos. É rara em criança2.A idade média de diagnóstico é 50 anos3. Sua prevalência real é difícil de ser estabelecida em razão da dificuldade de diagnóstico, mas estima-se que seja de 1% a 3% da população1.
Existe um infiltrado inflamatório tecidual que acomete os órgãos-alvo, que é composto na maioria (60% a 70%) por linfócitos T CD4 e por uma minoria de linfócitos B. No entanto, existe uma hiperatividade das células B com produção mono ou policlonal de imunoglobulinas IgM ou IgG. As células epiteliais das glândulas salivares expressam citocinas, como interleucina 1b, interleucina 6 e TNFa. A resposta auto-imune é direcionada para as ribonucleoproteínas Ro/SS-A, com duas cadeias protéicas de 52 e 60 kDa (citoplasmática) e La/SS-B (nuclear) de 48 kDa. O mecanismo que pode ser o responsável pelo processo auto-imune é a apoptose das células epiteliais, em que auto-antígenos intracelulares são expostos ao sistema imune na superfície das bolhas apoptóticas4.
Mais de um terço dos pacientes apresentam manifestações sistêmicas, que podem incluir vasculite, crioglobulinemia, hepatite auto-imune, fibrose pulmonar, envolvimento do sistema nervoso central, acidose tubular renal, linfoma de células B e mieloma múltiplo1,2,4. Assim, o diagnóstico adequado do quadro é importante não somente para aliviar os sintomas do paciente3, mas também para um acompanhamento clínico das suas possíveis complicações, já que estes são eventos tardios no curso da síndrome5.
A saliva tem papel importantíssimo na gustação, mastigação, deglutição e fala, em razão do papel de lubrificante da cavidade oral, além disso, várias enzimas que compõem a saliva atuam como antimicrobianos6. A diminuição da saliva leva a repercussões na deglutição e na fala, com complicações como candidíase eritematosa e cáries.
Vários estudos tentaram estabelecer critérios de classificação para a Síndrome de Sjögren, já que não existe um exame de certeza para diagnóstico do quadro. Tais critérios começaram a ser empregados em diferentes serviços, dificultando a interpretação de dados na literatura internacional. Um estudo multicêntrico realizado em 12 países, orientado pelo Grupo de Estudo da Comunidade Européia sobre Critérios para Diagnóstico da Síndrome de Sjögren, procurou estabelecer critérios e testar sua especificidade e sensibilidade, a fim de que possam ser usados critérios confiáveis de maneira a uniformizar os diagnósticos1,7,8. Para Síndrome de Sjögren primária são necessários 4 critérios positivos dentre 6. Para Síndrome de Sjögren secundária, a presença de 3 critérios específicos é suficiente.
A técnica de sialometria utilizada nos estudos do Grupo de Estudo da Comunidade Européia é a da simples coleta da saliva durante 15 minutos, para a não-estimulada, e coleta durante 5 minutos, após mascar parafina, para a estimulada. A sialometria não-estimulada foi preferida por sofrer menor influência da idade do indivíduo1,7.
A positividade dos auto-anticorpos varia, sendo cerca de 70% para anti-SSA e 60% para anti-SSB, de acordo com o método utilizado para sua detecção.
A biópsia de glândula salivar menor é o exame de maior acurácia8, porém não é um critério sine qua non para o diagnóstico de Síndrome de Sjögren e que, juntamente com os auto-anticorpos, são considerados os exames mais específicos.
Nos últimos anos várias pesquisas têm se voltado para métodos não-invasivos para o diagnóstico da Síndrome de Sjögren, especialmente, através de dosagem de substâncias presentes no processo inflamatório na saliva e nas lágrimas. Contudo, ainda não existem estudos definitivos que validem o seu uso como critérios de diagnóstico. Outros exames de imagem, como a sialografia por ressonância magnética, vêm sendo estudados como alternativa não-invasiva à sialografia tradicional, tentando evitar as possíveis complicações que incluem trauma do ducto, dor à injeção do contraste, infecção e reação alérgica.
A participação do otorrinolaringologista é fundamental no estabelecimento deste diagnóstico, não apenas para a realização da biópsia de glândula salivar menor mas também na avaliação do envolvimento glandular, sempre buscando a realização de exames menos invasivos. A sialometria com a técnica de pesagem do algodão, que vem sendo utilizada no nosso serviço9, tem se mostrado de execução bastante fácil e prática em relação às demais e menos invasiva que a sialografia de parótidas.
Na prática diária um diagnóstico de Síndrome de Sjögren pode ser feito apenas com impressões clínicas, contudo, para a inclusão de um paciente em estudos científicos, é necessário que exista comprovação diagnóstica através de critérios obtidos pela história clínica e exames objetivos10,11.
O presente estudo tem como objetivo a avaliação da importância do papel da biópsia de glândula salivar menor e da sialometria, isoladamente ou associadas, como métodos utilizados para a classificação da Síndrome de Sjögren, com base nos critérios estabelecidos pelos trabalhos do Grupo de Estudo da Comunidade Européia e Consenso Americano-Europeu1,7,8,11,12.
CASUÍSTICA E MÉTODO
Todos os 72 pacientes com queixa de boca seca que procuraram o Departamento de Otorrinolaringologia da Santa Casa de São Paulo, de janeiro de 1997 até setembro de 2003, foram avaliados clinicamente no Ambulatório de Estomatologia da instituição e foram submetidos à investigação diagnóstica e classificação, com base nos critérios estabelecidos no Consenso Americano-Europeu11 (Quadro 1).
Estes pacientes foram divididos em 2 grupos: grupo que não apresentava Síndrome de Sjögren (NSS) e grupo com Síndrome de Sjögren (SS). O grupo com Síndrome de Sjögren foi dividido em 2 subgrupos: com Síndrome de Sjögren primária (SSp) e Síndrome de Sjögren secundária (SSsec).
Para classificar os pacientes com Síndrome de Sjögren primária foi considerada necessária a presença de 4 dos 6 itens, com obrigatoriedade da presença do item IV (histopatologia) ou item VI (auto-anticorpos). Em relação à classificação dos pacientes com Síndrome de Sjögren secundária, esta foi feita com a presença do item I ou item II mais quaisquer 2 dos itens III, IV e V (Quadro 1).
Foram considerados critérios de exclusão para classificação de Síndrome de Sjögren: radioterapia anterior de cabeça e pescoço; hepatite C; SIDA; linfoma pré-existente; sarcoidose; doença enxerto versus hospedeiro; uso de drogas anti-colinérgicas. Foi excluída também uma paciente com Granulomatose de Wegener.
O tempo de evolução da doença foi considerado como o decorrido entre o início dos sintomas até a chegada ao Ambulatório de Estomatologia do Departamento de Otorrinolaringologia.
A sialometria não-estimulada foi realizada com a técnica de coleta da saliva, através de um par de chumaços de algodão que haviam sido, previamente, pesados em conjunto com pote coletor universal, com capacidade para 80 ml, numa balança digital modelo. Os pacientes eram orientados a deglutir toda a saliva que tivessem na cavidade oral e os chumaços de algodão eram colocados no assoalho da boca próximo ao rebordo gengival, onde permaneciam durante 2 minutos. Após este tempo, o conjunto foi novamente pesado. A diferença de peso foi transformada de g/min diretamente em ml/minuto e foram consideradas alteradas as sialometrias com valor menor que 0,1 ml/minuto.
A técnica para biópsia das glândulas salivares menores, escolhida como preferencial, foi aquela em que é feita uma incisão horizontal na face mucosa do lábio inferior paralela à parte vermelha, com retirada de 4 a 6 glândulas salivares menores, sem retirada de mucosa labial. Este material foi colocado em frascos com formol a 10%, processado com inclusão em parafina, submetido a secções em micrótomo rotativo, obtendo-se cortes com 3 micrômetros de espessura. Os cortes foram corados com hematoxilina e eosina (HE) e submetidos a exame histológico. As lâminas foram posteriormente revisadas, com uso de microscópio Zeiss modelo Axioskop 40, acoplado a um computador com processador Intel Pentium III e com auxilio do programa Axiovision 3.1, para delimitação de área de tecido glandular. Nesta revisão, o tecido glandular foi medido com uso do cursor nos diversos campos, com o aumento de 50X, e os exames histopatológicos foram avaliados quanto à presença de infiltrado inflamatório e presença de focos inflamatórios, que consistem em aglomerados de pelo menos 50 células linfocitárias. A contagem de focos na área total de tecido glandular de cada exame foi corrigida em cada um para a correspondente em 4 mm2. As lâminas com as respectivas áreas medidas de tecido glandular foram fotografadas, num total de 280 fotos.
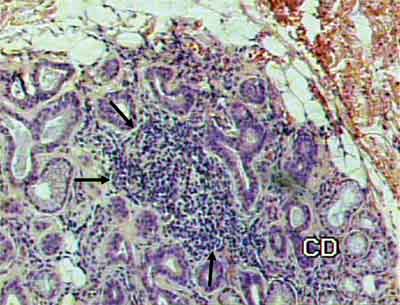
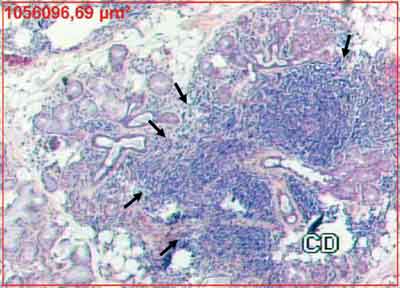
Os aspectos histopatológicos foram graduados em: glândula normal; processo inflamatório leve; processo inflamatório moderado; processo inflamatório acentuado; e presença de foco inflamatório (Figuras 1 e 2).
Pelo Método Estatístico eleito, foram utilizados os valores mínimo, máximo, mediana, média e desvio padrão, na descrição das variáveis quantitativas, e os testes de Wilcoxon, para amostras independentes e de Kruskal-Wallis, para as respectivas comparações entre 2 e mais de 2 grupos. No caso em que se detectou diferença estatisticamente significativa entre os grupos, comparações múltiplas foram realizadas pelo teste de Dunn, para a identificação das diferenças.
O coeficiente de correlação de Pearson foi utilizado para o estudo da associação entre o número de focos e o tempo de evolução do quadro.
Foram calculados os índices de sensibilidade, especificidade, valores preditivos positivo e negativo e acurácia dos exames de biópsia, sialometria e combinações dos resultados de ambos. A comparação de tais índices entre os exames foi realizada através de modelos lineares para dados categorizados, utilizando-se a estatística de Wald. O nível de significância adotado em todas as comparações foi de 5%.
Este estudo foi aprovado pela Comissão de Ética desta Instituição.
RESULTADOS
Dos 72 pacientes com queixa de xerostomia estudados, 26 (36,1%) foram classificados como Síndrome de Sjögren (SS), com base nos critérios apresentados e 46 (63,9%) apresentaram diagnósticos etiológicos diversos e foram classificados como não-Síndrome de Sjögren (NSS). Os pacientes do grupo SS foram divididos em 2 subgrupos: 17 (65,4%) apresentavam Síndrome de Sjögren primária (SSp) e 9 (34,6%), Síndrome de Sjögren secundária (SSsec).
Dos 46 casos do grupo NSS, 7 (15,2%) foram submetidos à radioterapia de cabeça e pescoço; 3 (6,5%) tinham diagnóstico de diabetes; 3 (6,5%) apresentavam sorologia positiva para hepatite C; 12 (26,1%) faziam uso de medicações causadoras de xerostomia; 6 (13,1%) apresentavam quadro de sialadenite crônica; 1 (2,2%) apresentava Granulomatose de Wegener; 4 (8,7%) preenchiam 4 dos 6 critérios, porém não apresentavam exame histopatológico ou auto-anticorpos positivos; e 10 casos (21,7%) não apresentaram causa definida (Figura 10). Dos pacientes sem causa definida, alguns ainda se encontram em investigação e outros abandonaram o seguimento.
Dentre os 9 casos do subgrupo SSsec, 7 (77,8%) foram secundários à artrite reumatóide; 1 (11,1%) secundário a lúpus; e 1 (11,1%) secundário à esclerodermia.
Quanto ao tempo de evolução do quadro, os grupos apresentaram: NSS com mediana de 2,00 anos (mínimo de 0,08 e máximo de 18,00); SSp com mediana de 4,00 anos (mínimo de 0,25 e máximo de 13,00); e SSsec com mediana de 3,00 anos (mínimo de 0,50 e máximo de 7,00), não houve diferença entre os grupos (p = 0,0717). Quando a análise foi feita com o agrupamento dos subgrupos SSp e SSsec, a comparação do grupo SS com mediana de 3,00 anos (mínimo de 0,25 e máximo de 13,00) com o grupo NSS, mostrou diferença entre os dois grupos (p = 0,0369).
Figura 1. Presença de foco inflamatório em meio ao tecido glandular, indicado pelas setas (HE 100X)
Figura 2. Focos inflamatórios confluentes, indicados pelas setas, que substituem em parte o tecido glandular (HE 50X). O retângulo marcado em vermelho corresponde à medida de área
Analisando os resultados da biópsia em relação ao número de focos inflamatórios nos grupos, observaram-se: em relação a 37 casos NSS, mediana de 0,00 (mínimo de 0,00 e máximo de 6,00); em 17 casos SSp, mediana de 5,20 (mínimo de 0,00 e máximo de 12,00); e em 8 casos SSsec, mediana de 0,00 (mínimo de 0,00 e máximo de 5,90). A comparação entre os grupos mostrou diferença em relação ao número de focos (p < 0,0001).
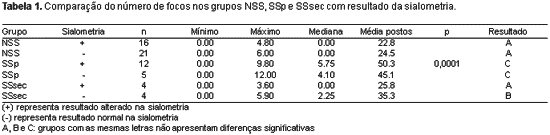
Ainda em relação ao número de focos nas biópsias, os grupos NSS, SSp e SSsec foram comparados levando-se em conta os resultados da sialometria. Quando a sialometria estava alterada, o teste foi considerado positivo (+) e quando normal, o teste foi considerado negativo (-). O teste de Kruskal-Wallis mostrou diferença significante (p = 0,0001) na comparação do número de focos em todos os grupos, simultaneamente. Comparações múltiplas foram realizadas para identificação das diferenças, representadas por letras diferentes (Tabela 1). Grupos com as mesmas letras apresentam resultados sem diferença significativa.
O teste de correlação de Pearson foi utilizado para correlacionar o número de focos na biópsia com o tempo de evolução, porém não se observou resultado significativo (r = 0,17330; p = 0,1780).
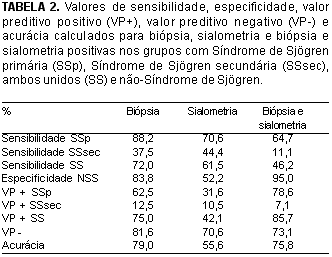
Para a biópsia, para a sialometria e para a associação dos dois critérios: biópsia e sialometria positivas, foram calculados sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acurácia em relação aos grupos NSS, SSp e SSsec.
A fim de se comparar os índices sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acurácia, os subgrupos SSp e SSsec foram unidos e representados por SS (Tabela 2).
Foram comparados os valores preditivos positivos da biópsia e da sialometria, com achado de diferença significativa entre eles (p = 0,0036), sendo o da biópsia maior que o da sialometria. Não se encontrou diferença entre os valores preditivos negativos (p = 0,0997) e as sensibilidades (p = 0,5237) da biópsia e da sialometria. Comparando-se as especificidades, observou-se que a especificidade da biópsia foi maior que a da sialometria (p = 0,0106).
Ao se compararem os valores preditivos positivos da biópsia e da biópsia associada à sialometria, evidenciou-se que não são significativamente diferentes (p = 0,1553). No entanto, os valores preditivos negativos das duas (p = 0,0129), bem como as sensibilidades (p = 0,0051) são diferentes e são maiores para a biópsia. Já as especificidades da biópsia e da biópsia associada à sialometria apresentaram diferença significante (p = 0,0350), maior na biópsia associada à sialometria.
Na comparação dos valores preditivos positivos da sialometria e da biópsia associada à sialometria, observou-se diferença entre eles (p < 0,0001), sendo maior o da biópsia associada à sialometria. Contudo, os valores preditivos negativos da sialometria e da biópsia associada à sialometria mostraram-se sem diferença significativa (p = 0,5662). A sensibilidade da sialometria foi maior (p = 0,0304) que a da biópsia associada à sialometria, e a especificidade da biópsia associada à sialometria foi maior que a da sialometria (p < 0,0001).
DISCUSSÃO
A tentativa de se estabelecerem critérios com o objetivo de fazer o diagnóstico de pacientes com Síndrome de Sjögren tem ocupado as páginas de publicações científicas há várias décadas. Concorda-se com a afirmação que o julgamento clínico de um médico experiente possa ser o único padrão-ouro disponível12. Pelo fato de não existir um exame padrão-ouro para o diagnóstico, o que se tenta fazer é conseguir um conjunto de critérios com tal intuito.
As classificações inicialmente incluíam uma série de critérios e de acordo com o número destes critérios preenchidos se afirmava que o paciente apresentava Síndrome de Sjögren "definida" ou Síndrome de Sjögren "possível"10,13, o que gerava certa insegurança para os pacientes e dificuldade para os pesquisadores de incluir ou não estes casos em estudos científicos.
Outra dificuldade encontrada para o estabelecimento dos critérios de classificação é o pequeno número de pacientes com Síndrome de Sjögren, o que foi resolvido com a realização de estudos multicêntricos, com participação de vários países, conseguindo-se assim realizar exames e aplicar questionários em grupos de pacientes e controles com mais de 200 casos1,7.
Pelo fato de ser responsabilidade do otorrinolaringologista conhecer e identificar as doenças que acometem as glândulas salivares e que podem interferir na produção de saliva, procurou-se identificar dentre os pacientes que chegavam ao Ambulatório de Estomatologia do Departamento de Otorrinolaringologia, aqueles que apresentavam Síndrome de Sjögren. Para isto, foram adotados os critérios descritos pelo Grupo de Estudos da Comunidade Européia e Consenso Americano-Europeu1,7,8,11, com realização dos métodos descritos. Para avaliação do comprometimento ocular, o teste de Schirmer foi mais aplicado que o teste de Rosa-Bengala pela facilidade de realização e familiaridade com a técnica do teste pelo otorrinolaringologista, que o utiliza para avaliação dos pacientes com paralisia facial. Na investigação do envolvimento de glândula salivar, a cintilografia e a sialometria foram mais realizadas que a sialografia de parótida, também pela facilidade de execução, mas principalmente por serem exames menos invasivos.
Ainda a respeito da sialometria, a técnica utilizada foi a de coleta de saliva com algodão previamente pesado9, preferida pela sua praticidade diante das demais técnicas que envolvem atitudes voluntárias dos pacientes, como cuspir ou coletar a saliva na boca.
Em relação à sensibilidade e à especificidade dos testes descritas na literatura, a biópsia apresentou sensibilidade de 82,4% e especificidade de 86,2%, e a sialometria não-estimulada apresentou sensibilidade de 56,1% e especificidade de 80,7%7. Nos presentes resultados, observaram-se a biópsia com sensibilidade menor, 72%, e especificidade semelhante, 83,8%, e sialometria com maior sensibilidade, 61,5%, e menor especificidade, 52,2%. Provavelmente estas diferenças sejam devidas ao tamanho da amostra, porém, a biópsia manteve a especificidade mesmo com menor amostra. Também foi relatado que a biópsia foi o teste com maior acurácia, 89%8 e nos presentes resultados apresentou uma acurácia discretamente menor, 79%.
Observou-se que a associação dos dois critérios positivos, a sialometria e a biópsia, apresenta uma especificidade bastante alta, de 95%, maior, inclusive, que a da biópsia isoladamente. Tal fato tem grande importância pensando-se na importância dos critérios para a classificação dos pacientes em pesquisas, em que uma especificidade alta vai aumentar o rigor na inclusão de casos.
A classificação dos pacientes, neste estudo, baseou-se na modificação introduzida no Consenso Americano-Europeu, isto é, obrigatoriedade da biópsia ou da presença de auto-anticorpos, dentre os quatro critérios para pacientes com Síndrome de Sjögren primária, a fim de ir ao encontro da classificação internacional. Assim, para classificar os pacientes no grupo SSp considerou-se obrigatória a presença da biópsia ou dos auto-anticorpos positivos11. Este tema ainda é alvo de controvérsias na literatura internacional14. Como resultado, 4 pacientes neste estudo, que teriam diagnóstico de Síndrome de Sjögren, foram reclassificados como NSS (19%), pois apresentavam 4 critérios positivos, porém não apresentavam biópsia ou auto-anticorpos positivos. Na literatura, este índice de reclassificação foi maior15.
Apesar de não fazer parte dos critérios de exclusão de Síndrome de Sjögren11, optou-se por excluir um caso que preenchia os critérios para Síndrome de Sjögren primária, pois a paciente apresentava Granulomatose de Wegener. Como já descrito16, a Granulomatose de Wegener pode cursar com comprometimento de glândulas salivares, com aumento de volume, possibilidade de comprometimento funcional e exame histopatológico que pode ser compatível com Síndrome de Sjögren.
Existe uma multiplicidade de técnicas de sialometria e, com isto, várias nomenclaturas, como medida do fluxo salivar em repouso, ou fluxo basal ou fluxo não-estimulado. Existem também várias técnicas de estimulação e, além disso, variações em relação ao tempo de coleta e parâmetros de normalidade. No presente estudo, foram considerados apenas os valores da sialometria não-estimulada como definido nos critérios de classificação. A sialometria estimulada tem seu papel na avaliação da reserva glandular e, com isso, na indicação da melhor escolha em relação ao tratamento da hiposalivação. Se houver reserva, deve ser feita tentativa de estimulação da glândula, se não houver, deve ser preferido o uso de substitutos da saliva.
Em relação ao fluxo salivar não-estimulado, podem ser usadas as técnicas de drenagem, cuspir, sucção e swab, com uso de algodões17. A adoção da técnica do swab9 mostrou grande praticidade na realização, baixo custo, facilidade de medida e autonomia dos atos do paciente, como, por exemplo, cuspir. Isto nos parece importante quando se avaliam pacientes idosos ou com algum grau de comprometimento motor.
A queixa de boca seca, ou xerostomia, nem sempre se correlaciona com sinais objetivos de hiposalivação18-22. Considera-se, nesta pesquisa, difícil estabelecer uma correlação entre a queixa de boca seca e a sialometria alterada, pois muitas vezes, indivíduos com queixa de xerostomia apresentam sialometria dentro do valor de normalidade. Isto talvez ocorra por uma redução no fluxo de saliva que é significativa para o paciente, porém com valores ainda dentro da normalidade, ou ainda por redução na produção de mucina, uma alteração na composição qualitativa da saliva. Em contrapartida, indivíduos com sialometria com fluxos bastante baixos, muitas vezes, não apresentam queixas.
Quanto à idéia que o idoso apresentaria uma prevalência maior de boca seca, na realidade, o idoso não apresenta mais boca seca pelo envelhecimento em si, mas pela maior prevalência das doenças associadas e do uso de medicações23-25. No presente estudo, 6,5% dos pacientes NSS apresentavam diabetes como causa dos sintomas e 26,1% usavam medicações causadoras de xerostomia.
Em relação ao critério de normalidade, o valor de 0,1 ml/min corresponde ao adotado pelos critérios de classificação de Síndrome de Sjögren e foi também adotado por este estudo19,21. Porém, este valor também foi bastante discutido em outras publicações22,25,26.
Neste estudo, a sialometria não-estimulada apresentou uma sensibilidade para SSp de 70,6% e para SSsec de 44,4%. A especificidade foi de 52,2%. Observou-se um desempenho do teste bem diferente entre SSp e SSsec. Quando os grupos SSp e SSsec foram unidos em SS, a sensibilidade foi de 61,5%, um pouco maior que a relatada na literatura, e a especificidade manteve-se em 52,2%, menor que a descrita na literatura, de 80,7%7. Tais diferenças talvez possam ser explicadas pelo tamanho da amostra. Em relação aos valores preditivos, o valor preditivo positivo foi de 42,1% e o negativo foi de 70,6%, ou seja, é grande a probabilidade de o indivíduo não ter Síndrome de Sjögren, quando a sialometria for negativa. A acurácia foi de 55,6%.
A biópsia de glândula salivar menor mantém-se como a grande alternativa para avaliar o comprometimento de glândula salivar na Síndrome de Sjögren. Sua morbidade é baixíssima, em relação à biópsia de glândulas salivares maiores, principalmente com a modificação técnica de se retirar isoladamente as glândulas através de uma incisão27, diferente do que era feito anteriormente, com retirada de um fuso de mucosa28.
Apesar de ser considerado o teste de maior acurácia dentre os critérios de classificação, a biópsia de glândula salivar menor também é cercada por controvérsias, principalmente em relação ao número de focos presentes que serão sugestivos de Síndrome de Sjögren. Alguns autores afirmaram que 1 foco inflamatório em 4 mm2de tecido glandular seria sugestivo de Síndrome de Sjögren1,28, enquanto que outros afirmaram que seriam necessários mais de 1 foco em 4 mm2para o diagnóstico do componente salivar na Síndrome de Sjögren29-31. Outros, ainda, questionaram o valor da biópsia, afirmando que quadros semelhantes podem estar presentes em outras doenças32.
Com os trabalhos publicados pelo Grupo de Estudos da Comunidade Européia principalmente os de 1993 e 19941,7, em que a biópsia de glândula salivar menor foi validada e testadas suas sensibilidade e especificidade, considerando como limite a presença de 1 foco e também de mais de 1 foco, os autores demonstraram que o ganho em especificidade foi pequeno em comparação com a perda de sensibilidade, quando se considerou mais de 1 foco. Assim, deve haver uma tendência em se adotar este limite para uniformizar os estudos científicos. No presente estudo considerou-se a positividade do exame histopatológico com a presença de 1 ou mais focos em 4 mm2 de tecido glandular.
Durante a revisão das lâminas dos pacientes NSS e SS, observaram-se diferentes tipos de infiltrado inflamatório e procurou-se graduá-los em leve, intermediário e severo30 e, também, fez-se a contagem de focos inflamatórios, que é fundamental para se definir se a biópsia é ou não sugestiva de Síndrome de Sjögren.
Observou-se diferença significativa entre as medianas do número de focos nos grupos NSS (0,00), SSp (5,20) e SSsec (0,00), ou seja, realmente a sialadenite focal com maior número de focos foi uma característica da Síndrome de Sjögren primária, confirmando também a afirmação de que os pacientes com Síndrome de Sjögren secundária apresentariam menos focos nas biópsias7.
O fato de a biópsia ser considerada um critério obrigatório para a classificação de pacientes com Síndrome de Sjögren primária e não obrigatório para a classificação de pacientes com Síndrome de Sjögren secundária, talvez, deva-se a este mesmo fato, que indiretamente reflete a diferença existente nos dois quadros, isto é, são quadros com comportamento laboratorial e histopatológico diferentes.
A comparação do número de focos nos grupos NSS, SSp e SSsec, subdivididos de acordo com o seu resultado da sialometria, alterada ou normal, demonstrada na Tabela 1, mostrou que não há diferença nos resultados obtidos nos grupos NSS com sialometria alterada e com sialometria normal, e SSp com sialometria alterada e com sialometria normal. O grupo SSp continuou apresentando número de focos significativamente maior, independentemente do resultado da sialometria. Houve diferença no grupo SSsec, em que aqueles que apresentavam sialometria alterada tiveram resultado igual ao grupo NSS. Dessa maneira, pôde-se observar que as alterações do fluxo salivar representadas pela sialometria alterada não tiveram relação com o número de focos apresentado na biópsia.
Ainda em relação ao número de focos, não se observou correlação entre um maior número de focos e maior tempo de evolução, o que faz pensar que a intensidade do quadro e o grau de comprometimento das glândulas salivares são independentes do tempo de evolução do quadro, isto é, um indivíduo que apresenta Síndrome de Sjögren há pouco tempo pode ter um comprometimento maior que um indivíduo com Síndrome de Sjögren há muitos anos, que se encontra controlado e sem surtos.
Em relação ao papel da biópsia de glândula salivar menor como critério de diagnóstico, observou-se que ela apresentou uma sensibilidade para SSp de 88,2%, bastante diferente da sensibilidade para SSsec, que foi de 37,5%, o que novamente reflete um perfil bastante diverso do teste em cada um dos quadros. A especificidade foi de 83,8%. Quando os grupos SSp e SSsec foram unidos em SS, constatou-se que a sensibilidade do teste foi de 72,0%, um pouco menor que a descrita7, de 82,4%, e a especificidade manteve-se em 83,8%, muito semelhante à descrita no mesmo trabalho, de 86,2%. Isto mostra que a especificidade do teste foi mantida. Seu VP positivo foi de 75%, seu VP negativo foi de 81,6%, mostrando que o indivíduo tem 75% de chance de ter Síndrome de Sjögren, quando a biópsia for positiva e 81,6% de chance de não ter Síndrome de Sjögren, quando a biópsia for negativa. A acurácia foi de 79,0%.
Quando os testes foram analisados em conjunto, isto é, biópsia mais sialometria positivas, a sensibilidade caiu para 46,2%, no entanto, a especificidade subiu para 95,0%. O VP positivo foi de 85,7% e o VP negativo foi de 73,1%. A acurácia foi de 75,8%. Observou-se um aumento expressivo na especificidade com esta associação.
Compararam-se a biópsia e a sialometria e pôde-se observar que a especificidade e o VP positivo da biópsia foram maiores e que não houve diferença entre as sensibilidades e os VP negativos. Assim, se for necessário o uso de um destes testes para triagem, tanto biópsia quanto sialometria isoladamente podem ser usados, pelo fato de não apresentarem diferença nas suas sensibilidades.
Quando a comparação foi feita entre a biópsia e a biópsia associada à sialometria, observou-se que a biópsia teve maior sensibilidade e maior VP negativo. Os VP positivos não apresentaram diferença. A especificidade da biópsia associada à sialometria foi maior.
Na comparação entre sialometria e biópsia associada à sialometria, pôde-se observar que a biópsia associada à sialometria apresentou maior VP positivo e maior especificidade. A sensibilidade da sialometria foi maior. Não houve diferença significativa entre seus VP negativos. Novamente a especificidade do conjunto biópsia mais sialometria foi maior que o teste isolado.
Assim, nota-se que a positividade do conjunto biópsia mais sialometria aumenta muito a especificidade para Síndrome de Sjögren, diferentemente de quando são consideradas em separado. Considera-se que, a perda da sensibilidade pode ser compensada com uso de outros critérios que não são objeto de estudo neste trabalho.
Pelo fato de não haver diferença entre os VP positivos da biópsia e da biópsia associada à sialometria, e o VP positivo da biópsia associada à sialometria ser maior que o VP positivo da sialometria, pode-se afirmar que é de 85,7% a chance de um indivíduo ter Síndrome de Sjögren quando estes dois exames forem positivos, uma probabilidade bastante considerável.
Desta maneira, quando houver uma limitação em relação aos exames a serem realizados para classificar um paciente, o conjunto biópsia e sialometria, ambos positivos, mostra-se com grandes chances de classificação correta.
CONCLUSÕES
Com base nas observações deste estudo, pudemos concluir que:
Os testes sialometria e biópsia apresentaram desempenhos diferentes nos pacientes com Síndrome de Sjögren primária e secundária. As sensibilidades e os valores preditivos positivos foram maiores para Síndrome de Sjögren primária, tanto isoladamente como dos dois critérios em conjunto. O número de focos na biópsia também foi maior na Síndrome de Sjögren primária.
A sialometria realizada com a técnica do swab apresentou sensibilidade de 61,5% e valor preditivo negativo de 70,6%.
A biópsia apresentou especificidade de 83,8% e valor preditivo positivo de 75%.
A positividade dos dois critérios em conjunto aumenta muito a especificidade para Síndrome de Sjögren (95%), do que quando são considerados isoladamente, o que é importante para classificação em pesquisas. O valor preditivo positivo dos dois critérios em conjunto é de 85,7%.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Vitali C, Bombardieri S, Moutsopoulos HM, Balestrieri G, Bencivelli W, Bernstein RM et al. Preliminary criteria for Sjögren's Syndrome. Results of a prospective concerted action supported by the European Community. Arthritis Rheum 1993; 36: 340-7.
2. Bartunková J, Sedivá A, Vencovsky J, Tesar V. Primary Sjögren's syndrome in children and adolescents proposal for diagnostic criteria. Clin Exp Rheumatol 1999; 17: 381-6.
3. Bell M, Askari A, Bookman A, Frydrych S, Lamont J, Mccomb J et al. Sjögren's syndrome: a critical review of clinical management. J Rheumatol 1999; 26: 2051-61.
4. Tapinos NI, Polihronis M, Tzioufas Ag, Moutsopoulos HM. Sjögren's Syndrome. Autoimmune epithelitis. Adv Exp Med Biol 1999; 455: 127-34.
5. Skopouli FN, Dafni U, Ioannidis JPA, Moutsopoulos HM. Clinical evolution, and morbidity and mortality of primary Sjögren's syndrome. Semin Arthritis Rheum 2000; 29: 296-304.
6. Scully C. The role of saliva in oral health problems. Practioner 2001; 245: 841-8.
7. Vitali C, Moutsopoulos HM, Bombardieri S. The European Community Study Group on Diagnostic Criteria for Sjögren's Syndrome. Sensitivity and specificity of tests for ocular and oral involvement in Sjögren's Syndrome. Ann Rheum Dis 1994; 53: 637-47.
8. Vitali C, Bombardieri S, Moutsopoulos HM, Coll J, Gerli R, Hatron PY. The European Community Study Group On Diagnostic Criteria For Sjögren's Syndrome. Assessment of the European classification criteria for Sjögren's syndrome in a series of clinically defined cases: results of a prospective multicentre study. Ann Rheum Dis 1996; 55: 116-21.
9. Pupo DB, Bussoloti Filho I, Liquidato BM, Korn GP. Proposta de um método prático de sialometria. Rev Bras Otorrinolaringol 2002; 68: 219-22.
10. Manthorpe R. New criteria for diagnosing Sjögren´s syndrome: a step forward? - or... Scand J Rheumatol 2001; 115 (Suppl): 14-22.
11. Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander El, Carsons SE. The european study group on classification criteria for Sjögren's syndrome. Classification criteria for Sjögren's syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis 2002; 61: 554-8.
12. Vitali C, Bombardieri S. The diagnosis of Sjögren's syndrome: definition and validation of classification criteria for this disorder. Ann Med Interne 1998; 149: 12-6.
13. Fox RI, Robinson CA, Curd JG, Kozin F, Howell FV. Sjögren's Syndrome: Proposed criteria for classification. Arthritis Rheum 1986; 29: 577-85.
14. Manthorpe R. Sjögren's syndrome criteria. American-European and Japanese Groups' criteria compared and contrasted. Ann Rheum Dis 2002; 61: 482-4.
15. Brun JG, Madland TM, Gjesdal CB, Bertelsen LT. Sjögren's syndrome in an out-patient clinic: classification of patients according to the preliminary European criteria and the proposed modified European criteria. Rheumatology 2002; 41: 301-4.
16. Böttinger EP, Niles JL, Collins AB, Mccluskey RT, Arnaout MA. Antineutrophil cytoplasmic autoantibody-associated vasculitis presenting as Sjögren's syndrome. Arthritis Rheum 1992; 35: 1373-6.
17. Navazesh M, Chistensen CM. A comparison of whole mouth resting and stimulated salivary measurement procedures. J Dent Res 1982; 61: 1158-62.
18. Fox PC, Busch KA, Baum BJ. Subjective reports of xerostomia and objective measures of salivary gland performance. J Am Dent Assoc 1987; 115: 581-4.
19. Sreebny LM, Valdini A. Xerostomia. Part I: Relationship to the other oral symptoms and salivary gland hypofunction. Oral Surg Oral Med Oral Pathol 1988; 66: 451-8.
20. Wang SL, Zhao ZT, Li J, Zhu XZ, Dong H, Zhang YG. Investigation of the clinical value of total saliva flow rates. Arch Oral Biol 1998; 43: 39-43.
21. Hay EM, Thomas E, Pal B, Hajeer A, Chambers H, Silman AJ. Weak association between subjective symptoms of and objective testing for dry eyes and dry mouth: results from a population based study. Ann Rheum Dis 1998; 57: 20-4.
22. Longman LP, Mccracken CFM, Higham SM, Field EA. The clinical assessment of oral dryness is a significant predictor of salivary gland hipofunction. Oral dis 2000; 6: 366-70.
23. Sreebny LM, Valdini A, Yu A. Xerostomia. Part II: Relationship to nonoral Symptoms, drugs, and diseases. Oral Surg Oral Med Oral Pathol 1989; 68: 419-27.
24. Baum BJ. Salivary gland fluid secretion during aging. J Am Geriatr Soc 1989; 37: 453-8.
25. Ship JA, Fox PC, Baum BJ. How much saliva is enough? "Normal" function defined. J Am Dent Assoc 1991; 122: 63-9.
26. Crockett DN. Xerostomia: the missing diagnosis? Aust Dent J 1993; 38: 114-8.
27. Greenspan JS, Path MRC, Daniels TE, Talal N, Sylvester MD. The histopathology of Sjögren's syndrome in labial salivary gland biopsies. Oral Surg 1974; 37: 217-29.
28. Chisholm DM, Mason K. Labial salivary gland biopsy in Sjögren disease. J Clin Pathol 1968; 21: 656-60.
29. Daniels TE. Labial salivary gland biopsy in Sjögren's syndrome. Assessment as a diagnostic criterion in 362 suspected cases. Arthritis Rheum 1984; 27: 147-56.
30. Daniels TE, Whitcher JP. Association of patterns of labial salivary gland inflammation with keratoconjunctivitis sicca. Arthritis Rheum 1994; 37: 869-77.
31. Manthorpe R, Benoni C, Jacobsson L, Kirvata Z, Larsson A, Liedholm R, et al. Lower frequency of focal lip sialadenitis (focus score) in smoking patients. Can tobacco diminish the salivary gland involvement as judged by histological examination and anti-SSA/Ro and anti-SSB/La antibodies in Sjögen's syndrome? Ann Rheum Dis 2000 59: 54-60.
32. Lindahl G, Hedfors E. Lymphocytic infiltrates and epithelial HLA-DR expression in lip salivary glands in connective disease patients lacking sicca: a prospective study. Br J Rheumatol 1989; 28: 293-8.
1 - Doutora em Otorrinolaringologia pela F.C.M. Santa Casa de São Paulo (Prof. Instrutora do Depto. de Morfologia da F.C.M. Santa Casa de São Paulo )
2 - Doutor em Otorrinolaringologia pela UNIFESP