Diabetes Mellitus como causa de perda auditiva
Diabetes Mellitus as etiological factor of hearing loss
Autor(es): Clícia Adriana S. Maia1, Carlos Alberto H. de Campos2
Palavras-chave: perda auditiva, angiopatia diabética, diabetes mellitus, retinopatia, neuropatia.
Keywords: hearing loss, diabetic angiopathy, diabetes mellitus, retinopathy, neuropathy.
Resumo:
Os pacientes com diabetes mellitus freqüentemente apresentam sintomas como tontura, zumbidos e hipoacusia. Via de regra, a perda auditiva é do tipo sensorioneural, confundindo-se, por vezes, com presbiacusia, principalmente por ocorrer em pacientes acima dos 40 anos de idade. A angiopatia e a neuropatia causadas pelo diabetes mellitus têm sido considerados importantes fatores responsáveis pelas manifestações vestibulococleares nesses pacientes. Porém, existe controvérsia no que se refere à etiopatogênese da perda auditiva, sendo que parte dos autores advoga que ela ocorre devido à neuropatia, outra parte à angiopatia, e outra, ainda, à associação das duas. Porém há também os que entendem que o diabetes mellitus e a perda auditiva poderiam ser partes integrantes de uma síndrome genética e não dependentes entre si. Realizamos uma extensa revisão bibliográfica procurando analisar se há relação "causa e efeito" entre o diabetes mellitus e a perda auditiva. Pudemos observar que, apesar do grande número de estudos realizados, a controvérsia ainda é grande, sendo que novas perspectivas, como no campo da genética, estão sendo estudadas, mostrando que novos rumos podem ser tomados para se chegar à conclusão do tema.
Abstract:
Patients with diabetes mellitus often show symptoms such as dizziness, tinnitus, and hearing impairment. In general, hearing loss is sensorineural, which is sometimes confused with presbycusis, mainly because it develops in patients older than 40 years of age. Angiopathy and neuropathy caused by diabetes mellitus have been considered important factors for the vestibulo-cochlear disorders found in these patients. However, there is controversy regarding the etiopathogenesis of hearing loss, as some researchers support that it develops due to neuropathy, others say it is due to angiopathy, or even a combination of both. Yet, some researchers believe diabetes mellitus and hearing loss are part of a genetic syndrome. We have conducted an extensive bibliographic review to determine whether there is a cause-effect relationship between diabetes mellitus and hearing loss. We were able to verify that, despite the large number of studies performed, there is still a great deal of controversy, and new approaches are being studied, for example in the field of genetics, which shows that new paths can be followed to reach a conclusion on this issue.
![]()
INTRODUÇÃO
As causas mais freqüentes de alterações nos sistemas vestibular e auditivo são as atribuídas às disfunções no metabolismo dos carboidratos, afecções da tireóide, da supra-renal e outros distúrbios metabólicos diversos. Dentro dos distúrbios do metabolismo da glicose, o diabetes mellitus é a afecção mais comumente relacionada a distúrbios auditivos1.
Diabetes mellitus é um distúrbio metabólico determinado geneticamente, associado com deficiência absoluta ou relativa de insulina e que na sua manifestação clínica completa é caracterizado por alterações metabólicas, complicações vasculares e neuropáticas. O principal objetivo do tratamento do paciente diabético é a prevenção das complicações crônicas, pois a doença não é curável e sim controlável. No Brasil é bastante elevada a incidência de complicações crônicas do diabetes. Estima-se que existam cinco milhões de indivíduos portadores de diabetes, sendo que metade desconhece o diagnóstico. Em grande número de indivíduos, principalmente em crianças e adolescentes, o diagnóstico do diabetes é realizado em vigência de complicações, principalmente infecções2.
Um dos aspectos morfológicos mais constantes do diabetes mellitus é o espessamento difuso das membranas basais, o que ocorre também no endotélio vascular, e recebe o nome de microangiopatia diabética. Ela é mais evidente nos capilares da pele, dos músculos esqueléticos, da retina, dos glomérulos renais e da medula renal. Sua patogênese ainda é obscura, porém, está claramente associada à hiperglicemia. Outras alterações morfológicas referem-se ao comprometimento tanto de nervos motores quanto dos nervos sensoriais das extremidades inferiores, caracterizando-se por lesão das células de Schwann, degeneração da mielina e dano axônico. A causa dessa neuropatia ainda é bastante controversa, podendo estar relacionada à microangiopatia difusa que afetaria a nutrição dos nervos periféricos3.
Neuropatia e angiopatia são afecções comuns no diabetes mellitus. A angiopatia tem sido observada nas pequenas artérias e capilares da pele, músculo, rim, retina e nervos periféricos. Fatores que podem ser causa da neuropatia são as desordens metabólicas (metabolismo da glicose, defeitos no metabolismo dos lipídeos e vitaminas) Alguns pesquisadores citam que alterações vasculares nos ramos interfasciculares ou intrafasciculares do vasanervorum contribuem para a neuropatia. A arteriosclerose, contudo, muito comum no diabetes, pode também contribuir para a neuropatia, devido à interferência na taxa de transferência de nutrientes4.
A angiopatia pode ocorrer tanto de maneira direta, interferindo com o suprimento para a cóclea pela redução do transporte através das paredes espessadas dos capilares, como indiretamente, pela redução no fluxo de uma estreita vasculatura ou, ainda, por causar degeneração secundária do oitavo nervo craniano5.
Em se tratando de diabetes mellitus, há discordância de opiniões quanto às alterações patológicas provocadas no sistema auditivo.
Segundo Nageris et al., a associação entre perda auditiva e diabetes mellitus tem sido debatida desde que foi citada pela primeira vez por Jordão, em 18576.
Na literatura, há citações de vários tipos de perdas auditivas encontradas em diabéticos. Uma delas é a de instalação gradual e progressiva, bilateral, sensorioneural, afetando principalmente as freqüências altas e em pacientes idosos. Seria similar à presbiacusia, porém com perdas maiores que as esperadas pela idade5-8. Em contrapartida, há autores que citam a possibilidade de ser uma perda auditiva sensorioneural precoce7 e outros relataram ainda perda auditiva em baixas e médias freqüências9,10. Alguns estudos descrevem o diabetes como possível causa de perda súbita unilateral4,10,11,, porém outros autores não encontraram essa associação12.
Quanto à incidência da perda auditiva em pacientes com diabetes mellitus, observou-se que também não há consenso na literatura, variando de zero a 93%6.
Diante do exposto, realizamos uma revisão bibliográfica com a finalidade de verificar se realmente há uma perda auditiva inerente ao diabetes mellitus e a que fator ou fatores ela está relacionada.
Revisão da literatura
A) Angiopatia diabética: aspectos estruturais e ultra-estruturais
A angiopatia diabética tem sido caracterizada por proliferação endotelial, acúmulo de glicoproteínas na íntima e espessamento da membrana basal de capilares e pequenos vasos sangüíneos. Também foi observado espessamento fibrótico da parede e estreitamento do lume da artéria auditiva interna. Constatou-se, ainda, acúmulo de substância PAS positiva (ácido periódico de Schiff) na parede dessa artéria, assim como nos vasos do modíolo e capilares da estria vascular4.
A1) Estudos experimentais em animais de laboratório
Os efeitos do diabetes na orelha interna podem ser estudados em modelos experimentais pelo emprego de drogas diabetogênicas (alloxan ou estreptozocina), em animais com diabetes (ex. ratos da linhagem Sabra) geneticamente modificados, pelo artifício da pancreatectomia total ou subtotal e ainda, através da extração da hipófise anterior.
Costa13 (1967) utilizou o alloxan para induzir o diabetes em ratos, com a finalidade de avaliar a angiopatia diabética. Encontrou na microscopia óptica aumento na espessura da parede dos vasos do modíolo, mais pronunciado após seis meses de diabetes induzido. Não observou mudança estrutural no órgão de Corti, nas células ganglionares ou nas fibras nervosas.
Smith et al.14 (1995) comprovaram que a microangiopatia diabética ocorre na orelha interna dos ratos induzidos com uso de injeção de estreptozocina. No grupo de estudo houve documentação quantitativa, por microscopia eletrônica de transmissão, do aumento na espessura da membrana basal dos capilares da estria vascular, o que não foi observado no grupo controle.
Raynor et al.15 (1995) utilizando-se também da estreptozocina para indução do diabetes mellitus, observaram que a perda de célula ciliadas externas foi maior nos ratos diabéticos que eram simultaneamente expostos a ruído.
A utilização do alloxan ou da estreptozocina intraperitoneal para induzir o diabetes em modelos experimentais tem sido contestada, pois não refletiria o real mecanismo fisiológico do diabetes no ser humano, por ser este de origem genética. Assim, Nageris et al.6 (1998) utilizaram ratos da linhagem Sabra, que têm tendência a apresentar uma intolerância à glicose quando submetidos por 21 dias a uma dieta rica em carboidratos. Concluíram que se há uma perda sensorioneural associada a diabetes mellitus, sua patogênese não envolve danos nas células ciliadas ou estria vascular.
Triana et al.16 (1991), utilizando a linhagem de ratos (SHR/N-cp - Spontaneus hypertensive rats/ corpulent), que afirmaram ser o único modelo genético para o diabetes mellitus não-insulino-dependente, observaram uma perda significativa de células ciliadas externas nos animais que eram simultaneamente obesos e diabéticos, quando comparados com o grupo controle. Entretanto, um experimento semelhante foi realizado por outros autores utilizando o mesmo modelo animal e concluíram que o diabetes sozinho não causou um espessamento significativo da membrana basal, mas em combinação com obesidade e exposição a ruído apresentou um espessamento, este sim considerado significante17.
A2) Estudos anatomopatológicos em humanos
Willianson & Killo18 (1977), em um trabalho de revisão, citaram que a membrana basal do capilar é composta de proteínas do colágeno, que são comuns no tecido conectivo, e também nos tecidos cicatriciais, visto que a síntese destas substâncias aumenta em resposta a uma variedade de estímulos e injúrias. Afirmaram que o espessamento da membrana basal do capilar associada com diabetes é considerado uma resposta proliferativa das células capilares à injúria. Eles relataram que esse espessamento é atribuído a repetidos episódios de morte de células endoteliais e regeneração (com retenção de células endoteliais necróticas na membrana basal e surgimento de novas camadas nessa mesma membrana, pela regeneração). Concluíram que uma grande variedade de estudos in vivo e in vitro é também consistente com essa hipótese, sugerindo que a síntese da membrana basal e a renovação tecidual estão aumentadas no diabetes e que a degradação da membrana basal está reduzida ou prejudicada.
Jorgensen & Buch9 (1961), em um estudo dos ossos temporais de 32 indivíduos diabéticos, de várias faixas etárias, mostraram ser de maior interesse as alterações demonstradas nas preparações dos vasos sangüíneos da estria vascular quando coradas pelo PAS (ácido periódico reativo de Schiff - método de coloração que define bem membrana basal, matriz mesangial e hialinose). Nesse estudo, foi encontrado depósito maciço de PAS nas paredes dos capilares da estria vascular, que eram 10 a 20 vezes mais espessas que o usual e possuíam estrutura homogênea ou lamelar. As alterações eram semelhantes àquelas que podem ser vistas na aterosclerose, porém mais pronunciadas, ocorrendo somente na estria vascular. Esses autores observaram degeneração em outras partes do labirinto, todavia correspondentes aos achados nos ossos temporais de pessoas não-diabéticas, da mesma faixa etária. O estudo confirmou que a angiopatia não é generalizada, tendo a predileção por certos sistemas capilares da orelha interna, por exemplo, na estria vascular. Contudo, a partir dessa investigação, os autores afirmaram não poderem tirar conclusões sobre a natureza química do precipitado, pois várias substâncias são coradas por esse método. Relataram que as alterações são típicas do diabetes, mas não específicas da doença, observando que a aterosclerose se reduz perifericamente, enquanto a angiopatia diabética aumenta de intensidade na região dos pequenos vasos.
Costa13 (1967), em um estudo realizado em ossos temporais de seis indivíduos diabéticos que foram usados no seu estudo comparativo citado anteriormente, também detectou material PAS positivo na parede dos capilares da estria vascular e modíolo, além de espessamento da membrana basal em ambos os sítios.
Makishima e Tanaka4 (1971) utilizando ossos temporais de quatro indivíduos, encontraram também impregnação pelo ácido periódico de Schiff na espessura da parede dos capilares da estria vascular e do modíolo, o que foi considerado responsável por um estreitamento do lume desses vasos, sendo mais intensamente afetada a artéria auditiva interna.
Após esses dados iniciais da pesquisa sobre diabetes mellitus e audição, a maioria dos pesquisadores concordou que a lesão primária é angiopática4,10,14.
B) Neuropatia diabética: aspectos estruturais e audiológicos
B1) Estudo anatomopatológico em humanos
Makishima & Tanaka4 (1971) descreveram a atrofia dos neurônios do gânglio espiral e desmielinização do oitavo nervo em quatro indivíduos diabéticos. Mostraram que desmielinização é também a lesão inicial nos nervos periféricos das extremidades no diabetes e que há indícios que anormalidades no metabolismo da mielina podem ter importância na patogênese da neuropatia diabética. Através de microscopia óptica, foram observadas: desmielinização do nervo auditivo, por degeneração da bainha de mielina, com pequenas alterações no axônio e fibrose do perineuro; severa atrofia do gânglio espiral com perda de células do giro basal e do giro médio da cóclea, além de um decréscimo no número de fibras nervosas na lâmina espiral. Outros achados foram: redução no número das células ganglionares dos núcleos cocleares ventral e dorsal, pequena perda de células ganglionares no núcleo olivar superior, colículo inferior e corpo geniculado medial. Nos centros auditivos de ambos os lobos temporais não foi observada nenhuma alteração específica diretamente atribuída ao diabetes mellitus.
B2) Estudo audiológico em humanos
Há outros autores que acreditam ser a neuropatia a lesão primária da perda auditiva, argumentando que o material PAS positivo encontrado na parede dos vasos é muito inespecífico, sendo encontrado também em outras doenças. Eles realizaram um estudo audiométrico em 20 pacientes com neuropatia periférica diabética, usando como controle 32 pacientes sem diabetes mellitus. Observaram que o limiar dos indivíduos com neuropatia periférica era sempre pior que o do grupo controle, em todas as freqüências. E também que o limiar dos pacientes com mais de 60 anos era pior em ambos os grupos. A perda auditiva encontrada por eles foi tipicamente sensorioneural, progressiva, mais intensa acima dos 60 anos7.
C) Correlação entre angiopatia e/ou neuropatia diabética e perda auditiva
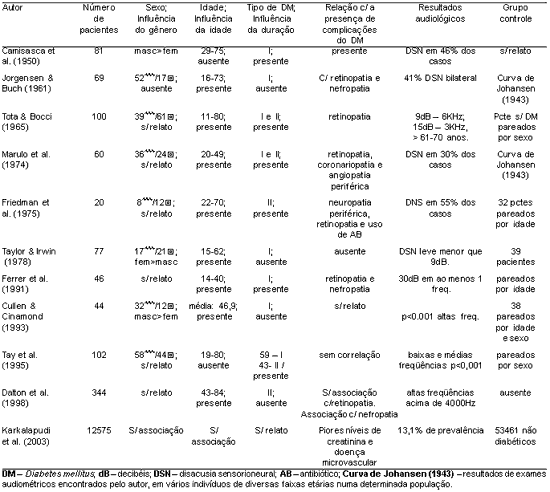
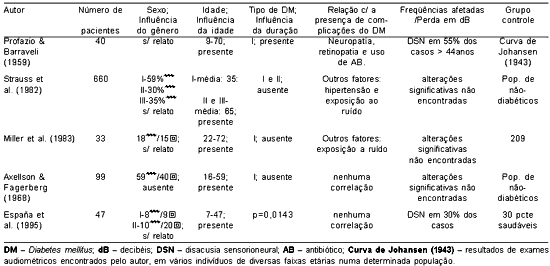
A Tabela 1 apresentam os trabalhos que referem ter encontrado relação entre diabetes mellitus e perda auditiva e a Tabela 2 apresenta os trabalhos que não encontraram tal relação.
D) Correlação entre alterações genéticas, diabetes mellitus e perda auditiva
É conhecido que a deficiência auditiva pode, também, ter sua origem em mutações genéticas que podem ser congênitas ou adquiridas, ocorrerem em genes nucleares e mitocondriais e apresentarem quadros sindrômicos ou não sindrômicos. As mutações do DNA mitocondrial são transmitidas pela linhagem materna, porém podem ocorrer mutações espontâneas. Quanto à fisiopatogenia dessa deficiência auditiva ainda há muitas discussões e várias teorias19. Yamasoba et al20 (1996) apresentaram a seguinte teoria: alteração no DNA mitocondrial '+alteração na síntese protéica mitocondrial'+alteração na fosforilação oxidativa '! redução na formação de ATP '+alteração das bombas iônicas '+alteração no balanço de potássio, sódio e cálcio '+morte celular.
Em 1989, uma particular árvore genealógica foi estudada por Lemkes et al.21, no qual nove crianças de mães com diabetes mellitus também exibiam o diabetes. Foi observado uma perda auditiva coincidente, de variável severidade, em cada diabético individualmente. Quando a terceira geração dessa linhagem foi considerada, verificou-se que o diabetes e a perda auditiva estava presente somente em crianças de mães afetadas. Essa observação sugeriu fortemente que a herança é exclusivamente materna, o que é uma característica particular das doenças associadas com mutação do DNA mitocondrial.
Newkirk et al.22 (1997) relataram, em seu estudo prospectivo, a prevalência do diabetes mellitus e surdez de herança materna na população de diabéticos do Newcastle Hospital. Ressaltaram ser essa associação um novo subtipo de diabetes e que resulta da substituição de uma adenina por uma guanina na posição 3243 do gene mitocondrial tRNALeu(uur). Lembraram que esta síndrome era originalmente identificada como causa da síndrome MELAS (miopatia, encefalopatia, acidose lática e episódios repetidos de acidente vascular cerebral) e que a perda auditiva sensorioneural aparece como um sintoma adicional em cerca de 70% dos casos.
Em alguns casos, a mesma mutação pode causar fenótipos diferentes como no caso do gene tRNAleu, a substituição do nucleotídeo adenina pelo guanina no locus 3243 pode causar três fenótipos diferentes: o quadro de oftalmoplegia externa crônica progressiva, o diabetes e a surdez de origem materna e a síndrome MELAS. Clinicamente, o quadro de diabetes mellitus e surdez de herança materna é caracterizado por: diabetes mellitus insulino-dependente, que pode ser não insulino-dependente inicialmente, porém geralmente evolui para insulino-dependente porque a alteração mitocondrial altera a secreção de insulina pelo pâncreas; os pacientes são magros e com idade inferior a 40 anos e a perda auditiva é do tipo neurossensorial progressiva19.
Fowler et al.23 (1999) descreveram a síndrome de Diadmoad ou síndrome de Wolfram também como conseqüência de mutações no DNA mitocondrial, caracterizada por diabetes insipidus e mellitus, atrofia óptica e perda auditiva do tipo sensorioneural, de início na infância.
DISCUSSÃO
Como apresentado na revisão da literatura, não há evidências suficientes para estabelecer de forma sólida a relação entre diabetes mellitus como causa de perda auditiva. Não há um consenso em todos o aspectos desse tema: audiológico e histopatológico. A experiência clínica, em muitos trabalhos, mostra relação direta entre perda de audição e diabetes, como citado na Tabela 1. Porém, há outros trabalhos com grande número de indivíduos e bem estruturados, que negam a existência de tal associação (Tabela 2).
Tabela 1. Trabalhos que encontraram relação entre diabetes mellitus e perda auditiva
O acometimento dos vasos que irrigam a orelha interna e as alterações que ocorrem na estria vascular em pacientes diabéticos são fatos irrefutáveis e comprovados por diversos autores, que acreditam na relação entre perda de audição e diabetes, tais alterações são fortes indícios que o diabetes possa causar perda auditiva10,13-15. Porém, há autores que não acreditam nessa relação24.
Alguns estudos indicam que o decréscimo na acuidade auditiva, que é similar ao apresentado na presbiacusia, é maior do que o esperado pela idade, em pacientes mais idosos e diabéticos8,10,12,22,24. Segundo eles, é mais provável uma associação de fatores que levariam a uma perda auditiva, como conseqüência da alteração vascular provocada pelo diabetes mellitus.
Tabela 2. Trabalhos que não encontraram relação entre diabetes mellitus e perda auditiva
Até 1960, havia três teorias sobre a patogênese da perda auditiva causada por diabetes: a neuropatia, a angiopatia e a associação das duas. Hoje, há importantes razões para se acreditar que a angiopatia encontrada em diabéticos contribui com as maiores evidências para a disacusia. A favor desta hipótese estão os achados histopatológicos das lesões microvasculares na orelha interna, como o espessamento da membrana basal dos capilares da estria vascular, assim como o fato de serem bem conhecidas as alterações vasculares difusas provocadas pelo diabetes mellitus4,13-15,25.
Sabe-se que a dificuldade maior na realização do estudo da orelha interna está relacionada à dificuldade de acesso para avaliação histológica, especialmente em humanos. Além disso, os passos para a preparação do material também podem causar artefatos, provocando interpretações errôneas. A localização da circulação da orelha interna dificulta o estudo da sua homeostase, assim como das conseqüências dos seus distúrbios metabólicos. Outros fatores que podem induzir a resultados estatísticos errôneos são: uso de populações diferentes para comparação, falta de um bom grupo controle, necessidade de estudos longitudinais (devido ao fato que nos estudos transversais não é possível saber, muitas vezes, se o diabetes mellitus precede a perda auditiva ou vice-versa). Outro aspecto importante é o tamanho dos grupos estudados e o imenso número de variáveis como: outras doenças, uso de drogas, exposição a ruído, alterações genéticas. É possível que essas sejam as razões dos resultados muitas vezes discrepantes entre autores que realizaram estudos semelhantes.
Finalmente, observou-se o interesse crescente das deficiências auditivas causadas por alterações genéticas, muitas delas relacionadas a mutações do DNA mitocondrial. Elas correspondem a 0,5% a 1% de todas as deficiências auditivas de origem genética, podendo estar ou não associadas a quadros sindrômicos. Um dos quadros sindrômicos é o diabetes mellitus associado à surdez de herança materna correspondendo a 1,5% de todos os casos de diabetes no Japão e na Holanda19.
A investigação das causas genéticas ultimamente tem sido a resposta para várias dúvidas e para resultados discrepantes.
COMENTÁRIOS FINAIS
À luz dos conhecimentos atuais, há indícios que o diabetes mellitus possa causar perda auditiva, porém não se pode afirmar que exista correlação nítida de causa e efeito. Sabe-se que uma série de variantes pode favorecer a associação entre as duas doenças, mas são necessários estudos mais criteriosos a fim de estabelecer o verdadeiro papel desses fatores. Como foi visto, diabetes e perda auditiva poderiam ser componentes dependentes entre si, ou até componentes de uma síndrome genética e não dependentes entre si.
De acordo com os estudos analisados, pode-se concluir que muitas questões poderão ser esclarecidas por meio de estudos longitudinais, multicêntricos, com grande número de pacientes e critérios rígidos de inclusão e exclusão.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Albernaz PLM. Doenças metabólicas da orelha interna. RBM - Otorrinolaringologia 1995; 1: 18-22.
2. Chacra AR. Diabetes mellitus. In: Prado FC, Ramos já, Borges dr, Rothschild hA, eds. Artes Médicas. Tratado de Atualização Terapêutica. 20aed. São Paulo: Câmara Publicadora do Livro; 2001. p.375-89.
3. Robbins SL, Cotran RS, Kumar V. Pathologic Basis of disease (3rd ed.) Philadelphia: W.B. Sauders Co.; 1991. p.982-3.
4. Makishima K, Tanaka AK. Pathological changes of the inner ear and central auditory pathway in diabetes. Ann Otol Rhinol laringol 1971; 80(2): 218-28.
5. Taylor IG, Irwin J. Some audiological aspects of diabetes mellitus. J Laringol Otol 1978; 92(2): 99-113.
6. Nageris B, Hadar T, Feinmesser M, Elidan J. Cochlear histopathogic analysis in diabetic rats. The American Journal of Otology 1998; 19: 63-5.
7. Friedman SA., Schulman RH, Weiss S. Hearing and diabetic neuropathy. Arch Intern Med 1975; 135: 573-6.
8. Miller JJ, Beck L, Davis A, Jones DE, Thomas AB. Hearing loss in patients with diabetic retinopathy. Am J Otolaryngol 1983; 4(5): 342-8.
9. Tay HL, Ray N, Ohri R, Fronntko NJ. Diabetes mellitus and hearing loss. Clin Otolaryngol 1995; 20: 130-4.
10. Jorgensen MB, Buch NH. Studies on inner-ear and cranial nerves in diabetes. Acta Otolaringol. (Stockh.) 1961; 107: 179-82.
11. Camisasca L. L'esame dell'apparato cochleo-vestibulare nel diabete mellito. G Sci Med 1950; 5: 45-9.
12. Dalton DS, Klein R, Klein BEK, Moss SE, Cruickshanks KJ. Association of NIDDM and hearing loss; Diabetes Care 1998; 21(9): 1540-4.
13. Costa OA. Inner ear pathology in experimental diabetes. The Laryngoscope 1967; LXXVII: 68-75.
14. Smith TL, Raynor E, Prazma J, Buenting JE, Pillsbury HC. Insulino-dependent diabetic microangiopathy in the inner ear. J. Laringol Otol 1995; 105: 236-40.
15. Raynor EM, Carrasco VN, Prazma J, Pillsbury HC. An assessment of cochlear hair - cell loss in insulin - dependent diabetes mellitus diabetic and noise-exposed rats. Arch Otolaryngol Head and Neck Surg 1995; 121: 452-6.
16. Triana RJ, Suits GW, Garrison S, Prazma J, Brechtelsbauer B, Michaelis OE, Pillsburg HC. Inner ear damage secondary to diabetes mellitus. Arch Otolaryngol Head and Neck Surg 1991; 117: 635-40.
17. Mcquen CT, Baxter A, Smith TL, Raynor E, Yoon SM, Prazma J, Pillsburg HC. Non-insulin-dependent diabetic microangiopathy in the inner ear. The Journal of Laryngology and Otology 1999; 113: 13-8.
18. Williamson JR, Killo C. Capillary basement membrane disease in diabetes mellitus. Diabetes 1977; 26: 65.
19. Kakarlapudi V, Sawyer R, Staecker H. The Effect of Diabetes on Sensorioneural Hearing Loss. Otology & Neurotology 2003; 24(3): 382-6.
20. Yamasoba T, Yoshimoto O, Tsukuda K, Nakamura M, Kaga K. Auditory findings in patients with maternally inherit diabete transfer RNAleu(uur) gene. Laryngoscope 1996; 106: 49-53.
21. Lemkes HHPJ, Vijlder M, Struyvnberg P, Kamp JJP, Frolich. Maternal inherited diabetes-deafness of the young. A new mitocondrial syndrome. Diabetologia 1989; 32(7): 509A.
22. Newkirk JE, Taylor RW, Howell N, Bindoff LA,Chinnery PF, Alberti K, Turnnbuill DM, Walker M. Maternally inherited diabetes and deafness: prevalence in a hospital diabetic population. Diabetic med 1997; 14(6): 457-60.
23. Fowler PD, Jones NS. Diabetes and hearing loss. Clin Otolaryngol 1999; 24(1): 3-8.
24. Axellson A, Fagerberg SE. Auditory function in diabetics. Acta Otolaryngol. 1968; 66: 49-64.
25. Marulo T. Perceptive hypoacusias in diabetes mellitus. Rev Laryngol Otol Rhinol 1975; 95(5) Supl. 6: 253-71.
26. España AR., Birrun O, Lorente J, Trassera J. Hearing and diabetes. ORL J Otorhinolaringol Relat Spec 1995; 57(6): 325-7.
27. Jáuregui RK, Domingues RB, Ibarra AO, Gonzales BD. Ver Invest Clin 1998; 50(2): 137-8.
28. Carvalho MFP, Ribeiro FAQ. As deficiências auditivas relacionadas às alterações do DNA mitocondrial. Rev Bras Otorrinolaringol 2002; 68(2): 268-75.
29. Cullen JR, Cinnamond MJ. Hearing loss in diabetics. The journal of Laryngology and Otology 1993; 107: 179-82.
30. Tota G, Bocci G. Audiometric examinations in diabetic retinopathy. Riv Oto-neuro-oftal 1965; 491-508.
31. Ferrer JP, Birrun O, Lorent J, Conget JI, España R, Esmaltjs E, Gomis R. Auditory function in young patients with type 1 diabetes mellitus. Diabetes Res Clin Pract 1991; 11(1): 17-22.
32. Profazio A, Barravelli P. La funzione auditiva nel diabete. Otorinolaring Italiana 1959; 28(2): 103-11.
33. Strauss P, Schneider K, Terriuolo V, Sanches B. Laringol Rhinol. Inner ear and diabetes mellitus studies on 660 patients. Otol 1982; 61(6): 331-8.
1 Médica Otorrinolaringologista; Professora auxiliar do Curso de Medicina da Universidade Estadual Santa Cruz; Aluna do curso de
Pós Graduação em Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
2 Professor Adjunto e Chefe do Departamento de Otorrinolaringologia da Faculdade de Ciências Médicas da Santa Casa de São Paulo.
Endereço para correspondência: Clicia Adriana Santos Maia - Av. Firmino Alves, 60 sala 205 Ed. Módulo Center Itabuna BA 45600-185.
Tel (0xx73) 613-0424/ 613-0218/ 91913870 - E-mail: clicia.adriana@terra.com.br
Artigo recebido em 26 de maio de 2004. Artigo aceito em 21 de março de 2005.