Ano: 1999 Vol. 65 Ed. 1 - Janeiro - Fevereiro - (6º)
Seção: Artigos Originais
Páginas: 50 a 57
Disacusia Sensorioneural AutoImune: Avaliação Auditiva em Pacientes Portadores de Doença Auto-Imune.
Autoimmune Hearing Loss: Auditory Evoluation in Patientes with Autoimmune Diseases.
Autor(es):
Eliézia H. L. Alvarenga* ;
Oswaldo L. M. Cruz** ;
Marcos Grellet*** ,
José F. Colafêmina****.
Palavras-chave: perda auditiva sensorioneural, auto-imunidade
Keywords: hearing loss sensorineural, autoimmunity
Resumo:
Através da pesquisa da função auditiva em pacientes portadores de doenças auto-imunes (grupo P = 59 pacientes), procuramos observar se o ouvido interno seria igualmente susceptível de lesão, à semelhança dos diferentes órgãos que se mostram comprometidos durante a evolução natural da doença. A avaliação auditiva foi feita através de anamnese dirigida, exames otorrinolaringológico e otoneurológico, audiometria tonal liminar, pesquisa do reflexo estapediano e discriminação vocal, Analisamos os achados comparativamente ao grupo controle (C = 59 pessoas), que foi constituído de forma pareada, quanto à idade, cor, sexo e ocupação profissional. A presença de sintomas auditivos (zumbido, perda auditiva e tontura) foi significantemente maior no grupo P, e estatisticamente correlacionada com alterações audiométricas. Embora não tenha sido detectada diferença significativa no estudo isolado das alterações audiométricas, acreditamos que a presença de queixa auditiva sem expressão audiométrica possa representar o início da doença. Estas características sugerem que a disacusia neurossensorial auto-imune existe, e parece apresentar incidência baixa, mesmo entre pacientes com doenças auto-imunes sistêmicas bem estabelecidas.
Abstract:
By evaluating the auditory function we study the clinical behavior of sensorineural hearing loss of 59 patients (P) with autoimmune diseases to observe whether the inner ear is as susceptible to damage as the different organs that become involved during the natural course of the disease. The control group (C) consisted of 59 subjects matched for age, color, sex, and professional occupation. Auditory evaluation consisted of directed anamnesis, otolaryngologic and otoneurologic examination, threshold tone audiometry, determination of stapedial reflex, and vocal discrimination. The presence of auditory symptoms (tinnitus, hearing loss and dizziness) was significantly higher in the P group, and statiscally correlated with audiometric alteration. These features sugest that autoimmune sensorineural hearing loss does exist, although presents low incidence even among patients with well established autoimmune diseases.
![]()
INTRODUÇÃO
Disacusia neurossensorial auto-imune é uma doença caracterizada pela perda auditiva neurossensorial decorrente de reação imunológica direcionada contra antígenos próprios do ouvido interno. McCabe (16) (1979) foi o primeiro a sugerir a disacusia neurossensorial auto-ímune como entidade nosológica, o que é considerado marco inicial no campo da pesquisa em otoimunologia. Entretanto, devemos salientar que o termo auto-imune inclui as disacusias desencadeadas por processos imuno-mediados e por auto-imunidade.
As doenças auto-imunes (DAI) podem ser classificadas - em: doenças órgão-específicas - anticorpos dirigidos aos antígenos de apenas um órgão do corpo, como a tireoidite de Hashimoto; e doenças não órgão-específicas - anticorpos dirigidos aos antígenos que estão disseminados pelo corpo, desenvolvendo lesões que caracterizam a doença sistêmica, como o lúpus eritematoso sistêmico. O ouvido interno pode se situar dentro destes grupos como doença órgão-específica ou, mais comumente, como órgão comprometido dentro da forma sistêmica (10, 11, 14, 21).
Na revisão da literatura, vários trabalhos têm mostrado associação de DAI e disacusia neurossensorial (DNS), como na poliarterite nodosa (9,19,20,25); no lúpus eriternatoso sistêmico(19,20.2S); na artrite reumátóide(18, 19, 20) ; na vasculite(19); na arterite de células gigantes (12); na arterite temporal(19); na granulomatose de Wegener(14,15,19) na colite ulcerativa12; na síndrome de Sjogren(19); na síndrome de Behçet(19); na doença mista do tecido conjuntivo (19,20); na amiloidose(20); na policondrite recidivante(14, 19, 25) na sarcoidose(14) na espondílite anquilosante5; na síndrome de Cogan(19); na doença de Berger - nefropatia por IgA(2,3).
Entre os mecanismos causadores da disfunção audiosvestibular, têm-se considerado as reações ímunológicas humoral, celular ou multifatorial (6, 7, 8, 22, 23).
O índice de comprometimento do ouvido interno nas DAI sistêmicas é variável. McAdanl e colaboradores (1976, citado por Stephens e colaboradores)'9 mostraram que, na policondrite recidivante, a incidência de doença do ouvido interno é de 46%. Doig e colaboradores (1971, citado por Stephens e colaboradores)(19), encontraram DNS em quase 50% dos pacientes cone artrite reumatóide. Os demais trabalhos da literatura revisados mostraram a presença de DNS em pacientes com DAI sistêmicas, mas não citaram a incidência1, 3, 5, 12, 14, 15, 18, 20.
McCabe16,17 caracterizou o quadro clínico de disacusia neurossensorial auto-imune (DNSAI) como perda auditiva neurossensorial, freqüentemente bilateral, assimétrica e progressiva, associada a sintomas vestibulares (vertigens, instabilidade, ataxia ou simulação da síndrome de Ménière) com resposta vestibular reduzida. Sintomas corno a plenitude auricular e zumbidos, ocasionalmente, estavam presentes, e raramente se notou destruição tecidual do ouvido médio e externo e paralisia facial.. Notou, também, que surdez súbita, flutuante, ou de evolução protraída, uni ou bilateral, não afasta a etiologia auto-imune, Hughes e colaboradores10 mostraram que a disfunção vestibular auto-imune ocorre comumente paralela à disfunção auditiva.
Hughes e colaboradores10 e Harris9 observaram que 20 a 30% dos pacientes com perda auditiva ele caráter auto-imune apresentam manifestações definidas de DAI sistêmica.
Na série de McCabe17, a idade dos pacientes variou de 19 a 42 anos, sem diferença quanto ao sexo. Hughes e colabora dores10 relataram que a perda auditiva pode começar em qualquer idade, sendo mais comum em mulheres de meia idade.
As curvas audiométricas também não apresentam característica padrão na DNSAI, podendo ser ascendentes ou descendentes17. A discriminação vocal pode ser, desproporcionalmente, boa ou má, quando comparada ao limiar tonal puro17. Na eletronistagrnografia, pode ser observada redução da resposta calórica vestibular bilateral10.
A investigação imunológica pode ser realizada através de testes antígeno não específicos10, 11, 21. Entre eles: velocidade de hemossedimentação, proteína C reativa, irnunocomplexos circulantes, análise de C1q ligante, complemento hemolítico total (CH50), crioprecipitação, imunoglobulinas (IgM, IgG, IgA), fator reumatóide, auto-anticorpos (fator antinúcleo, autoanticorpos músculo liso, fator antiperinuclear), anticorpo anticolágeno II6,25 e, ainda, microbiologia (vírus Epstein Baar, citomegalovírus, vírus da hepatite B, toxoplasrnose e sífilis). Pode ser avaliada também através de testes antígeno-cocleares específicos10,11,21 incluindo transformação linfocitária, inibição da migração linfocitária, análise imunoenzimática (Elisa) e imunofluorescência de anticorpos anticóclea.
Como sugerido por McCabe16,17, o diagnóstico de DNSAI é baseado no curso clínico relativamente distinto, testes laboratoriais imunológicos e resposta terapêutica. Elabora o guia original de McCabe seja ainda muito útil, algumas variações têm sido observadas11.
Realizamos este trabalho entendendo que o diagnóstico da DNSAI é fundamentalmente clínico, não sendo possível a comprovação histopatológica invivo. Os exames laboratoriais apenas reforçam o diagnóstico. Além disso, pacientes com DAI sistêmicas representam grupo de risco para desenvolver DNSAI, por já mostrarem distúrbio causado pela auto-imunidade.
Os objetivos deste trabalho foram: 1) estudar o comportamento clínico da DNSAI, através da pesquisa da função auditiva nesses pacientes com DAI bem estabelecidas; 2) observar se o ouvido interno é igualmente susceptível de lesão como os diferentes órgãos que se mostram comprometidos durante a evolução natural da doença.
MATERIAL E MÉTODOS
Para o estudo da incidência da DNS em portadores de DAI, selecionamos pacientes com quadro clínico estabelecido, com acompanhamento pelo ambulatório do Departamento de Clínica Médica, das disciplinas de Imunologia Clínica e Nefrologia do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto. O estudo estendeu-se de agosto de 1992 a fevereiro de 1993.
A amostra totalizou 59 pacientes (P), sendo 20 portadores de artrite reumatóide; 17, de lúpus eritematoso sistêmico; 4, espondilite anquilosante; 2, esclerose sistêmica progressiva; 7, doença de Berger (nefropatia por IgA); 5, doença mista do tecido conjuntivo; e 4, doença de Reiter. Quarenta e três pacientes eram do sexo feminino; e 16, do sexo masculino; 48, de cor branca; 9, mulata; e 2, negra. A idade variou entre 18 a 48 anos, com média de 34 anos, com tempo de seguimento médio de 74 meses, e tempo de evolução da doença médio de 125 meses. O grupo controle (C) foi constituído de forma pareada quanto à idade, cor, sexo e ocupação profissional.
Foram excluídos do estudo pacientes que apresentavam fatores de risco para disacusia, como trauma acústico, história familiar de DNS, sífilis, e, ainda, qualquer doença da orelha média. Quanto à ototoxicidade, foram excluídos apenas pacientes que haviam utilizado aminoglicosídios e diuréticos de alça (Furosemida, Bumetanida e Ácido Etacrínico). Foram mantidos os pacientes que haviam utilizado antiinflamatórios, antimaláricos e citostáticos em doses e períodos variáveis, sem história clínica de ototoxicidade.
Os pacientes e amostras controle foram analisados através de anamnese dirigida (zumbido, perda auditiva, tontura e plenitude auricular), exame otorrinolaringológico, exame neurológico (exame da marcha, Romberg, Romberg sensibilizado, Untemberg, observação de nistagmo, pares cranianos e coordenação motora), avaliação auditiva e teste sorológico para diagnosticar lues. A avaliação auditiva foi feita utilizando o audiômetro clínico MA 31, VE Kombinat Pracitronic, Dresden, Stammbetrieb, em câmara com isolamento acústico. A pesquisa dos reflexos estapedianos contralaterais foi realizada através do impedanciômetro Dicton, modelo ZA 42.
A audiometria tonal, via aérea e óssea, foi realizada, com a pesquisa das freqüências de 0,25, 0,50, 1, 2, 4 e 6 KHz. Os limiares tonais foram analisados isoladamente para cada lado e para cada freqüência, e comparados com suas respectivas amostras controle.
A pesquisa do reflexo estapediano, nas freqüências de 0,25, 0,5, 1, 2, 4 e 6 KHz, foi feita para complementar o estudo audiométrico.
A discriminação vocal foi testada através da emissão de uma lista de 50 palavras, foneticamente balanceadas.
RESULTADOS
Como ainda não existe um consenso para se classificar perda auditiva utilizando apenas freqüências selecionadas, optamos pela análise do limiar tonal puro de cada freqüência isoladamente, considerando audição normal de -10 a 25 dB.
O par de pacientes foi considerado como unidade experimental e estudado nas seguintes variáveis: queixas clínicas, alterações audiométricas e presença simultânea de alguma queixa clínica e alguma alteração audiométrica, uni ou bilateral, em qualquer freqüência. O objetivo foi comparar as proporções dos grupos controle (C) e portadores de DAI de base (P) com relação a cada uma das variáveis estudadas. O teste estatístico utilizado para a comparação foi o teste de McNemar. Consideram-se as proporções significativamente diferentes no nível de 0,05, se o teste apresentar valor de p < 0,025 ou p> 0,975.
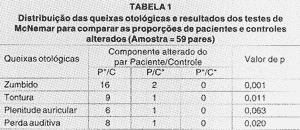
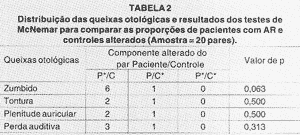
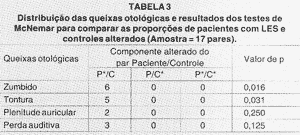
As Tabelas 1, 2 e 3, consecutivamente, referem-se aos resultados dos testes relativos ao estudo das queixas clínicas, da amostra total, da amostra com artrite reumatóide (AR) e da amostra com lúpus eritematoso sistêmico (LES) com seus respectivos controles. As abreviações abaixo das Tabelas 2 e 3 seguem a mesma descrição feita abaixo da Tabela 1.
Encontramos diferença estatisticamente significante (DES) na análise dos zumbidos, tontura e perda auditiva no grupo P em relação ao grupo C.
Não observamos DES na análise das queixas clínicas otológicas entre o grupo com AR e seu grupo controle. Observamos DES apenas quanto à análise do zumbido no grupo portador de LES em relação ao seu grupo controle. Otoscopia alterada foi encontrada em apenas um paciente do grupo P, com discreta retração da membrana timpânica bilateralmente. Com as avaliações posteriores, pôde se constatar ser decorrente de provável disfunção tubária.
O exame otoneurológico mostrou-se dentro da normalidade nos dois grupos (P e C).
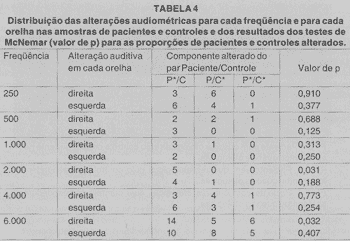
A análise dos audiogramas foi feita separadamente para cada lado e cada freqüência, considerando apenas a busca de DNS, ou seja, queda dos limiares da via óssea acima de 25 dB, e ausência de diferença (GAP) entre via aérea e óssea, maior ou igual a 10 dB (Tabela 4).
Na análise audiométrica, notamos que os pacientes do grupo P apresentam alteração auditiva, mas não houve DES entre os dois grupos. Observamos que o número de pares discordantes (ou seja, paciente com alteração audiométrica cujo controle correspondente não apresentou alteração audiométrica, ou paciente sem alteração audiométrica cujo controle correspondente apresentou alteração audiométrica) na amostra é muito pequeno, o que dificulta observar significância no teste estatístico empregado.
Conforme a Tabela 4, podemos observar que alteração audiométrica foi mais encontrada na freqüência de 6.000 Hz nos dois grupos (sem DES entre os dois), e as alterações audiométricas na área da fala (500, 1.000 e 2.000 Hz) foram predominantemente no grupo P, mas DES foi encontrada apenas na análise unilateral esquerda.TABELA 1
P*/C - Paciente com queixas otológicas cujo controle correspondente não apresentou queixas otológicas.
P/C* - Paciente sem queixas otológicas cujo controle correspondente apresentou queixas otológicas.
P*/C* - Paciente com queixas otológicas cujo controle correspondente apresentou queixas otológicas.
TABELA 2
TABELA3
TABELA 4
P*/C - Paciente com alteração audiométrica cujo controle correspondente não apresentou alteração audiométrica
P/C* - Paciente sem alteralção audiométrica cujo controlo correspondente apresentou alteração audiométrica.
P*/C* - Paciente com alteralção audiométrica cujo controle correspondente apresentou alteração audiométrica.
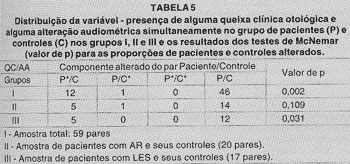
TABELA 5
P*/C - Paciente com alteração audiométrica e queixa otológica (simultâneas) cujo controle correspondente não apresentou alteração audiométrica e queixa otológica (simultâneas).
P/C* - Paciente sem alteração, audiométrica e queixa otológica (simultâneas) cujo controle correspondente apresentou alteração audiométrica e queixa otológica (simultâneas).
P*/C* - Paciente com alteração audiométrica e queixa otológica (simultâneas) cujo controle correspondente apresentou alteração audiométrica e queixa otológica (simultâenas).
P/C - Paciente e controle sem alteração audiométrica e queixa otológica (simultâneas)
QC - Queixa clinica otológica.
AA - Alteração audimétrica (ou seja, limiar auditivo maior que 25 dB em uma ou mais freqüências, uni ou bilateral).
Através da análise dos achados audiométricas alterados na área da fala, observamos que os mesmos pacientes apresentaram alteração em 4.000 e/ou 6.000 Hz ipsilateral.
A análise estatística considerando as alterações audiométricas nos grupos portadores de AR e LES (com seus respectivos controles), isoladamente, também não mostrou DES.
Na pesquisa da discriminação vocal e recrutamento de Metz não houve DES entre os dois grupos analisados, em ambas as orelhas.
Analisamos, como mostra a Tabela 5, se a proporção do grupo P com alteração audiométrica e queixa clínica otológica simultaneamente é a mesma do grupo controle para a amostra total (59 pacientes com DAI), amostra com AR (20 pacientes) e amostra com LES (17 pacientes) e seus respectivos controles. Encontramos DES no grupo 1: a proporção do grupo P, com presença simultânea de alguma queixa clínica otológica e alguma alteração audiométrica foi maior que a do grupo C, e não observamos nenhuma DES em relação ao estudo desta mesma variável nos grupos com AR (11) e LES (III).
DISCUSSÃO
Embora várias alterações da orelha interna possam ser causadas por reações imunológicas, apenas recentemente sua imunologia tem sido melhor compreendida, através de pesquisa clínica.
Como já referido, McCabe16,17 foi o primeiro a sugerir a relação clínica de DNS com DAI. Apartir de 1979, pode se observar um maior número de publicações na literatura mostrando que a hipótese diagnostica de causa auto-imune tem sido aventada em muitos casos de DNS sem causa aparente9,10,21, além dá tentativa de se correlacionar achados laboratoriais com a provável causa auto-imune5,7,10,21,24 ;observar o envolvimento do ouvido interno em muitas DAI sistêmicas3,12,18,19 e, também, estudar os resultados da terapêutica 10,14,16,17.
A peça fundamental no diagnóstico de DNSAI é a história clínica, visto que ainda não existem testes laboratoriais definitivos17.A prova histopatológica ainda não é possível, uma vez que a orelha interna é inacessível para biópsia tecidual, Bowman e Nelson4 mostraram que a associação entre DNSAI e o HLACW7 poderá ser um marcador diagnóstico que facilitará a seleção dos pacientes para tratamento.
Como já salientamos, a DNSAI pode se apresentar de diversas formas, como perda auditiva súbita, progressiva, flutuante, uni ou bilateral, associada ou não às queixas de plenitude auricular, zumbidos e sintomas vestibulares 10,16,17 . Embora possa apresentar inicialmente sintomas otológicos isolados, é mais comumente parte de uma doença sistêmica imunomediada10,14,20. Stephens e colaboradores19, através de estudo clínico, mostraram alta incidência de sintomas cócleo-vestibulares 13/17em pacientes com DAI. E, mesmo assim, trabalhos na literatura que investigam grupos de risco (pacientes com DAI de base) para desenvolver DNS não tentaram correlacionar história clínica otológica aos seus achados da investigação audiológical1,18,19.
Nosso trabalho, em conformidade com o de McCabe 16,17também mostrou que perda auditiva e tontura foram as queixas mais freqüentes (DES entre grupo P e C), e observamos ocasionalmente a queixa de plenitude auricular (nenhuma DES foi vista entre os dois grupos), mas os zumbidos foram mais freqüentes no grupo P em relação ao grupo C. O mesmo estudo acima, em pacientes portadores de AR, não evidenciou DES entre o grupo com AR e C. Nos pacientes portadores de LES observamos DES apenas quanto à análise dos zumbidos.
Quanto aos achados audiométricos, analisados separadamente da anamnese, não observamos DES entre o grupo P e seu grupo C, nem no estudo dos grupos AR e LES. Talvez o pequeno número de pares discordantes, ou seja, paciente com alteração audiométrica cujo controle correspondente não apresentou alteração audiométrica, ou paciente sem alteração audiométrica cujo controle correspondente apresentou alteração audiométrica na amostra, dificulte o encontro de significância no teste estatístico. Outra explicação possível para este achado seria a ocorrência de alterações bioquímicas ou fisiológicas sem lesão anatómica, o que pode justificar a presença de queixas clínicas sem expressão audiométrica.
Nossos resultados quanto à análise da discriminação vocal e recrutamento de Metz mostraram-se dentro da normalidade, tanto no grupo P quanto no C, e não observamos alterações audiométricas consistentes em diferentes freqüências que nos permitissem classificar a perda auditiva e discutir sobre as curvas apresentadas, e compara-las aos achados de McCabe16,17. Quando estudamos a variável presença de alguma queixa clínica otológica e alguma alteração audiométrica (limiar auditivo maior que 25 dB em uma ou mais freqüências, uni ou bilateral) simultaneamente, observamos que a proporção de pacientes do grupo P apresentou DES em relação ao grupo C. No estudo desta mesma variável nos grupos AR e LES (em relação aos seus grupos controles), não observamos DES. Parece-nos importante esse achado, uma vez que, havendo queixa otológica, esta não pode ser desprezada, devendo ser sempre complementada através do estudo audiométrico, e ter um seguimento clínico apropriado. Essa queixa pode ser indicativa de uma fase inicial da degeneração auditiva.
Samara e colaboradores18 estudaram 18 pacientes com AR graus I a IV, do ponto de vista otoneurológico, utilizando-se da audiometria tonal, impedanciometria e recrutamento. Os resultados foram interpretados mediante quadro clínico geral, faixa etária, e estudo estatístico, rias sem relação com grupo controle. Concluíram que, embora não se tenha conseguido estabelecer qualquer relação entre intensidade das manifestações articulares e disfunções do ouvido médio, a ocorrência de evidências de disacusia latente (audiometria normal e recrutamento presente) e neurossensorial (perda auditiva para agudos e recrutamento presente), em 66,6% dos pacientes, não vinculados ao grupo etário ou outras condições mórbidas, parece sugerir uma forma de agressão reumatóide às estruturas cocleares. Os nossos achados são discordantes desses autores, pois encontramos alterações audiométricas (neurossensoriais) no grupo AR; mas DES não foi encontrada em relação ao grupo C.
Atra e colaboradores1 realizaram estudos de audição em 30 pacientes com LES utilizando os mesmos critérios usados em nosso estudo, em relação ao grupo C e aos critérios de exclusão. Os resultados foram normais nos dois grupos, e concluíram que o LES e o tratamento medicamentoso desta doença de base não produziram alterações na audição. Em discordância com os achados de Atra e colaboradores, nossos resultados mostraram que os pacientes com LES apresentaram queixas de zumbidos, significativamente diferentes do grupo C. Encontramos também alteração audiométrica, mas não significativamente diferente do grupo C.
Apesar de contarmos, no grupo P, com pacientes que apresentaram critérios clínicos bem estabelecidos e longo tempo de evolução, inclusive seqüelas, uso de drogas com potenciais efeitos colaterais, alguns com comprometimento renal, não observamos incidência de alterações audiométricas maiores que no grupo C. Esse fato poderia significar que o ouvido interno apresenta fator de proteção adicional em relação aos demais órgãos na evolução das DAI. Talvez a sua pequena assa antigenica, a sua menor vascularização, as características e capilares cocleares não fenestrados13 e o desenvolvimento embrionário tardio possam explicar, em parte, esse menor envolvimento.
Acreditamos que alguns casos de perda auditiva flutuante, perda auditiva progressiva, surdez súbita ou doença de Mèniére de etiologia não definida poderão, num futuro próximo, ser incluídas no grupo de DNS de etiologia imunológica.
Por outro lado, nem todas as formas inexplicáveis de DNS progressiva ou surdez súbita deverão ser atribuídas às causas auto-imunes.
De todo modo, é importante orientar os portadores de DAI sistêmica quanto à possibilidade de o ouvido interno poder se tornar mais um órgão comprometido na evolução da doença de base, e propor que a avaliação audiométrica seja realizada periodicamente neste grupo, especialmente quando da existência de sintomas auditivos. Essa monitorização auditiva facilitaria a detecção precoce da DNS, e contribuiria também para o estudo da possível ototoxicidade provocada pela terapêutica da doença de base.
Finalmente, uma observação quanto aos casos de suspeita de DNSAI, numa fase de queixa clínica sem expressão audiométrica. Em nossa opinião, deve se iniciar o tratamento com corticosteróide ou imunossupressores quando exista suspeita clínica importante, podendo com isto reverter ou estabilizar o processo degenerativo da orelha interna ainda numa fase incipiente, prevenindo a surdez irreversível. A recuperação está diretamente relacionada à lesão coclear, mais especificamente às células ciliadas. Uma vez ocorrendo a morte dessas células, nem a imunossupressão restaurará a função auditiva. Em pacientes que apresentam lesão coclear definida, devemos considerar satisfatória a interrupção da progressão do quadro, o que ainda permitirá eventual reabilitação com prótese auditiva.
Pesquisas futuras deverão concentrar-se na melhor definição do paciente de risco, nos antígenos envolvidos e na imunoterapia específica, permitindo um diagnóstico mais objetivo e um tratamento mais eficiente.
CONCLUSÕES
1. A incidência das queixas clínicas de perda auditiva, zumbidos e tontura foi maior no grupo P que no C.
2. DES foi vista quanto à análise da variável - presença simultânea de queixa auditiva e alteração audiométrica no grupo P, e o estudo desta variável nos grupos com AR e LES (e seus controles), isoladamente, não mostrou DES.
3. A incidência das queixas clínicas otológicas no grupo com AR não mostrou DES quando comparadas com seu grupo C.
4. Na análise das queixas clínicas otológicas (perda auditiva, zumbido, tontura e plenitude auricular) no grupo com LES em comparação com C, encontrou-se DES apenas quanto ao zumbido.
5. Em relação às alterações na audiometria tonal liminar, não houve DES entre a amostra total (P) e o seu controle.
6. Alteração audiométrica foi encontrada principalmente na freqüência de 6.000 Hz na amostra total de pacientes (P) e no grupo C, tuas não houve DES entre eles.
INFERÊNCIAS
1.Mesmo entre os pacientes com DAI de base, a DNS apresentou baixa incidência
2. A presença de sintomas sugestivos de DNS não acompanhados por alterações audiométricas parece sugerir que a disfunção celular precede a morte celular.
REFERÊNCIAS BIBLIOGRÁFICAS
1. ATRA, E.; PONTES, P. A. L.; GOLDENBERG, J.; NOBREGA, J. L.; SATO, E. L; POLLAR, D. F. - Estudo da audição no lúpus eritematoso disseminado. Rev. Bras. Reumat., 23(5): 203-207, 1983.
2. BALLARDIE, F. W. & WILLIANS, S. - Autoimmunity in IgA nephropaty. Lancet, 1: 588, 1988.
3. BIZARRI, D.; DURANTI, E.; SASDELLI, M.; CASANOVA, S. - Familial IgA nephropaty and sensorineural deafness. Contrib. Nephrol., 80: 113-117, 1980.
4.BOWMAN, C. A. & NELSON, R. A. - Human leukocytic antigens in autoimmune sensorineural hearing loss. : 7-9, 1987.
5. BROOKES, G. B. - Immune complex-associated deafness: preliminary communication. J. R. Soc. Med., 78:47-55, 1985.
6. CRUZ, O. L. M.; MINITI, A.; COSSERMELLI, W.; OLIVEIRA, R. M. - Autoimmune sensorineural hearing loss: a preliminary experimental study. Am. J. Otol.,11(5): 342-346, 1990.
7. ELIES, W. & PLESTER, D. - Immunological findings in various sensorineural hearing disorders. In: Veldman, J. E. & Mccabe, B. F. - Oto-immunology. Amsterdan, KuglerPub1.,1987,157-161.
8. HARRIS, J. P. - Immunology of the inner ear: evidence of local antibody production. Ann. Otol. Rbinol. Laryngol., 93:157-162, 1984.
9. Harris, J. P. Autoimmune or immune-mediated causes of deafness. West. J. Med., 154: 719-720, 1991.
10. HUGHES, G. B.; KINNEY, S. E.; BARNA, B. P.; HAMID, M. A.; CALABRESE, L. H. - Autoimmune vestibular dysfunction: preliminary report. Laryngoscope, 95 893-897, 1985.
11. HUGHES, G. B. & BARNA, B. P. -Autoimmune inner ear disease: fact or fantasy? Adv. Oto-rbíno-Larngol., 46. 82-91, 1991.
12. JACOB, A.; LEDINGHAM,J. G.; KERR, A.1. G.; FORD, M. J. - Ulcerative colitis and giant cell arteritis associated with sensorineural deafness. J. Laryng. Otol., 104: 889-890, 1990.
13. Juhn, S. K.; Rybak, L. P.; Prado, S. - Nature of blood-labyrinth barrier in experimental conditions. Ann. Otol., 9Q 135-141,1981.
14. KANZAKI, J. & O-UCHI, T. - Circulating immune complexes in steroid-responsive sensorineural hearing loss and the long-term observation. Acta Otolaryngol., (supPO393: 7784, 1983.
15. LEONE, C. A.; FEGHALI, J. G.; LINTHICUM, F. H. - Endolymphatic sac: possible role in autoimmune sensorineural hearing loss. Ann. Otol. Rhinol. Laryngol., 93:208-209,1984.
16. McCABE, B. F. - Autoimmune sensorineural hearing loss. Ann. Otol., 88. 585-589, 1979.
17. McCABE, B. F. -Autoimmune inner ear disease: clinical varieties of presentation. In: Veldman, J. E. & Mccabe, B. F. - Otoimmunology. Amsterdan, Kugler Publ., 1987,143-148.
18. SAMARA, A. D.; MARQUES-NETO, J. F.; ERMEL, M. H.; MAUDONNET, O. -Audição na artrite reumatõide: recursos da impedanciometria e audiometria tonal. Rev. Bras. Reumat., 2 86-90, 1975.
19. STEPHENS, S. D. G.; LUXON, L.; HINCHCLIFFE, R. - Immunological disorders and auditory lesions. Audiology, 21:128148, 1982.
20. VELDMAN, J. E.; ROORD, J. J.; O'CONNOR, A. F.; SHEA, J. J. -Autoimmunity and inner ear disorders: an immune-complex mediated sensorineural hearing loss. Laringoscope, 94:501-507, 1984.
21. VELDMAN, J. E. - Immune-mediated inner ear disorders. New syndromes and their etiopathogenesis. In: Veldman, J. E. & Mccabe, B. F. - Oto-immunology, Amsterdan, Kugler Publ., 1987,125-142.
22. WOOLF, N. K.; HARRIS, J. P. - Cochlear pathophysiology associated with inner ear immune responses. Acta Otolaryngol. (Stockl), 102: 353-364, 1986.
23. YOO, T. J.; TOMODA, K.; HERNANDEZ, A. D.; - Type II collagen-induced autoimmune inner ear lesions in guinea pigs. Ann. Otol. Rbinol. Laryngol., 93 (suppl. 113). 3-5, 1984c.
24. YOO, T. J.; FLOYD, R.; ISHIBE, T.; SHEA, J. J.; BOWMAN, C. - Immunoogy testing of certain ear diseases. Am. J. Otol., G 96-100, 1985.
25. YOO, T. J.; PAPARELLA, M. M.; SCHACHERN, P. A.; ALLEVA, M. - Histophatology of sudden hearing loss. Laryngoscope, 100: 707-715, 1990.
*Mestre em Otorrinolaringologia pela Faculdade de Medicina de Ribeirão Preto, da Universidade de São Paulo.
** Professor Associado do Departamento de ORL da Universidade Federal de São Paulo - UNIFESP - EPM.
*** Professor Associado do Departamento de ORL e Oftalmologia do HC de Ribeirão Preto, da USP.
**** Professor Doutor do Departamento de ORL e Oftalmologia do HC de Ribeirão Preto, da USP.
Trabalho realizado no HC de Ribeirão Preto /SP. Apresentado como Tese de Mestrado ao Departamento de Otorrinolaringologia e Oftalmologia. Agraciado com menção honrosa do Prêmio Mário Ottoni de Rezende de Otorrinolaringologia de 1995, pela Associação Paulista de Medicina, em São Paulo /SP. Apoio da CAPES. Endereço para correspondência: Rua Diana, 183 /41 - Perdizes - 05019-000 São Paulo /SP. Artigo recebido em 7 de agosto de 1998. Artigo aceito em 13 de outubro de 1998.